单核钌配合物的合成、表征及抗肿瘤活性研究
张 燕,贾士芳
(太原科技大学 化学与生物工程学院,太原030021)
癌症是威胁人类健康的主要问题之一,所以研究其作用机理,寻找新的治疗方法和高效低毒的抗肿瘤药物一直是科学家们热衷研究的前沿课题[1-4]。自从顺铂作为第一个抗肿瘤药物后[5],小分子金属配合物作为抗肿瘤药物的研究便引起了人们极大的兴趣[6]。继金属铂配合物之后,发现一些钌的配合物也有较高的抗肿瘤活性,如NAMI和KP1019,其中KP1019型钌金属配合物现已进入临床Ⅰ期,其对Lewis肺癌和原发性直肠癌有明显抑制作用[7-8]。NAMI对肺癌非小细胞的研究已进入Ⅱ期临床阶段[9]。SATYANARAYANA 教 授[10]课 题 组 合 成了三 个含有 ptip[ptip= (2-(5-phenylthiophen-2-yl)-1H-imidazo[4,5-f][1,10phenanthroline]配体的吡啶钌配合物,其对Hela的IC50值依次为21.7,22.4和23.1μmol/L,它们的细胞毒性均与浓度呈线性关系。广东药学院刘云军老师课题组[11]也合成过一组单核钌配合物Ru1~3(结构如图1),分别测试了它们对A549,BEL-7402,MG-63和SKBR-3四种肿瘤细胞的细胞毒性。其中,Ru3对三种肿瘤细胞表现出比顺铂好的效果。
图1 Ru1~3的结构式Fig.1 Structure of Ru1~3
希夫碱是含有—CH■ N—结构的一类有机物,因其N原子上连有苯环而比较稳定。此类有机物结构多样,除含有碳氮双键外,通常还含有羟基等其它可提供孤对电子的基团,使其易与金属离子形成配合物,而且形成的配合物具有丰富的电子光谱和电化学性质,因此希夫碱及其配合物一直是炙手可热的研究对象[12-17]。基于这两点本文将金属钌与希夫碱配体反应,得到两个单核钌配合物,通过元素分析、红外光谱、电喷雾质谱和核磁氢谱对它们进行表征。此外,还对配合物做了紫外-可见吸收光谱和电化学测试。通过体外细胞实验方法研究了两个配合物对宫颈癌细胞(Hela)、乳腺癌细胞(MCF-7)和胃癌细胞(BGC823)三种肿瘤细胞的抗肿瘤活性。
1 实验部分
1.1 试剂与仪器
AL204分析天平(梅特勒-托利多仪器有限公司);DF-101B恒温磁力搅拌器(郑州长城科工贸有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);PE20005型元素分析谱仪(美国PE公司);Varian Mercury VX-300型核磁共振仪(瑞士Bruker公司);Nicolet38型傅立叶红外光谱仪(thermo electron corporation);TU-1901紫外-可见分光光度计(北京普析通用仪器有限责任公司);CHI630E型电化学工作站(上海辰华仪器有限公司);EPICS XL-MCL型酶标仪(美国 Beckman Coulter公司);EPICS XL-MCL型流式细胞仪(美国Beckman Coulter公司)。
三水合三氯化钌、2,2′-联吡啶(bpy)、4,4′-二氨基二苯硫醚、2-吡啶甲醛、硼氢化钠、氘代三氯甲烷、氘代二甲基亚砜等均为市售分析纯试剂,购于武汉申试化工有限公司,所有试剂都未经纯化直接使用。使用的水为蒸馏水。胎牛血清购自美国Gibco公司。
1.2 目标化合物的合成
1.2.1 合成路线图
配体及配合物的合成路线见图2.
1.2.2 配体及配合物的合成
配体L1的合成:称取4,4′-二氨基二苯硫醚1.08g(5mmol),2-吡啶甲醛1.30g(12mmol),溶于25mL甲醇溶液中,加热回流4h.反应结束后,将溶液冷却过滤,浓缩至干得油状物,用二氯甲烷处理产物,得黄绿色固体粉末,用乙醚多次洗涤,真空干燥,得产物1.83g,产率93%.分子式:C24H18N4S.元素分析实验值(%):C 73.07,H 4.59,N 14.25;计算值:C 73.10,H 4.57,N 14.21.1H NMR(300 MHz,CDCl3):8.72(d,J=4.2Hz,2H),8.61(s,2H),8.20(d,J=7.9Hz,2H),7.82(t,J=7.1Hz,2H),7.42(m,4H),7.28(m,6H).IR(KBr,cm-1):,1 563,1 476,1 432,199,1 018(vPh—S),826,769,730(δC—H).
配体L2的合成:称取配体L10.40g(1mmol),硼氢化钠0.10g(2.5mmol),溶于25mL甲醇中,加热回流4h,将产物浓缩至干,用乙醚多次洗涤,真空干燥,得浅黄色固体粉末0.33g,产率82.9%.分子式C24H22N4S.元素分析实验值(%):C 72.39,H 5.49,N 14.11;计算值:C 72.36,H 5.53,N 14.07.1H NMR(300MHz,CDCl3):8.57(d,J=4.3Hz,2H),7.64(t,J=7.6Hz,2H),7.36(m,4H),7.11(d,4H),6.58(d,J=8.4Hz,4H),4.85(s,2H),4.43(s,4H).IR(KBr,cm-1):3 378(vN—H),1 596,1 499,1 426,1 316(vC■C,vC■N,vC—N),1 083,1 043(vPh—S),823,752(δC—H).

图2 配体及配合物的合成路线Fig.2 Synthesis of the ligand and Ru complexes
配合物Ru1的合成:称取0.52g(1mmol)二水合二氯二联吡啶钌,0.35g(2.1mmol)硝酸银于250mL烧瓶中,加入100mL乙醇溶解,加热回流2 h,趁热过滤,除去氯化银沉淀,得到红棕色溶液。称取0.4g(1.0mmol)配体L1于250mL烧瓶中,将所得到的滤液加入烧瓶中,溶液在N2保护下回流12h.反应结束后,将溶液浓缩除去大量溶剂,将产物倒出,加入少量饱和高氯酸钠乙醇溶液,产物逐渐沉降出来,过滤,用乙醚洗涤,真空干燥。所得固体用少量的乙腈溶解,以乙腈和水混合溶剂作为洗脱剂(体积比24∶1),氧化铝装柱进行柱分离,将收集的产物浓缩至干,真空干燥后,得棕色固体粉末0.31g,产率62.5%.配合物 Ru1的分子式为C44H34Cl2N8O8RuS.元素分析实验值(%):C 52.51,H 3.35,N 11.15,计算值:C 52.49,H 3.38,N 11.13.1H NMR(300MHz,DMSO-d6):8.88(d,4H),8.79~8.74(m,6H),8.60~8.19(d,8H),7.99~7.64(t,6H),7.50(s,1H),7.30(d,4H),7.03~6.62(m,5H).IR(KBr,cm-1):1 627(vC■N),1 593,1 441(vC■C,vC■N),766,622(δC—H),1 092(vCl—O).ESI-MS(m/z):计算值为403.500 0,实际测得值为404.300 0,此峰归属为Ru12+.
配合物Ru2的合成:合成方法及步骤同Ru1,换用配体L20.21g(0.5mmol)代替 L1,得到红褐色固体0.26g,产率51.4%.配合物Ru2的分子式为C44H38Cl2N8O8RuS.元素分析实验值(%):C 52.25,H 3.75,N 11.12,计算值:C 52.28,H 3.76,N 11.09.1H NMR(300MHz,DMSO-d6):8.85(d,4H),8.60~8.36(m,6H),8.24~8.09(m,4H),7.93~7.74(dd,J=17.8,11.8Hz,6H),7.66~7.46(m,3H),7.28(t,J=12.2,10.8Hz,4H),7.01(d,J=8.5Hz,4H),6.50(d,J=8.6Hz,4H),4.32(d,J=3.8Hz,3H).IR(KBr,cm-1):1 596,1 502,1 435(vC■C,vC■N),758,625(vC—H),1 086(vCl—O).ESI-MS(m/z):计算值为406.100 0,实际测得值为405.000 0,此峰属于Ru22+.
1.3 生物活性检测
按照标准的 MTT测试方法[18-19]进行检测,概括为4步:
1)种入细胞。在96孔板的3~11列用排枪分别加入悬有细胞的200μL培养基,使每孔细胞数大约为10 000个,第2列作为溶剂空白,96孔板周围加培养基防止挥发。将96孔板放入37℃,5%CO2的培养箱中过夜,观察细胞生长情况,待80%细胞贴壁后,进行下一步。
2)加药。在24孔板的每个孔中各加入3mL培养基,将所加药物稀释到不同浓度梯度,用排枪将孔中原有的培养液吸掉,每一列加入相同浓度的药物,加完后,放入培养箱培养48h。
3)加 MTT.在药物与细胞相互作用结束前4h,吸掉培养液,用缓冲溶液PBS洗涤两次,然后每孔加入180μL PBS缓冲溶液,再加入20μL 5mg/mL的MTT,放入培养箱继续培养4h.
4)加DMSO.4h后拿出96孔板,吸掉上清液,每孔加入150μL DMSO,放入摇床内摇10min,将紫色结晶物充分溶解,放入酶标仪卡槽内在490 nm波长处扫描,得到吸光度值(OD值)。吸光度值可以间接的反应活细胞的数量,以此来计算IC50值:
IC50=OD(实验组)/OD(对照组). (1)
1.4 流式细胞仪检测细胞凋亡
流式细胞仪检测Ru1诱导肿瘤细胞凋亡使用的荧光探针是Annexin V-FITC和PI.Ru1处理MCF-7细胞24h,同时做一个Ru1未处理的MCF-7细胞作对照,分别收集细胞数目达到105个,用灭菌PBS缓冲液洗涤一次后,每管加入500μL试剂盒中的结合缓冲液并重悬细胞。每管分别加10μL PI染液和5μL Annexin V-FITC染液,避光染色5 min,使用EPICS XL-MCL型流式细胞仪检测细胞凋亡,使用488nm分别激发出FITC的绿光和PI的红光。样品上仪器前用200目滤网过滤杂质以免堵塞机器。使用仪器自带的EXPO32MultiComp(Beckman Coulter)软件自动拟合出各时期细胞凋亡率和坏死率。
1.5 Hoechst 33258染色测定细胞凋亡
盖玻片放入6孔板内,细胞培养过夜,大约50%~80%铺满细胞。用各个浓度的药物(5,10,25 μmol/L)处理细胞24h,吸尽培养液,加入0.5mL含4%多聚甲醛或70%乙醇的固定液,固定10min或者更长时间。弃掉固定液,用PBS洗两遍,每次3 min,吸尽液体。加入1mL 10μg/mL的 Hoechst33258染色液,37℃染色15min.弃去染色液,用PBS洗两遍,每次3min,吸尽液体。荧光显微镜下用紫外光激发,可观察到呈蓝色的细胞核,根据细胞核是否皱缩来判断细胞凋亡情况。
2 结果与讨论
2.1 配体及配合物的合成
配体及配合物是按照相关文献合成的[20],为了确定配体及配合物的结构,在CDCl3和DMSO-d6溶剂里做了核磁氢谱。以配体L1为例(如图3),8.72处为吡啶环上H6的峰,该峰属于双重峰,由于受邻位氮原子的吸电子效应影响,使得吡啶环中该氢的化学位移最大;8.61处为希夫碱—CHN—上H5的峰,该峰是一个强的单峰,由此可判断配体中形成了希夫碱键;8.20处为吡啶环上H4的双重峰;7.82处为吡啶环中 H3的三重峰;7.42处的峰属于苯环上H2的峰,为双重峰;7.28处为多重峰,此多重峰归属于苯环上的H1及吡啶环上的H1.苯环上H2的峰相比H1移向低场,由于H2受希夫碱键吸电子效应的影响,使得去屏蔽作用增强,所以移向低场。同样L2和Ru1、Ru2也分别在CDCl3和DMSO-d6溶剂里做了核磁氢谱,很明显L2配体的1H NMR中8.61×10-6附近的单峰消失了,说明希夫碱键被还原为单键。对配合物来说,因其分子中苯环较多,氢化学环境相差不大,使得峰相互叠加,难以一一指认。但是测得的图谱中总氢的个数与化学结构式中氢的个数一致。说明配体和配合物在溶液里能稳定存在。
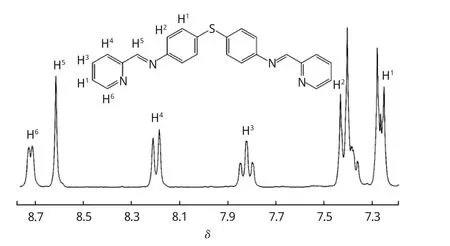
图3 配体L1在CDCl3中的核磁氢谱Fig.3 1 H NMR of ligand L1 in CDCl3
2.2 光谱性质
将配合物配制成浓度为1.0×10-5mol/L的乙腈溶液,测试配合物的紫外-可见吸收光谱,如图4所示。配合物Ru1在254,286和487nm处有三个吸收峰,而配合物Ru2在278和484nm处有两个吸收峰。其中254,286和278nm三个峰属于配体内π-π*跃迁产生的吸收峰;487和484nm处的吸收峰属于金属到配体的电荷转移吸收峰(MLCT),相比[Ru(bpy)3]2+(λmax=451nm)发生了略微的红移,说明所合成的配合物共轭体系比[Ru(bpy)3]2+大[21-22]。
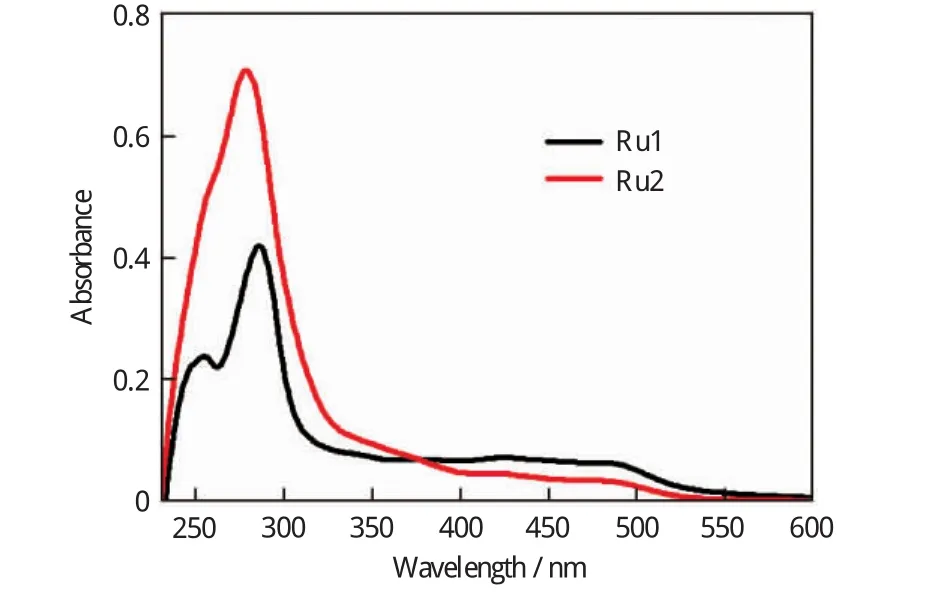
图4 Ru1和Ru2在乙腈中的紫外-可见吸收光谱Fig.4 UV-Vis spectra of complexes Ru1and Ru2(1×10-5 mol/L)in acetonitrile
2.3 电化学性质
将 Ru1和 Ru2分别溶解在0.1mol/L的Bu4NClO4的乙腈溶液中配制成一定浓度(1.0×10-3mol/L)的溶液,以铂电极为工作电极和对电极,饱和甘汞电极(SCE)作为参比电极,组成简单的三电极体系通过微分脉冲极谱法测试配合物的氧化还原电位,得到微分脉冲极谱曲线(DPV),如图5所示。从图5可以看出,两个配合物在0~1.5V范围内均有两个氧化峰,而配体在0~1.5V范围内没有氧化峰,说明这两个峰是金属中心的氧化峰,分别对应于Ru2+→Ru3+→Ru4+.

图5 Ru1和Ru2在乙腈中的微分脉冲极谱曲线Fig.5 Differential pulse voltammetry studies of Ru1and Ru2in acetonitrile
2.4 生物活性检测
通过MTT方法检测配合物对Hela(人宫颈癌细胞)、BGC823(胃癌细胞)和 MCF-7(乳腺癌细胞)的细胞毒性。作出Ru1和Ru2对三种肿瘤细胞作用48h后的浓度-存活率曲线图。图6显示了Ru1和Ru2对Hela、BGC823和MCF-7的细胞毒性结果。从表1和图6可以看出,对不同的肿瘤细胞,Ru1的IC50值都比Ru2小,说明Ru1的抗肿瘤活性大于Ru2.而对所测的三种细胞,Ru1和Ru2均对MCF-7的IC50值最小,说明两个配合物对 MCF-7有比较好的选择性,可能成为潜在的抗癌药物。机理可能是配合物的溶解度低,疏水性强,亲脂性大,使得配合物容易累积到线粒体内。钌配合物作为抗肿瘤药物的具体机理还在进一步研究中。

图6 Ru1和Ru2对肿瘤细胞的浓度-存活率曲线图Fig.6 Cell viability of Ru1and Ru2toward proliferation of Hela,BGC823and MCF-7

表1 Ru1和Ru2的IC50值Table 1 IC50of Ru1and Ru2
2.5 流式细胞仪检测细胞凋亡
Annexin-V FITC和PI两种荧光试剂双染Ru1处理24h后的MCF-7细胞,再结合流式细胞技术检测处于各种状态的细胞(正常细胞、早期凋亡细胞、中晚期凋亡细胞、坏死细胞)的比例。图7所示是Ru1处理过的MCF-7细胞。当Ru1处理细胞24h后,对照组中正常细胞和早期凋亡细胞的比例分别为93.67%和2.58%.当用5,10和25μmol/L的Ru1处理后,早期凋亡细胞的比例分别为3.11%,4.22%和12.44%.明显可以看出,随着配合物浓度的增大,早期凋亡细胞所占比例逐渐增大,说明Ru1会诱导MCF-7细胞凋亡而不是坏死。
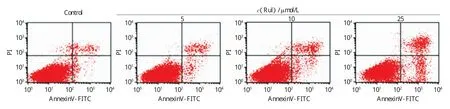
图7 MCF-7细胞中正常细胞、凋亡细胞和坏死细胞的比例Fig.7 Percentage of living(B3),necrotic(B2),and apoptotic(B4)MCF-7cells
2.6 Hoechst染色法检测细胞凋亡
Hoechst是一种荧光染料,它的膜通透性很好,正常细胞和早中期凋亡的细胞可以被Hoechst着色。正常细胞核被它染色后的形态是圆形,淡蓝色,里面有较深的蓝色颗粒,而凋亡细胞的细胞核由于浓集而呈亮蓝色,或呈分叶、碎片、边集状态。MCF-7细胞经5,10和25μmol/L的Ru1作用24h后,荧光显微镜下观察并拍照。从图8可见,对照组的细胞呈正常结构,没有观察到细胞核固缩,染色质凝聚和块状荧光等现象,而配合物作用后的细胞呈现细胞核固缩,染色质凝聚,部分呈月牙形附于核膜周围,并且随着配合物浓度的增大,这种不正常的细胞比例逐渐增大,说明Ru1诱导MCF-7细胞凋亡。

图8 荧光显微镜观察Hoechst33258染色MCF-7细胞Fig.8 Hoechst 33258staining of MCF-7cells
3 结论
本文以4,4′-二氨基二苯硫醚和2-吡啶甲醛为原料,合成了两个配体,并在此基础上合成了两个单核钌配合物。通过元素分析、核磁氢谱、红外光谱、电喷雾质谱对配体及配合物进行了结构表征,证实了配合物结构的正确性。此外,研究了配合物的紫外-可见吸收光谱和电化学性质。通过MTT法测试了Ru1和Ru2对Hela、BGC823和MCF-7三种肿瘤细胞的抗癌活性。结果显示:Ru1的抗肿瘤活性强于Ru2,说明含有希夫碱结构的配合物与肿瘤细胞作用较强。而在所测的三种细胞中,Ru1和Ru2均表现出对MCF-7有很好的选择性,说明Ru1和Ru2可能成为治疗癌症的潜在药物。最后通过荧光染色法和流式细胞仪检测配合物Ru1对MCF-7的细胞凋亡,实验结果表明Ru1诱导肿瘤细胞凋亡。

