lncRNA与缺血性脑卒中相关分子机制的研究进展
蔺文娟综述,吴松笛,2,3审校
脑卒中是目前导致全球范围内死亡和致残的主要病因,其中缺血性脑卒中约占全部脑卒中的60%~70%。中国是世界上卒中负担最沉重的国家之一,2019年全球疾病负担研究显示,1990年-2017年间各大疾病导致的死亡率中,脑卒中超过了缺血性心脏病和癌症成为中国人第一大死因[1]。如何更好地防治卒中已成为目前亟待解决的重要问题之一。
长链非编码RNA(long-non coding RNA,lncRNA)是一类由RNA polⅡ从独立启动子转录的长度大于200 nt、不编码蛋白质但能转录且具有特定功能的RNA分子,缺少特异完整的开放阅读框(open-reading frame,ORF),具有细胞和组织特异性,序列保守性通常比较低,但其二级结构比较保守[2]。lncRNA的分类尚未标准化,目前一种广泛的分类是科学家根据lncRNA在蛋白编码基因组中所处的有关位置进行分类的(见图1)[3]。大部分lncRNA具有反式作用,能够远距离调控基因的表达,在细胞中具有独立的转录位点并能够执行多种细胞功能;部分lncRNA具顺式作用,能够调节邻近蛋白编码基因的转录,精密控制多样性基因位点的时空表达,从而调控其功能。尽管lncRNA有这些特殊性,但越来越多的lncRNA的功能和机制已经开始被阐明,它的重要性逐渐被人们认识到。近些年,大量研究发现,lncRNA在缺血性脑卒中的病理生理过程中发挥着重要作用。本文综述最新的相关文献,就lncRNA与缺血性脑卒中相关分子机制的最新研究进展加以综述,包括lncRNA在缺血性脑卒中后表达谱的变化、在缺血性脑卒中后细胞凋亡、血管生成、炎症和自噬中的调节作用等,以期为卒中的更好防护提供依据。
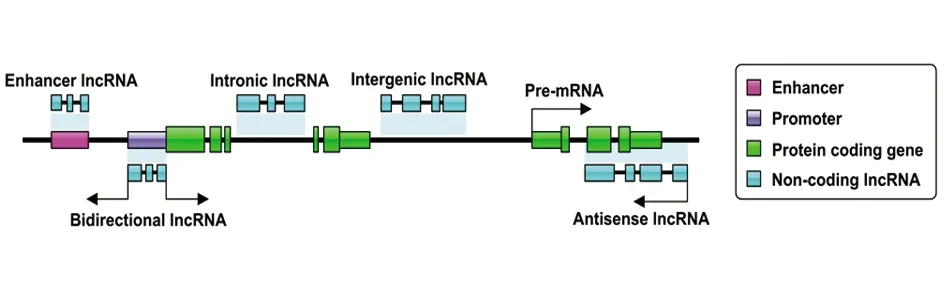
注:Enhancer lncRNA(增强子lncRNA),在基因组的增强子区域被转录;Bidirectional lncRNA(双向lncRNA),在蛋白质编码基因的启动子区域以双向方式转录;Intronic lncRNA(内含子lncRNA),在蛋白编码基因的内含子区域转录;Intergenic lncRNA(基因间lncRNA),在两个蛋白编码基因之间转录;Antisense lncRNA(反义lncRNA),在重叠的蛋白编码基因的反义链方向上转录。
1 缺血性卒中后lncRNA表达谱变化
lncRNA广泛存在于哺乳动物的脑组织中,基于lncRNA芯片和全基因转录组测序平台的多项研究显示,缺血性脑卒中后lncRNA的表达谱发生了广泛改变,这些改变的lncRNA通过调控兴奋性毒性、氧化应激、血管生成、神经炎症、凋亡及自噬等病理机制在神经元的死亡和/或再生过程中发挥着重要作用[4]。Ashutosh Dharap等[5]最早发现局灶脑缺血再灌注后大鼠脑内lncRNA的表达谱存在变化。随着技术的逐渐成熟和研究的不断深入,Bhattarai等[6]采用转录组测序技术(RNA-seq)发现,局灶性脑缺血再灌注诱导小鼠皮质中lncRNA表达发生了广泛变化,且这些变化与缺血再灌注时间点(再灌注时间点特异性分析显示,lncRNA表达变化在缺血再灌注6 h时达到峰值)具有明显的相关性依赖性表达特征。另有研究发现,急性缺血性脑卒中患者lncRNAs表达谱在急性期(24 h)向亚急性期(7 d)转变期间发生了显著变化;且这些差异表达的lncRNA可能与缺血性脑卒中患者外周免疫系统的调节过程相关[7]。此外,Deng等[8]研究发现,急性缺血性脑卒中(acute ischemic stroke,AIS)患者中Linc-DHFRL1-4、SNHG15、Linc-FAM98A-3等lncRNAs的表达明显高于健康对照组和短暂性脑缺血发作者,其中,SNHG15、Linc-FAM98A-3有作为AIS患者生物标志物的潜力。
2 lncRNA在脑缺血后的功能意义
缺血性脑卒中后继发性细胞死亡是由多种机制协同介导的,包括能量耗竭、兴奋性毒性、氧化应激、炎症反应、血管功能障碍、细胞凋亡和自噬等病理生理机制[9]。越来越多的研究表明,lncRNA在缺血性脑卒中病理生理过程中起着重要调节作用,有学者基于从部分患者中筛查出的差异性lncRNAs,在细胞或/和动物模型上对这些lncRNAs的相关功能及下游靶点进行了研究(见表1),有望为脑卒中的有效防控提供更精准的依据。
2.1 lncRNA和缺血后细胞凋亡 细胞凋亡(Apoptosis)是严格受基因控制的细胞出现的自主有序的死亡,凋亡过程的紊乱会引发多种疾病的发生。脑缺血发生后,受损的细胞为了适应变化的环境,减少对周围细胞的影响,通过一系列调控方式启动细胞凋亡。其中,细胞在外源性刺激下,死亡配体(如:FasL、TNFR1、DRs)会与细胞表面的受体(如:Fas、TNF、TRAIL)结合,激活下游caspase级联反应调控凋亡通路,最终导致细胞凋亡。而内源性刺激则是由线粒体和内质网途径激活的,脑卒中后细胞内环境受损,细胞外Ca2+大量内流,激活线粒体膜上的凋亡蛋白,促使线粒体转化孔开放,释放Cyto C,进而与线粒体外的凋亡蛋白酶激活因子1(apoptotic protease activating factor-1,Apaf-1)、Pro-caspase-9形成凋亡小体,最终引发caspase级联反应,导致细胞凋亡。
越来越多的研究表明,lncRNA在细胞凋亡参与的缺血性细胞损伤中发挥着重要调节作用[10,12,13]。lncRNA可直接或间接作用于caspase和Bcl-2两大家族的凋亡蛋白质,影响线粒体凋亡途径,调控细胞凋亡过程。例如,在氧-糖剥离(oxygen-glucose deprivation,OGD)诱导的嗜铬细胞瘤细胞PC-12中,位于INK4位点的反义lncRNA ANRIL的体外沉默能够促进抗凋亡因子Mcl-1的表达,抑制线粒体凋亡程序的启动,保护细胞免受凋亡带来的损害[10]。体外敲低lncRNA SNHG6则能抑制下游凋亡蛋白caspase-3的活性,并抑制线粒体膜上Bcl-2的下游靶点Bim的表达,进而抑制细胞凋亡,增加OGD诱导的神经细胞存活率;减少大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)小鼠的脑梗死体积[12]。lncRNA也可能通过调节下游凋亡蛋白(如:p53)的启动,调控由DNA损伤引发的凋亡。例如,lncRNA MALAT1在缺血性损伤中(包括69例脑卒中患者和OGD/R诱导的HBMECs)能够下调MDM2,增加p53蛋白水平,抑制细胞凋亡[13]。lncRNA还可能通过参与染色质异质化、转录调控以及转录后调控,调节细胞凋亡,改善神经功能。近期的一项研究显示,lncRNA Gas5的体外沉默能够抑制DNA甲基转移酶3B(DNA methyltransferase 3B,Dnmt3b)的募集,进而抑制MAP4K4的甲基化,增加MAP4K4的表达,减轻由缺血诱导的神经元凋亡[17]。细胞凋亡途径是一个复杂而又精密的庞大系统,而与lncRNA有关的细胞凋亡途径的研究目前尚处于初步阶段,lncRNA如何精细的调控卒中后凋亡还有待进一步的揭示。
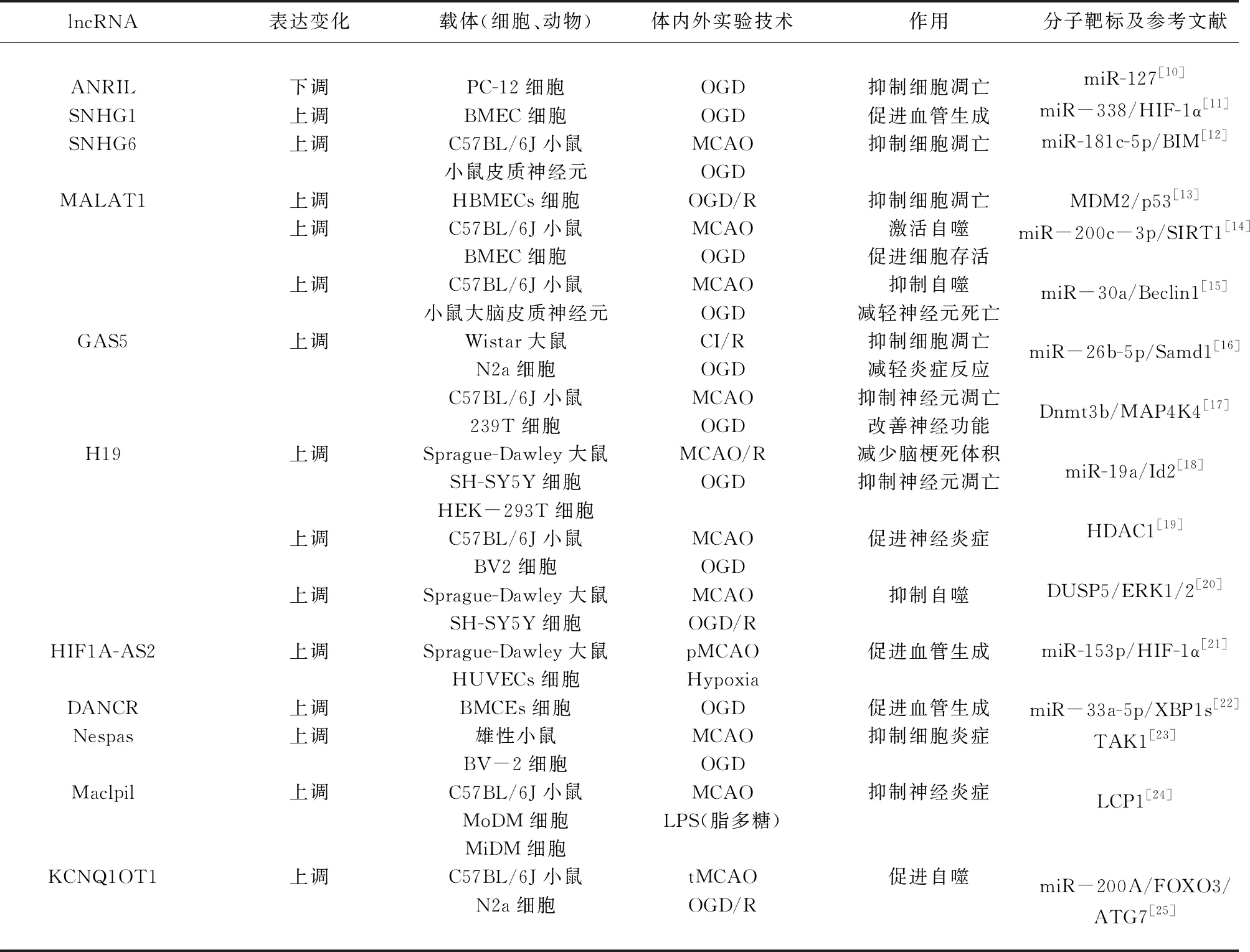
表1 lncRNA在缺血性脑卒中中的作用及相关机制
2.2 lncRNA和缺血后血管生成 血管生成(Angiogenesis)是指从已有的血管中形成新的血管。在正常生理状态下,血管生成受血管生成促进因子(如:VEGF、AngⅠ、AngⅡ等)和血管生成抑制因子(如:TSP、ENS等)的调节而处于动态平衡中,可改善周围组织的血流供应。然而,在缺血性脑卒中后,责任血管支配的脑组织区域血流迅速下降,导致氧和营养物质供应不足,最终引发受损脑组织部位细胞损伤甚至死亡,通过促进血管生成及建立侧支循环可能会诱导损伤脑组织的结构重塑及神经功能恢复[26]。lncRNA表达谱的改变可能发挥着诱导或促进血管生成的作用[11,21,22]。血管内皮生长因子(vascular endothelial growth factor,VEGF)作为血管生成过程中的重要促进因子,具有高度特异性,对内皮细胞有明显的靶向诱导作用[27]。而lncRNA可通过调节VEGF来诱导血管生成。例如,在缺氧条件下,体外沉默lncRNA SNHG1能够减少OGD诱导的小鼠脑微血管内皮细胞(brain microvascular endothelial cells,BMEC)中VEGF-A的表达,进而抑制血管生成[11]。在缺血缺氧条件下,低氧转录因子(hypoxia-inducible factor,HIF-1α)表达水平升高,可以调控VEGF/Notch1信号通路,促进脑卒中后的血管生成[28]。而源自HIF-1α的天然反义lncRNA HIF1A-AS2作为miR-153p的海绵,通过改变HIF-1α的活性,促进VEGF-A表达,进而抑制缺氧条件下人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤,促进血管生成[21]。此外,转录调节因子X-盒结合蛋白1(X-box binding protein l,XBP1)能促进大鼠BMEC存活,诱导血管生成[29]。Zhang等[22]发现lncRNA DANCR可通过“海绵”作用抑制miR-33a-5p的表达,促进XBP1的表达,进而促进OGD诱导的BMECs存活和血管生成。上述研究显示lncRNA是脑缺血后血管生成的重要介质,进一步探索lncRNA在血管生成中的生物学作用及其机制,有利于为缺血性脑卒中的临床治疗策略奠定基础。
2.3 lncRNA和缺血后炎症反应 炎症反应(Inflammation)在缺血性脑损伤中起着重要的作用,其过程主要由小胶质细胞、星形胶质细胞和外周血中的中性粒细胞、淋巴细胞、单核巨噬细胞介导。其中,小胶质细胞的表型(M1型和M2型)极化在控制促炎和抗炎状态之间的平衡中起着重要作用[30]。经典激活型(M1极化)的小胶质细胞主要发挥促炎功能,促进IL-1、IL-6、IL-1β、TNF-α和NO、ROS、Glu等促炎因子和介质的合成,启动中枢神经系统的炎症反应,引发细胞凋亡和继发性脑损伤等。而替代激活型(M2极化)的小胶质细胞则通过分泌IL-10、IL-1Ra、IL-37和TGF-β、PDGF等抗炎细胞因子和生长因子发挥抗炎功能,促进组织修复和再生,实现对神经的保护作用。小胶质细胞的表型转化在缺血性脑损伤引发的炎症过程中起着一定的作用,有望为临床治疗带来希望。lncRNA在小胶质细胞的表型极化过程中发挥着一定的作用[19,23]。例如,研究发现lncRNA H19在缺血损伤后(包括脑卒中患者、MCAO小鼠模型及OGD诱导的BV2细胞)表达水平升高,并通过驱动依赖于组蛋白去乙酰化酶1(histone deacetylase1,HDAC1)的M1小胶质细胞极化来促进神经炎症[19]。同时,lncRNA也可通过直接或间接方式调节炎症经典信号通路NF-κB,维持促炎因子和抗炎因子之间的平衡,抑制炎症损伤的发生。例如,在缺血性损伤后(MCAO小鼠和OGD诱导的BV2细胞),lncRNA Nespas能直接和转化生长因子激酶1(transforming growth factor-β-activated kinase 1,TAK1)相互作用,阻止E3连接酶TRIM8泛素化调控K63连接的重要分子TAK1,导致NF-κB失活,抑制神经炎症,减轻细胞死亡[23]。此外,lncRNA在靶向巨噬细胞的神经炎症调控方面也有巨大潜力。研究显示,在脑卒中急性期,免疫细胞(包括T细胞、B细胞、NK细胞和巨噬细胞等白细胞)会主动迁移到脑病变区域并加重脑损伤[31],其中,巨噬细胞(按来源可分为外周单核细胞衍生的巨噬细胞(MoDM)和小胶质细胞衍生的巨噬细胞(MiDM))在脑卒中诱发的神经炎症中起着关键作用[9]。新近一项研究使用流式细胞分选技术从MCAO的小鼠大脑中分离出了MoDM和MiDM细胞,并使用RNA深度测序从中鉴定和筛选出对MoDM至关重要的lncRNA Maclpil。发现Maclpil通过靶向调节淋巴细胞胞浆蛋白1(lymphocyte cytosolic protein1,LCP1)抑制MoDMs的迁移和吞噬能力,进而抑制神经炎症,改善MCAO小鼠神经功能[24]。由此可知,lncRNA介导的缺血性损伤后炎症反应的潜在机制复杂多样,研究lncRNA在缺血后炎症反应中的机制可能给缺血性脑卒中的临床抗炎治疗带来希望。
2.4 lncRNA和缺血后细胞自噬 细胞自噬(Autophagy)是受基因调控的,通过破坏异常折叠的蛋白质和功能失调的细胞质细胞器来维持细胞稳态。在正常生理情况下,自噬是真核生物体内存在的一种自我保护机制,能够通过双层膜选择性的将细胞内物质包裹在囊泡内形成自噬体,进而与溶酶体结合成自溶酶体,对包裹的物质进行降解,以达到物质的再利用,提供能量,维持细胞稳定。然而,在脑缺血发生后,因营养物质缺乏、能量供给减少,组织细胞的自噬水平可能上调。已有研究表明,可通过调节lncRNA调控缺血后细胞自噬,减轻缺血性损伤。例如,位于人体染色体11q13上的lncRNA MALAT1可通过新型调控网络MALAT1-miR-30a-Beclin1机制抑制自噬,保护OGD诱导的神经元免受自噬带来的损害[6]。
脑损伤后,lncRNA可通过多种自噬途径调节自噬水平[20,25]。自噬相关蛋白7(autophagy related protein 7,ATG7)被认为是一种关键的自噬启动子,特异性的敲低ATG7有利于防止缺氧后的脑损伤[32],lncRNA可以通过调控ATG7在自噬中发挥作用,减轻缺血导致的损伤。例如,反义lncRNA KCNQ1OT1作为miR-200a的竞争内源性RNA通过调节ATG7的转录调节因子FOXO3的表达,调节ATG7的活性,减轻缺血再灌注引发的自噬,增加N2a细胞活力[25]。LC3是自噬体形成的关键,LC3合成后经磷脂酰乙醇胺(PE)修饰形成LC3-Ⅱ,结合在自噬体膜上,促进自噬体形成,在调节脑缺血后神经元的自噬活性中起重要作用[33]。H19被证明通过抑制下游效应子DUSP5来消除其对LC3-Ⅱ和Beclin1的抑制作用,同时激活ERL1/2,增加OGD/R诱导的SH-SY5Y细胞自噬水平,促进MCAO大鼠缺血再灌注损伤[20]。以上研究为基于自噬的脑卒中干预治疗策略提供了新的理论依据。
3 lncRNA作为缺血性脑卒中生物标志物的临床研究
随着近些年基因测序技术的快速发展,已有临床研究开始探索急性脑卒中患者体内lncRNA及其基因多态型的表达变化作为缺血性脑卒中临床生物标志物的潜力。新近一项研究纳入了126名AIS患者和126名健康对照者,采用qRT-PCR定量测定方法检测发现ANRIL表达与卒中患者严重程度呈负相关,且ANRIL的低表达与急性缺血性卒中患者的风险增加、疾病严重程度和促炎细胞因子(TNF-α、IL-6、hs-CRP)水平升高有关。随着大数据的挖掘,有学者应用生物信息学技术寻找与缺血性脑卒中相关的关键基因和通路lncRNA。例如,Wang等[34]选择了3例IS患者和3例正常对照者,应用加权基因共表达网络(weighted gene co-expression network analysis,WGCNA)技术,分析和筛选出与IS相关的关键lncRNA模块(共调查了3627个lncRNA,分析了17个模块)。其中,一个模块与IS高度相关,且其与AKT1和MAPK14(IS相关的两个中枢基因)信号通路、T细胞淋巴病毒-1(T cell lymphotropic virus,HTLV-1)感染途径和mTOR信号传导途径相关,提示其可能成为未来IS精确诊断和诊疗的生物标志物靶标。Cao等[35]从基因表达综合数据库(www.ncbi.nlm.nih.gov/geo)中筛选了20例IS患者和20例匹配对照者,构建了一种识别IS患者外周血单核细胞中显著异常lncRNA的lncRNA介导的调节三联体(lncRNA-mediated regulatory triplet,lncMRT)网络拓补结构,功能分析显示lncMRTs参与IS后磷脂酰肌醇3激酶/蛋白激酶B信号通路的调节。
迄今为止,尽管有关脑卒中的大多数lncRNA的研究尚处于初期阶段,但这些研究仍然强调了这一策略的应用前景。因此,对lncRNA基因座中关键遗传变异的鉴定和卒中患者差异表达的lncRNA基因位点的评估,有望让基于lncRNA的治疗方法进入临床试验变成现实。
4 展 望
越来越多的证据显示,lncRNA在缺血性脑卒中后的病理生理学中发挥着广泛的调控作用。因此,lncRNA可能会成为有助于脑卒中临床诊疗和预后判断的生物标志物。有关lncRNA的大多数研究描述了其作为miRNA的海绵效应机制,但基于lncRNA-miRNA-mRNA的调节机制在脑卒中后是否发挥着广泛效应,目前尚不清楚。未来,仍需进一步就lncRNA调节网络在缺血性脑卒中后的作用进行深入研究,为脑卒中的有效防控提供更精准的依据。

