赤水白茶总黄酮超声辅助提取工艺优化及其抗氧化活性
张剑霜,王地平,侯忠华,张 旭,李 艳,喻 浩
(1.贵州师范大学生命科学学院,贵州贵阳 550025; 2.贵州师范学院生物科学学院,贵州贵阳550018)
赤水白茶起源于云贵高原大娄山脉及其周边地区,是大娄山区民间特有的古老茶种,在四川、重庆地区又称作“老鹰茶”或“老荫茶”[1]。赤水白茶主要是以樟科Lauraceae木姜子属Litsea毛豹皮樟Litseacoreanalevl. var.lanuginosa植物的嫩芽或嫩叶为原料,经蒸制后,再晒干或炒制烘干而成[2]。赤水白茶茶汤色泽金黄,具有特殊的樟科植物的芳香味,在大娄山区已有悠久的饮用历史,其味甘性寒,饮之可起到消暑解渴、止泻和消食解胀之功效,是炎热夏季倍受西南地区民众喜爱的清凉饮品[3]。
赤水白茶中含有黄酮、多酚、多糖、维生素及微量元素等多种功能活性物质,其提取物具有多方面的生物活性,其中黄酮类化合物是赤水白茶中的主要活性成分[4-6]。目前,赤水白茶黄酮类成分提取多采用浸提法和热回流法,但前者提取时间较长效率不高,而后者所需温度较高会导致有效成分被破坏[7-8]。近年来,超声辅助提取技术由于具有操作方便、耗时少和提取效率高等特点,被广泛应用于多种食品化学成分的提取[9]。
本研究采用超声辅助法提取赤水白茶总黄酮成分,在单因素实验基础上考察甲醇浓度、提取时间和液料比对赤水白茶总黄酮提取量的影响,结合Box-Behnken设计-响应面法考察影响赤水白茶总黄酮提取量的主要因素,建立二项式回归模型,优化超声辅助提取的工艺参数。采用多种体外抗氧化活性测定方法探讨赤水白茶总黄酮的抗氧化活性,以期为赤水白茶资源的开发利用提供理论参考。
1 材料与方法
1.1 材料与仪器
赤水白茶 产自贵州省赤水市元厚镇;芦丁标准品(纯度>99%) 购自北京索莱宝科技有限公司;维生素C(VC,纯度>99%)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,纯度>98%)、乙二胺四乙酸(EDTA)、过硫酸钾、无水甲醇 均购自上海阿拉丁生化科技股份有限公司;1,1-二苯基-2-苦基肼(DPPH,纯度>97%) 购自日本东京化成工业株式会社;无水乙醇、硝酸铝、亚硝酸钠、氢氧化钠等其它试剂 均为国产分析纯。
UV759CR紫外分光光度计 上海佑科仪器仪表有限公司;DK-8D恒温水浴锅 上海一恒科技有限公司;SB-5200DTD 超声波清洗器 宁波新芝生物科技有限公司;FA2204B精密电子分析天平 上海精密科学仪器有限公司;Millipore Simplicity system超纯水系统 美国默克公司;TD6多管架自动平衡离心机 上海卢湘仪离心机仪器有限公司;QL-901 Vortex涡旋振荡仪 江苏海门其林贝尔公司。
1.2 实验方法
1.2.1 赤水白茶样品预处理与总黄酮提取 将赤水白茶样品于50 ℃烘箱中烘干至恒重,使用粉碎机粉碎后过80 目筛,保存于干燥器内。根据前期预实验结果可知,相比乙醇和水,使用甲醇为提取溶剂所得总黄酮提取量最大;温度为50 ℃时样品总黄酮提取量最大,而超过此温度后提取量有所下降;此外,超声功率的变化(165~300 W)对赤水白茶总黄酮提取量无显著影响;目前甲醇已用于多种食品中总黄酮的提取[10-13],因此后续实验中选择以甲醇为溶剂,温度50 ℃,超声功率210 W,并在此基础上进行继续优化。准确称取0.05 g白茶粉末,按照液料比加入一定浓度的甲醇溶液,充分混匀后,在210 W功率和50 ℃下超声辅助提取一定时间,然后室温下以4000 r/min离心10 min,收集上清液,用于总黄酮提取量测定。
1.2.2 芦丁标准曲线绘制 称取100 ℃下干燥至恒重的芦丁对照品0.02 g,用适量95%的乙醇溶解,定容至50 mL,得质量浓度为0.4 mg/mL的芦丁标准液。分别准确吸取芦丁标准液0、0.5、1.0、1.5、2.0、2.5、3.0 mL置于25 mL具塞比色管中,用蒸馏水补足至5 mL,加入5%的NaNO2溶液1.0 mL,充分摇匀,静置6 min;再加入10%的Al(NO3)3溶液1.0 mL,充分摇匀,静置6 min;继续加入4%的NaOH溶液10 mL,混合后用蒸馏水定容至25 mL,摇匀并室温放置15 min,以空白试剂做为对照,测定510 nm处吸光度[14]。以芦丁浓度C为横坐标,测得的吸光度值A为纵坐标绘制标准曲线,得回归方程为:A=0.011C-0.0032,R2=0.9994。表明芦丁对照品在8~48 μg/mL范围内浓度与吸光度线性关系良好。
1.2.3 总黄酮提取量测定 采用硝酸铝分光光度法测定总黄酮提取量[14]。吸取 0.7 mL 赤水白茶总黄酮提取液于25 mL 具塞比色管中,按照“1.2.2”中的方法进行操作,以空白试剂为对照,测定510 nm处吸光度,根据芦丁标准曲线计算提取液中总黄酮浓度,再采用以下公式计算赤水白茶中总黄酮提取量。
式中:C-根据标准曲线计算出的黄酮质量浓度(μg/mL);V1-测定时的定容体积(mL);V2-提取液总体积(mL);V0-测定时所用提取液体积(mL);M-称取的白茶样品质量(g);RE-芦丁当量。
1.2.4 单因素实验
1.2.4.1 甲醇浓度对总黄酮提取量的影响 以液料比为100∶1 mL/g,提取温度为50 ℃,提取时间为40 min,超声功率210 W,考察甲醇浓度(30%、40%、50%、60%、70%、80%、90%)对赤水白茶总黄酮提取量的影响。
1.2.4.2 液料比对总黄酮提取量的影响 以甲醇浓度为70%,提取温度为50 ℃,提取时间为40 min,超声功率210 W,考察液料比(50∶1、75∶1、100∶1、125∶1、150∶1、175∶1 mL/g)对赤水白茶总黄酮提取量的影响。
1.2.4.3 提取时间对总黄酮提取量的影响 以甲醇浓度为70%,液料比为50∶1 mL/g,提取温度为50 ℃,超声功率210 W,考察提取时间(10、20、30、40、50、60 min)对赤水白茶总黄酮提取量的影响。
1.2.5 响应面优化试验设计 采用Box-Behnken试验设计原理,以甲醇浓度、液料比和提取时间为自变量,样品总黄酮提取量为因变量,在单因素实验的基础上,设计3因素3水平响应面试验优化赤水白茶总黄酮提取工艺,实验设计因素水平组合见表1。

表1 Box-Behnken试验设计因素及水平
1.2.6 赤水白茶总黄酮体外抗氧化活性测定
1.2.6.1 清除DPPH自由基能力测定 将赤水白茶总黄酮提取液加无水乙醇配制成总黄酮浓度分别为0.02、0.05、0.1、0.2、0.3、0.4、0.5 mg/mL的样品溶液。取0.5 mL样品溶液于具塞试管中,加入 0.15 mmol/L 的 DPPH溶液4.5 mL,充分摇匀,室温下避光反应30 min,测定520 nm波长的吸光度As,每个浓度重复3次实验。以0.5 mL纯水替代样品溶液与DPPH溶液混匀,测定吸光度Ab。以80%甲醇替代DPPH溶液与不同浓度样品溶液混合,测定吸光度A0。以VC为阳性对照,精密称取一定量的VC并配制与样品溶液相应的浓度,按上述方法进行测定。DPPH自由基清除率按下列公式进行计算[15]。
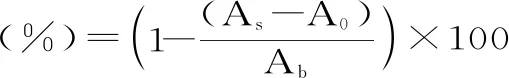
1.2.6.2 清除ABTS自由基能力测定 将ABTS配制成7 mmol/L的溶液,与2.45 mmol/L的过硫酸钾溶液混合后,避光放置12 h以上即得准备液,使用前用甲醇稀释使其在730 nm的吸光度为0.7~0.8[16]。将赤水白茶总黄酮提取液加无水乙醇配制成总黄酮浓度分别为0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.10 mg/mL的样品溶液。取样品溶液0.5 mL,加入准备液5 mL,充分混匀后室温避光反应6 min,测定730 nm吸光值As。以无水乙醇替代准备液与不同浓度样品混匀,测定吸光度A0。以0.5 mL水替代样品溶液,测定空白组吸光度Ab。以相应浓度的VC替代样品溶液作为阳性对照。ABTS自由基清除率参考“1.2.6.1”中公式进行计算。
1.2.6.3 铁离子还原法(Ferric ion reducing antioxidant power,FRAP)测定还原力 将赤水白茶总黄酮提取液加无水乙醇配制成总黄酮浓度分别为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的溶液。取1.0 mL不同浓度样品溶液与2.5 mL磷酸盐缓冲液(0.2 mol/L,pH=6.6)和2.5 mL铁氰化钾溶液(10 mg/mL)混合,50 ℃温浴20 min,加2.5 mL三氯乙酸终止反应,3000 r/min离心10 min。取上清液2.5 mL、纯水2.5 mL和FeCl3溶液(1 mg/mL)0.5 mL混合摇匀,测定700 nm吸光值,吸光值越高说明样品的还原性越强[17]。以相应浓度的VC替代样品溶液作为阳性对照。
1.2.6.4 金属离子螯合能力(Metal chelating activity,MCA)测定 采用络合菲洛嗪-Fe2+络合显色法测定样品对金属离子的清除能力,按照Damiani等[18]的方法进行适当修改。将样品总黄酮提取液加无水乙醇配制成总黄酮浓度分别为0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5 mg/mL的溶液,取1 mL样品溶液,加入1 mL的0.1 mmol/L硫酸亚铁溶液和1 mL 0.25 mmol/L菲洛嗪,充分混匀后,室温避光反应10 min,562 nm处测定吸光值As。用纯水代替样品测定空白对照组吸光值Ab,用水代替菲洛嗪测定不同浓度样品对照组吸光值A0。以相应浓度的EDTA替代样品溶液作为阳性对照。金属离子螯合力按下列公式进行计算。
1.3 数据处理
采用SPSS 19.0统计软件进行单因素数据方差分析,Design Expert 10软件进行响应面试验设计和结果分析,GraphPad Prism 7.0软件进行绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1 甲醇浓度对总黄酮提取量的影响 甲醇浓度对赤水白茶总黄酮提取量的影响如图1所示,在甲醇浓度30%~90%范围内,赤水白茶总黄酮提取量随着甲醇浓度呈现先上升后下降的趋势,研究结果与邓俊琳等[19-20]报道的甲醇浓度对总黄酮提取量的影响趋势一致。在甲醇浓度较低时,黄酮类化合物的溶解度较低,随着甲醇浓度升高总黄酮溶出率逐渐增加,在甲醇浓度70%时总黄酮提取量达到最大值(213.23 mg RE/g),此后由于溶液极性继续下降脂溶性成分溶出增加,导致赤水白茶总黄酮提取量降低。
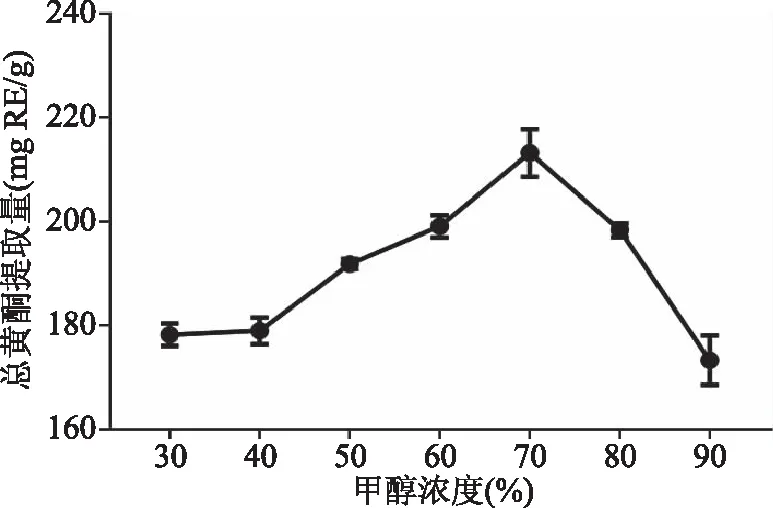
图1 甲醇浓度对赤水白茶总黄酮提取量的影响
2.1.2 液料比对总黄酮提取量的影响 液料比对赤水白茶总黄酮提取量的影响如图2所示,在液料比50∶1~100∶1 mL/g范围内,赤水白茶总黄酮提取量随液料比的增加呈逐渐升高,此后则呈相反趋势。在低液料比条件下赤水白茶总黄酮提取量较低,可能是由于溶剂与样品接触不充分所致,当液料比为100∶1 mL/g时总黄酮提取量达到最大值(239.27 mg RE/g),而继续增大液料比其它成分的溶出逐渐增加,从而导致黄酮类成分提取量降低[10]。
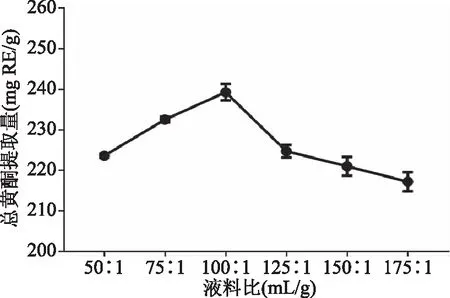
图2 液料比对赤水白茶总黄酮提取量的影响
2.1.3 提取时间对总黄酮提取量的影响 提取时间对赤水白茶总黄酮提取量的影响如图3所示,在10~20 min范围内,赤水白茶总黄酮提取量随着提取时间的延长而增加,此后继续增大提取时间总黄酮提取量呈逐渐下降趋势。当提取时间较短时,赤水白茶细胞中黄酮类物质还未完全溶出,在提取时间20 min时黄酮类物质基本完全溶出,提取量达到最大值(218.22 mg RE/g),继续延长提取时间可能会引起高温条件下黄酮类成分的降解,从而导致提取量降低[21]。

图3 提取时间对赤水白茶总黄酮提取量的影响
2.2 响应面试验结果
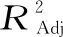
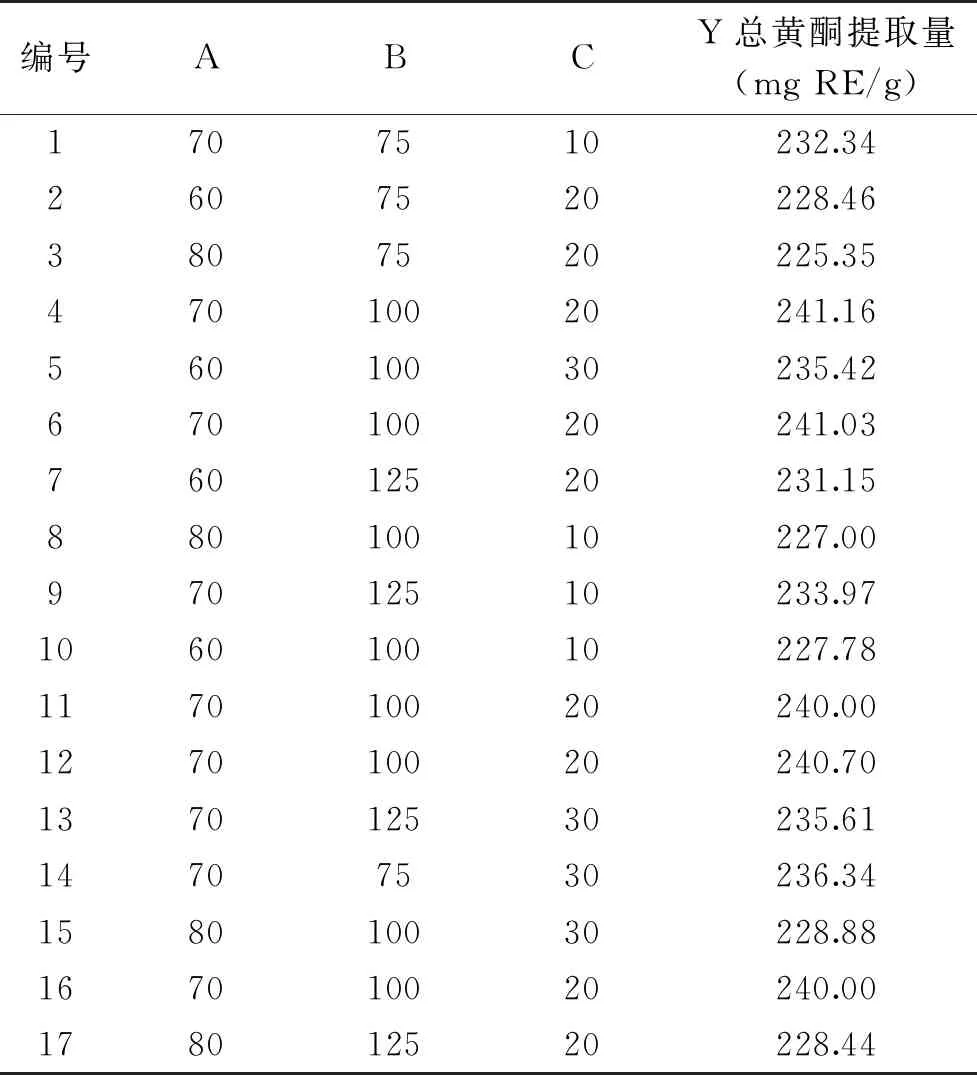
表2 Box-Behnken响应面试验设计及结果
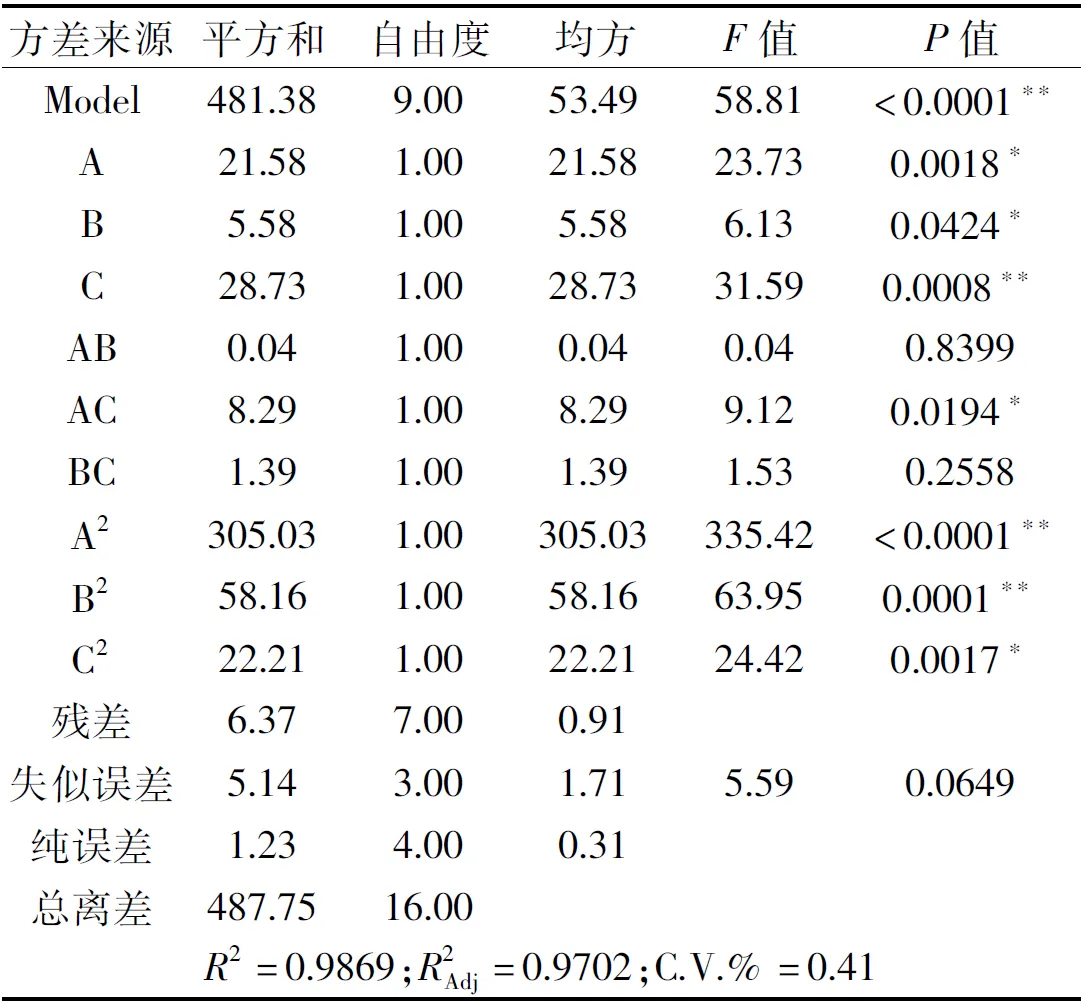
表3 响应面二次回归方程方差分析结果
各因素交互作用对赤水白茶总黄酮提取量的影响的3D响应面图和等高线图见图4~图6,三维响应面图可直观体现交互项对响应值的影响,响应曲面坡度陡峭程度和等高曲线离散程度可反映不同因子间交互作用对响应值的影响,响应曲面坡度越陡峭、等高线越接近椭圆形则表明响应值对因素的改变越敏感[22]。图4~图6均为响应面开口向下的椭圆形曲面,图4中响应面变化坡度较图5和图6更陡峭,并且等高线更接近椭圆形,表明甲醇浓度和提取时间的交互作用对总黄酮提取量的影响更大,与回归模型方差分析结果一致。

图4 甲醇浓度和提取时间对赤水白茶总黄酮提取量的影响
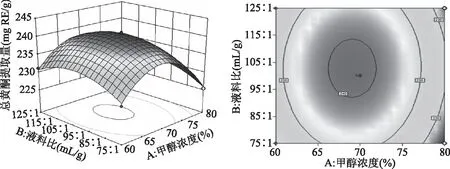
图5 甲醇浓度和液料比对赤水白茶总黄酮提取量的影响

图6 提取时间和液料比对赤水白茶总黄酮提取量的影响
采用Design Expert 10对回归方程进行分析,得出赤水白茶总黄酮提取最佳工艺参数为:甲醇浓度68.66%,超声时间24.46 min,液料比101.88 mL/g,此条件下所得赤水白茶总黄酮提取量最高,预测值为241.14 mg RE/g。结合实验可操作条件,将最佳提取工艺参数修正为甲醇浓度69%,超声时间24 min,液料比102∶1 mL/g,并在此条件下进行了有效性验证,结果显示总黄酮提取量为(243.50±1.16) mg RE/g,与预测值基本一致,并且无统计学显著差异(P>0.05),表明该回归模型所优化的赤水白茶总黄酮提取工艺参数可靠性高,具有实际应用价值。
2.3 体外抗氧化活性
2.3.1 DPPH自由基清除作用 DPPH自由基清除率实验结果表明,赤水白茶总黄酮对DPPH自由基具有较好的清除作用,但较相同浓度的VC略低(图7A)。在总黄酮浓度(Total flavonoids content,TFC)为0~0.20 mg/mL L范围内,对DPPH自由基清除效果与总黄酮浓度呈正相关量效关系,DPPH自由基清除率随总黄酮浓度的升高而增加,浓度为0.40 mg/mL时,对DPPH自由基清除率达到最大值90.1%。计算得到赤水白茶总黄酮对DPPH自由基的半数清除浓度IC50为0.082 mg/mL,高于VC(IC50=0.049 mg/mL)。
2.3.2 ABTS自由基清除作用 由图7B可知,在赤水白茶总黄酮浓度为0.01~0.10 mg/mL范围内,对ABTS自由基清除效果随总黄酮浓度的升高逐渐增强,当浓度达到0.10 mg/mL时,对ABTS自由基清除率可达到99.8%,表明赤水白茶总黄酮对ABTS自由基具有明显的清除作用,但清除效果相比同浓度的VC弱。计算得到赤水白茶总黄酮和VC对ABTS自由基的IC50分别为0.027和 0.018 mg/mL。

图7 赤水白茶总黄酮抗氧化活性
2.3.3 铁离子还原力 还原力能够反映抗氧化剂的电子给出能力,还原力大小可作为抗氧化性强弱的重要指标[23]。由图7C可知,赤水白茶提取物还原力大小与总黄酮浓度呈正相关量效关系,在低浓度范围(0.1~0.8 mg/mL)内,赤水白茶总黄酮还原力弱于相同浓度VC,当浓度达到0.8 mg/mL后,赤水白茶总黄酮还原力大小与VC相当,表明赤水白茶总黄酮具有较强的还原力。
2.3.4 金属离子螯合能力 金属离子(Fe2+)通常作为诱发剂加速脂质的氧化过程,因此可通过测定抗氧化剂对金属离子的螯合力来评价其抗氧化性。黄酮类成分中含有较多的酚羟基基团,可对金属离子产生一定的螯合力。由图7D可知,赤水白茶总黄酮对亚铁离子的螯合能力随浓度的增加而上升,相比同浓度EDTA的螯合力弱,计算得到赤水白茶总黄酮对亚铁离子的IC50为0.781 mg/mL。
3 结论
本研究采用超声辅助提取法提取赤水白茶中总黄酮,在单因素实验的基础上,应用Box-Behnken响应面试验设计优化赤水白茶总黄酮提取工艺,获得最佳工艺参数条件为:甲醇浓度69%,超声时间24 min,液料比102∶1 mL/g,此条件下赤水白茶总黄酮提取量达到243.50 mg RE/g,与预测值相一致无显著差异(P>0.05),表明所优化的赤水白茶总黄酮提取工艺可靠性高,可为后期的工业化提取作为理论参考。体外抗氧化活性实验表明,赤水白茶总黄酮对DPPH自由基和ABTS自由基均具有较强的清除效果,清除率分别可高达90.1%(总黄酮浓度0.4 mg/mL)和99.8%(总黄酮浓度0.1 mg/mL),IC50值分别为0.082和0.027 mg/mL;对亚铁离子具有较好的螯合能力,IC50值为0.781 mg/mL;在浓度为0.8 mg/mL时,还原力与VC相当;赤水白茶总黄酮具有较强的体外抗氧化活性,可作为一种天然抗氧化剂开发利用,提高其附加值和经济效益。

