大孔树脂纯化沉香叶黄酮工艺优化及纯化前后抗氧化性比较
段宙位,陈 婷,何 艾,方宗壮,王世萍,谢 辉,*
(1.海南省农业科学院农产品加工设计研究所,海南海口 571100;2.华中农业大学食品科技学院,湖北武汉 430070;3.江西生物科技职业学院,江西南昌 330200)
沉香(AquilariaagallochaRoxb.)为瑞香科常绿乔木,其含黑色树脂的木质部可作药材,用于治疗胃寒、肾虚、胸闷等症状[1-2]。沉香主要种植于广东、云南、海南等地。据统计,2017年沉香在海南种植面积约10万亩,呈逐年增长的趋势。沉香在种植过程中,产生大量的树叶,常被当做废弃物丢弃,造成资源的浪费。
据报道,沉香叶中含有多糖、黄酮、苷类[3-5]等多种活性物质,应用价值高。黄酮类化合物作为沉香叶中的主要活性成分,具有抗癌、抗炎、抗氧化和免疫调节等作用[6-10],应用前景广阔。研究利用沉香叶中黄酮化合物,这对实现废弃物再利用,提高沉香附加值具有非常重要的意义。现阶段开展了沉香叶黄酮的提取制备工艺研究,主要有纤维素酶辅助有机溶剂提取法[11]和有机溶剂浸提法[12]。但涉及沉香叶黄酮的纯化研究较少。大孔树脂法因其具有污染低、稳定性高、选择性强、易操作等优点[13],常用于黄酮类化合物的分离纯化,如陆英等[14]用HPD500型树脂纯化红薯叶黄酮,黄酮纯度提高至48.87%;徐怀德等[15]用D4020型树脂纯化花椒叶总黄酮,黄酮纯度提高至16.92%。关于大孔树脂纯化沉香叶黄酮的研究尚未见相关报到。因此,本实验在提取沉香叶黄酮的基础上,通过静态和动态实验,确定大孔树脂纯化条件,比较纯化前后黄酮的抗氧化性,以期获得纯度较高、抗氧化性较强的黄酮类化合物,为沉香叶的高值化利用提供参考。
1 材料与方法
1.1 材料与仪器
沉香叶 采自琼海市国营东平农场;1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;大孔树脂NKA-9、AB-8、D201、NKA-Ⅱ、X-5 南开大学化工厂;芦丁标准品 阿拉丁试剂公司;其他试剂为国产分析纯。
VaCo5-80型冻干机 德国Zirbus公司;BSZ-100自动收集器、BT-100恒流泵 上海嘉鹏科技有限公司;CPA225D电子天平 德国Sartorius公司。
1.2 实验方法
1.2.1 沉香叶黄酮的提取 将沉香叶清洗干净,50 ℃烘干,粉碎,过40目筛。按照纤维素酶用量200 U/g,底物浓度3 g/100 mL加入70%乙醇,在55 ℃,pH5条件下浸提3 h,浓缩和干燥后,得沉香叶黄酮提取物[11](以下简称“粗提物”)。
1.2.2 黄酮质量浓度的测定与标准曲线的制作
1.2.2.1 黄酮质量浓度的测定 采用硝酸铝显色法[12]。移取1.0 mL样品液于10.0 mL具塞试管中,用蒸馏水定容至5.0 mL。分别向其中加入5%亚硝酸钠溶液0.5 mL,静置6 min,再加入10%硝酸铝溶液0.5 mL,再放置6 min,再向其中加入1 mol/L氢氧化钠溶液4.0 mL后静置15 min。同时用70%乙醇作空白对照,于510 nm测定吸光值。
1.2.2.2 标准曲线的绘制 参考段宙位等[12]方法建立标准曲线方程。用70%乙醇溶液配制成0.2 mg/mL芦丁标准溶液,分别移取标准溶液(1.0、2.0、3.0、4.0、5.0 mL)于10.0 mL具塞试管中,用蒸馏水定容至5.0 mL。采用1.2.2.1方法测定吸光值,建立标准曲线方程:y=11.975x-0.0325,R2=0.9996,式中x表示芦丁质量浓度,y表示吸光值,芦丁标准溶液在0.02~0.10 mg/mL范围内线性关系良好。
1.2.3 树脂预处理 参考Xiao等[16]方法。用95%乙醇溶液浸泡24 h,用蒸馏水洗至无醇味。将大孔树脂湿法上柱(Φ16 mm×500 mm),分别用4 BV 5% NaOH溶液和2% HCl溶液以3 BV/h的速率淋洗大孔树脂,最后用蒸馏水洗至中性,滤干,备用。
1.2.4 大孔树脂静态吸附与解吸试验
1.2.4.1 树脂的筛选 分别称取预处理好的树脂5.0 g,加入6 mg/mL粗提液100 mL,30 ℃下振荡(180 r/min)吸附3 h,过滤,测定滤液中黄酮质量浓度,即为吸附平衡液黄酮质量浓度;往上述饱和吸附的树脂中加入70%乙醇75 mL,振荡(180 r/min)解吸15 min,过滤,测定滤液中黄酮质量浓度,即为解吸液黄酮质量浓度。按下面公示计算吸附率、解吸率、吸附量和回收率[17]。吸附率(%)=(C0-Ce)/C0×100;解吸率(%)=(Cd×Vd)/[(C0-Ce)×V0]×100;吸附量(mg/g)=(C0-Ce)×V0/M;回收率(%)=(Cd×Vd)/(C0×V0)×100,C0为粗提液黄酮质量浓度(mg/mL);Ce为吸附平衡液黄酮质量浓度(mg/mL);V0为粗提液体积(mL);M为大孔树脂干质量(g);Cd为解吸液黄酮质量浓度(mg/mL);Vd为解吸液体积(mL)。
1.2.4.2 粗提液浓度对吸附效果的影响 往20%(v/v)乙醇配制的3.0、4.0、5.0、6.0、7.0 mg/mL粗提液100 mL中加入NKA-9树脂5.0 g,振摇吸附3.0 h,过滤,测定滤液中黄酮质量浓度,计算吸附率,吸附量。
1.2.4.3 洗脱剂对沉香叶黄酮解吸率的影响 分别取饱和吸附的NKA-9树脂5.0 g,依次加入40%、50%、60%、70%、80%(v/v)乙醇75 mL,振荡解吸15 min,过滤,测定滤液中黄酮质量浓度,计算解吸率。
1.2.5 大孔树脂动态吸附与解吸试验
1.2.5.1 上样流速的确定 采用湿法装柱,将预处理好的NKA-9树脂填充于Φ16 mm×500 mm层析柱内,分别以1.0、1.5、2.0、2.5、3.0、3.5 mL/min流速上柱,测定流出液中黄酮质量浓度,计算吸附率。
1.2.5.2 洗脱流速的确定 将粗提液按上样流速1.5 mL/min上柱,待吸附完全后,用70%乙醇,以速度1.0、1.5、2.0、2.5、3.0 mL/min洗脱,测定流出液中黄酮质量浓度,计算解吸率。
1.2.5.3 动态吸附与洗脱曲线的绘制 将预处理好的NKA-9树脂装于层析柱中。将5 mg/mL的沉香叶黄酮粗提物,以流速1.5 mL/min上柱,按每9 mL一管收集流出液,每10管1个柱体积(BV),测定其黄酮质量浓度。以BV为横坐标,流出液中黄酮质量浓度为纵坐标,绘制动态吸附曲线。待动态吸附完全后,用70%(v/v)乙醇作为洗脱剂,以流速2.0 mg/mL洗脱,测定每0.5个BV中流出液黄酮质量浓度,同上述方法绘制动态洗脱曲线。
1.2.5.4 沉香叶黄酮纯化工艺验证 按照上述纯化条件:选择NKA-9树脂,在上样量60.0 BV,粗提液上样浓度5.0 mg/mL,上样流速1.5 mL/min吸附;在洗脱剂70%(v/v),洗脱流速2.0 mg/mL,洗脱剂用量5 BV条件下洗脱,收集洗脱液,55 ℃条件下浓缩,真空冷冻干燥。准确称取M(g)干燥后的固体,溶于V(mL)70%乙醇中,按照1.2.2.2计算黄酮质量浓度Y(g/mL),按公式:黄酮纯度(%)=Y×V×100/M,计算纯度。按照1.2.4方法计算回收率。
1.2.6 沉香叶黄酮纯化前后抗氧化性比较 采用清除羟自由基法、DPPH自由基法和ABTS自由基法,评价沉香叶黄酮纯化前后的抗氧化性。
1.2.6.1 清除羟自由基能力 参考Li等方法[18]。将沉香叶黄酮粗提物、纯化物和VC配成不同质量浓度的样品液,待用。往1 mL不同浓度样品液中加入1 mL 6 mmol/L硫酸亚铁溶液和1 mL 6 mmol/L过氧化氢溶液,混合均匀,静置10 min后,加入1 mL 6 mmol/L水杨酸溶液,混匀,静置30 min后,510 nm波长处测定吸光度Ai。重复上述步骤,以蒸馏水代替水杨酸在510 nm波长处测定吸光度Aj,用蒸馏水代替样品溶液在510 nm波长下测得的吸光度A0,则待测液对羟自由基清除率的计算为:清除率(%)=[A0-(Ai-Aj)]/A0×100
1.2.6.2 清除DPPH自由基能力 参考Sun等[19]方法,略有改动。取2 mL不同浓度的样品溶液,加入2 mL 6.5×10-5mol/L DPPH溶液,混合后在室温下避光反应30 min,以95%乙醇调零,在517 nm处测吸光度Ai;同时测定2 mL 95%乙醇与2 mL样品液混合后的吸光度Aj以及2 mL DPPH溶液与2 mL 95%乙醇混合后的吸光度A0。自由基清除率(%)=[1-(Ai-Aj)]/A0×100
1.2.6.3 清除ABTS自由基法 参考Stpéhanie等[20]方法,略有改动。取5.0 mL 7 mmol/L的ABTS溶液,加入88.0 μL 140 mmol/L的过硫酸钾,在室温下于暗处反应12~16 h,形成ABTS自由基储备液。在734 nm处,用体积分数70%乙醇将ABTS自由基储备液稀至吸光度为0.70±0.02,备用。准确量取0.1 mL不同浓度样品溶液,加入3.9 mL ABTS溶液,混匀,室温下反应6 min,于734 nm处测定吸光度(AE)。同时吸取3.9 mL ABTS溶液,加入0.1 mL 70%的乙醇溶液于734 nm处测定吸光度(AB)。ABTS自由基清除率按下式计算:ABTS自由基清除率(%)=(AB-AE)/AB×100,式中AB表示空白样吸光度;AE表示样品吸光度。
1.3 数据处理
采用Excle 2007进行数据统计分析,Origin 8.5软件绘制图形。
2 结果与分析
2.1 静态吸附与解吸试验结果
2.1.1 树脂筛选 大孔树脂对黄酮类化合物的吸附与解吸效果与其空间结构、极性、含水率等相关[17]。由表1可知,5种大孔树脂对沉香叶黄酮的吸附率依次为NKA-9>D201>X-5>AB-8>NKA-Ⅱ,解吸率依次为NKA-9>NKA-Ⅱ>X-5>AB-8>D201,其中NKA-9、NKA-Ⅱ、X-5解吸率差别不大。这可能是因为NKA-9树脂极性、结构与理化性质,利于沉香叶黄酮的吸附;二者之间主要靠范德华力、氢键作用,结合能力相对离子键弱,易被破坏,利于洗脱。综合考虑吸附率与解吸率,选择NKA-9大孔树脂用于沉香叶黄酮纯化。

表1 不同树脂对沉香叶黄酮静态吸附与解吸结果
2.1.2 粗提液浓度对吸附效果的影响 粗提液上样浓度与树脂吸附效果密切相关。由图1可知,NKA-9大孔树脂吸附不同浓度沉香叶黄酮粗提液,吸附效果变化的趋势为:随着粗提物浓度增大,沉香叶黄酮的吸附量先迅速增加后缓慢增加,吸附率逐渐降低。粗提液浓度5 mg/mL,为吸附率和吸附量变化的转折点。这是因为粗提液浓度低于5 mg/mL时,NKA-9树脂未达到饱和吸附,随着粗提液浓度增加,单位表面积的树脂与黄酮的接触量越大,吸附量增加;又因树脂表面游离基团减少,吸附率略有下降。当粗提液浓度高于5 mg/mL时,随着树脂表面基团逐渐饱和,传质速度变慢,部分黄酮未被吸附就流出,吸附率下降;又因树脂逐渐达到饱和吸附,吸附量变化不大。综合考虑吸附率与吸附量,选择5.0 mg/mL的粗提液作为树脂吸附黄酮的上样液。
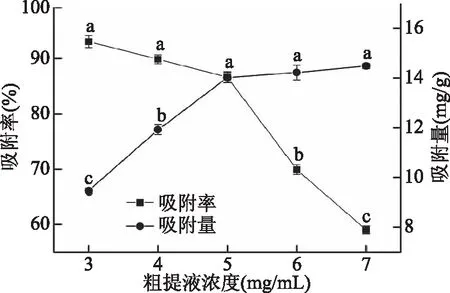
图1 粗提液浓度对树脂吸附效果的影响
2.1.3 洗脱剂对沉香叶黄酮解吸率的影响 由图2可知,70%(v/v)乙醇洗脱树脂时黄酮解吸率最大,增加或降低乙醇浓度,解吸率减小。这是因为乙醇体积分数与其极性相关,70%乙醇的极性易破坏NKA-9树脂与黄酮类化合物吸附的作用位点,把黄酮置换出来,利于解吸。这与苗修港等[21]研究的洗脱剂解吸香椿叶黄酮类化合物变化趋势相似。

图2 乙醇浓度对沉香叶黄酮解吸效果的影响
2.2 动态试验条件的确定
2.2.1 上样流速的确定 由图3可知,NKA-9树脂对沉香叶黄酮的吸附率随上样流速的增加而减小,这是因为上样流速越大,粗提液在柱中停留时间越短,沉香叶黄酮未及时被树脂吸附便流出柱体。流速较慢利于树脂吸附黄酮,然而流速过慢,会降低生产效率,延长周期,不利于生产应用。与上样流速1.0 mL/min相比,1.5 mL/min流速条件下,NKA-9树脂对沉香叶黄酮的吸附率仅下降了1.97%±0.06%,但单位时间粗提液上样量增加了0.5倍。这与杨喆等[22]研究的上样流速对D101大孔树脂吸附山杏核壳总黄酮变化趋势相同。综合考虑,选择1.5 mL/min作为粗提液上样流速。

图3 上样流速对沉香叶黄酮吸附效果的影响
2.2.2 洗脱流速的确定 由图4可知,黄酮解吸率随洗脱流速增加而减小,这是因为洗脱流速较快时,洗脱剂未及时置换出树脂中目标物质(黄酮),洗脱不完全。流速较慢,利于黄酮从树脂中解吸出来,然而流速过慢,会延长生产周期。与洗脱流速1.0 mL/min相比,2.0 mL/min流速条件下,乙醇洗脱树脂的解吸率降低3.16%±0.15%,但同等体积乙醇洗脱树脂所用时间缩短一半。这与李侠等[23]研究的洗脱流速对绿豆皮黄酮解吸效果影响变化趋势相同。综合考虑,选择2.0 mL/min作为乙醇洗脱剂洗脱流速。
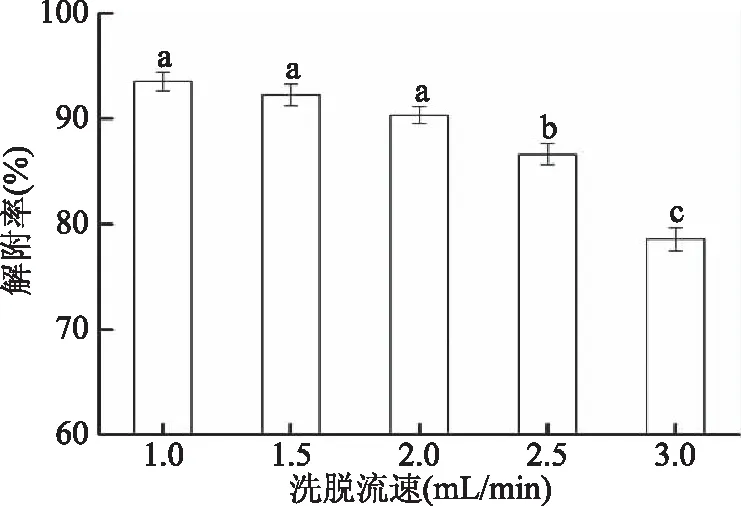
图4 洗脱流速对洗脱效果的影响
2.2.3 沉香叶黄酮动态吸附与洗脱曲线 动态吸附曲线直观反映树脂吸附沉香叶黄酮的情况。由图5可知,随着粗提液上样量增加,流出液中黄酮质量浓度增大。上样量小于30.0 BV时,流出液中黄酮质量浓度低于(172.86±11.12) μg/mL,约为上样中黄酮质量浓度(670.56±38.71) μg/mL的25%,说明上样液中大部分黄酮被NKA-9树脂吸附;上样量大于30.0 BV时,流出液中黄酮浓度快速增加,说明未被吸附的黄酮增加较快;上样量60.0 BV时,流出液中黄酮质量浓度(632.78±31.78) μg/mL接近上样液中黄酮质量浓度,且流出液中黄酮质量浓度趋于稳定。当流出液中黄酮质量浓度接近上样液黄酮质量浓度时,树脂达到吸附饱和[21],因此,60 BV时NKA-9树脂达到饱和吸附。
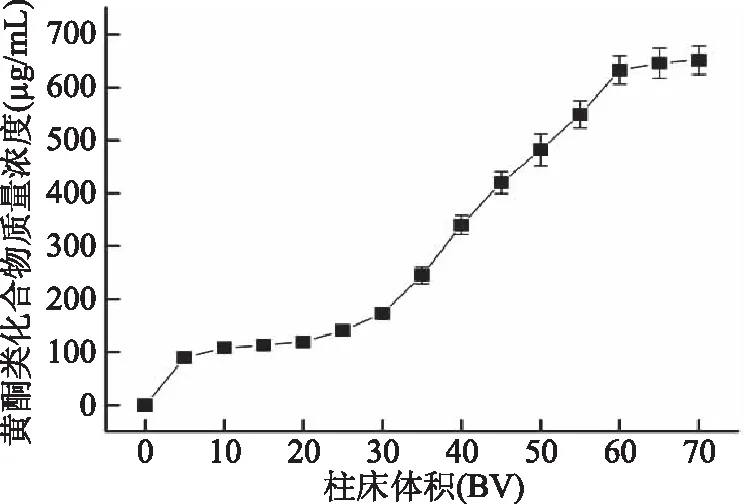
图5 动态吸附曲线
动态洗脱曲线直观地反映树脂解吸沉香叶黄酮的情况。由图6可知,当乙醇用量为1 BV时,流出液中黄酮浓度达到最大值(2050.31±100.62) μg/mL;再增加乙醇用量,流出液中黄酮的浓度迅速降低;当乙醇用量为5 BV时,流出液中黄酮浓度仅为(55.82±2.26) μg/mL,接近于沉香叶黄酮粗提液初始浓度的1/12,且流出液中黄酮质量浓度基本稳定,说明吸附的黄酮基本被解吸完全。
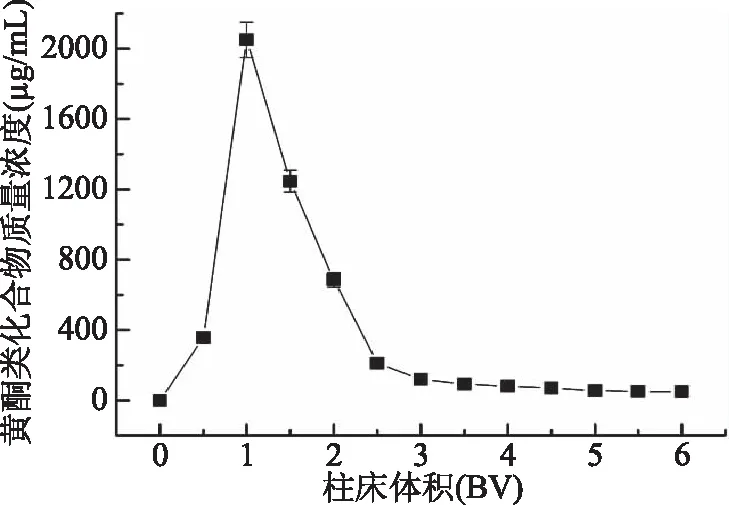
图6 动态洗脱曲线
2.2.4 沉香叶黄酮纯化工艺验证 按照1.2.5.4工艺条件,沉香叶黄酮经NKA-9树脂动态吸附解吸后,纯度提高至76.58%±3.46%,回收率为85.33%±3.72%(相对于沉香叶黄酮粗提物)。
2.3 沉香叶黄酮纯化前后抗氧化性比较
2.3.1 清除羟自由基能力比较 由图7可知,沉香叶黄酮粗提物与纯化物都具有较强的清除羟自由基能力,且随样品浓度增加而增大,这与邵盈盈等[13]研究蓝莓总黄酮清除羟自由基能力变化趋势相似。沉香叶黄酮粗提物、纯化物和VC清除羟自由基的IC50值分别为(0.300±0.015)、(0.120±0.008)、(0.150±0.011) mg/mL,说明沉香叶黄酮纯化后清除羟自由基能力增强,稍强于VC。沉香叶黄酮对羟自由基的清除作用稍强于VC,推测黄酮中可能含有多元羟基基团[13],具体结构尚待进一步验证。

图7 沉香叶黄酮纯化前后清除羟自由基能力比较
2.3.2 清除DPPH自由基能力比较 由图8可知,沉香叶黄酮粗提物与纯化物都具有较强的清除DPPH自由基能力,且随样品浓度的增加而增大,这与闫蕊等[24]研究黄花油点草黄酮清除DPPH自由基能力变化趋势相似,但其清除能力明显强于黄花油点草黄酮,这是因为不同植物中黄酮的种类与结构不同,表现出的抗氧化性能力不同。沉香叶黄酮粗提物、纯化物和VC清除DPPH自由基的IC50值分别为(0.170±0.008)、(0.016±0.009)、(0.0057±0.0004) mg/mL,说明沉香叶黄酮纯化物后清除DPPH自由基能力增强,更接近于VC。

图8 沉香叶黄酮纯化前后清除DPPH自由基能力比较
2.3.3 清除ABTS自由基能力比较 由图9可知,沉香叶黄酮纯化前后对ABTS自由基的清除能力随样品浓度的增加而增大,这一结果与艾薇等[25]对藿香叶黄酮清除ABTS自由基能力变化趋势相似。沉香叶黄酮粗提物、纯化物和VC清除ABTS自由基的IC50值分别(0.160±0.009)、(0.042±0.002)、(0.0067±0.0004) mg/mL,说明沉香叶黄酮纯化后清除ABTS自由基能力增强,更接近于VC。
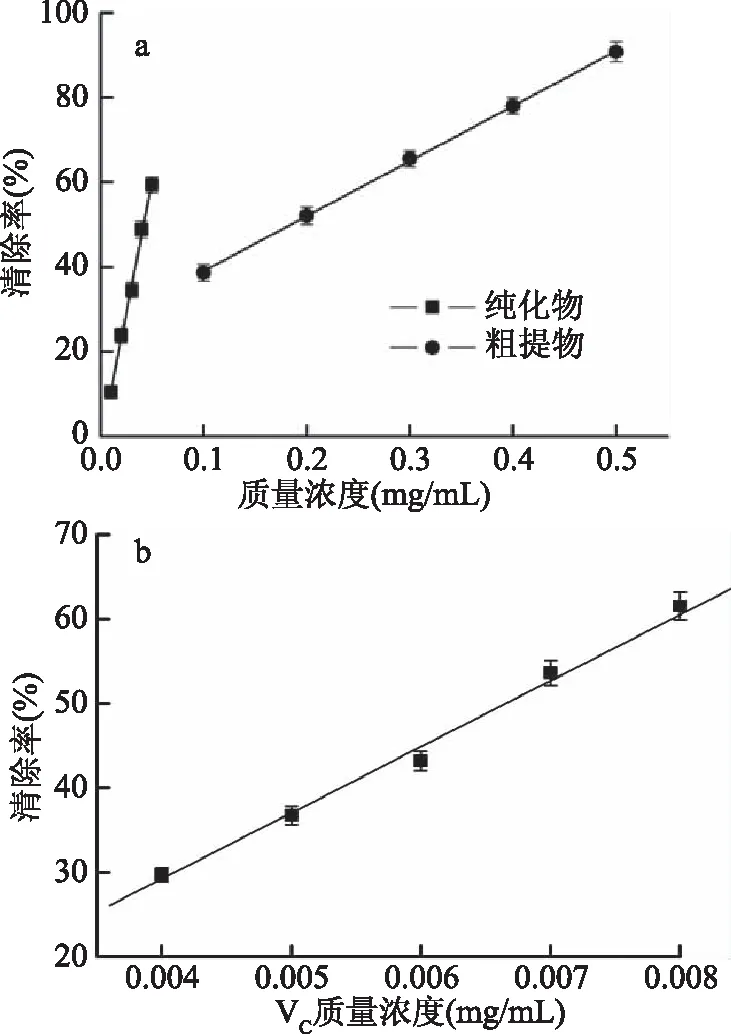
图9 沉香叶黄酮纯化前后清除ABTS自由基能力比较
3 结论
通过树脂吸附-解吸试验,确定NKA-9大孔树脂分离纯化沉香叶黄酮效果最佳。NKA-9大孔树脂的纯化条件为:以1.5 mL/min速度将5.0 mg/mL粗提液通过层析柱,用70%(v/v)乙醇以2.0 mg/mL速度洗脱。此条件下,树脂吸附量为(16.52±1.16) mg/g,黄酮回收率为85.33%±3.72%(相对于沉香叶黄酮粗提物),纯度提高至76.58%±3.46%。通过抗氧化性实验得出:沉香叶黄酮纯化后清除羟自由基、DPPH自由基和ABTS自由基IC50值分别为(0.120±0.008)、(0.016±0.009)、(0.042±0.002) mg/mL,远低于纯化前的(0.300±0.015)、(0.170±0.008)、(0.160±0.009) mg/mL,说明沉香叶黄酮纯化前后均具有较强的抗氧化性,经过NKA-9大孔树脂纯化后沉香叶黄酮的抗氧化性明显增强。沉香叶黄酮经大孔树脂吸附分离后,糖类、蛋白质、无机盐等杂质大幅度减少,纯度增加,抗氧化性增强,这对沉香叶的工业化生产应用具有一定的指导意义。

