慢性牙周炎在腹膜透析患者中的发病状况及其与患者透析充分性 的相关性研究
邓 海,佟 琰,Kristine SUN,夏欣怡,李 璞,张春丽,胡 春,宋忠臣,刘英莉
1. 上海交通大学医学院附属第九人民医院肾脏内科,上海 200011;2.上海交通大学医学院附属第九人民医院·口腔医学院牙周病科,国家 口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海 200011
慢性肾脏病(chronic kidney disease,CKD)的防治已成为全球重要公共卫生问题[1],腹膜透析(简称腹透,peritoneal dialysis,PD)是终末期肾脏病患者常用的肾脏替代治疗方式。慢性牙周炎(chronic periodontitis,CP)是一种以菌斑生物膜为始动因子的口腔慢性感染性疾病,已成为牙齿缺失的主要原因[2]。近年来越来越多研究提示CKD 与CP 之间关系密切,其中一项前瞻性研究[3]表明CP 可独立增加CKD 患者的全因死亡率,可视为CKD 患者一个非传统的危险因素;两者之间的关系可能是基于共同的病理生理基础——慢性炎症[4]。
充分透析是保证腹透患者生活质量的必要条件,而近年来已有研究提示CP 可能影响腹透患者透析充分性。首先,患有CP 的CKD 患者外周血炎症标志物水平更高[白细胞介素6(interleukin 6,IL-6)和C 反应蛋白(C-reaction protein,CRP)等][5],而IL-6 和C 反应蛋白水平的升高与炎症性贫血[6-7]、腹透患者转运模式[8]、营养状况[9]密切相关;其次,患有CP 的血液透析(简称血透,hemodialysis)患者具有更高的钙、磷水平[10-11],高钙血症是腹透患者无动力性肾性骨病进展的主要危险因素之一[12-13],而CP 是否影响腹透的钙、磷水平目前无研究报道。本研究以单中心的人群为基础,采用横断面调查研究方法观察CP 的发病情况以及其与腹透患者透析充分性(包括贫血、营养状况以及肾性骨营养不良等方面)的相 关性。
1 对象与方法
1.1 研究对象
选取2018 年12 月—2019 年12 月于上海交通大学附属第九人民医院肾脏内科行维持性腹透的患者。入选标准:①终末期肾病。②18 ~80 岁。③维持性腹透患者,透析龄≥3 个月。排除标准:①全口牙列缺失或全口烤瓷牙。②在行透析充分性评估及腹膜平衡试验时的近2 周内发生过腹透相关性腹膜炎或其他感染。③曾接受常规血透治疗。④曾接受肾移植。⑤曾行甲状旁腺切除术。⑥全身性疾病,如恶性肿瘤、艾滋病和肉芽肿病等。⑦慢性酒精中毒和/或药物依赖。⑧使用抗惊厥药、糖皮质激素或其他免疫抑制剂。
1.2 研究方法
1.2.1 患者资料收集 所有纳入研究的患者均接受透析充分性及CP 评估。收集患者基本信息(包括年龄、性别、透析龄、体质量指数、是否存在残肾功能,以及高血压、糖尿病、冠状动脉粥样硬化病史);并收集腹透患者透析充分性评估的指标,包括2018 年12 月1 日之后最近一次的腹膜平衡试验(peritoneal balance test,PET)结果、尿素清除指数(Kt/V)、肌酐清除率(creatinine clearance rate,Ccr)、标准蛋白分解率(normalized protein catabolic rate,nPCR)、白蛋白(albumin,ALB)、肌酐、校正钙(corrected total calcium,TCa)、磷、血红蛋白(hemoglobin,Hb)、CRP、甲状旁腺激素(parathyroid hormone,PTH);同时收集其他相关实验室指标,包括血清B 型钠尿肽(B-type natriuretic peptide,BNP)、胆固醇、三酰甘油、血清铁(serum iron,SI)、叶酸、维生素B12、铁蛋白(serum ferritin,SF)、转铁蛋白饱和度(transferrin saturation,TSAT)等;收集腹透患者CP 相关数据,包括临床附着丧失(clinical attachment loss,CAL)、牙龈指数(gingival index,GI)、探诊深度(probing depth)。患者病历资料库和血液标本库均由腹透专职护士负责,研究数据的录入和核对也由专人负责,CP临床评估由口腔科医师负责。
1.2.2 评价标准 腹透充分性评价标准:Hb ≥ 110 g/L,ALB ≥ 35 g/L,2.2 mmol/L ≤ TCa ≤ 2.6 mmol/L[TCa=血 清钙+0.02× (40-ALB)[14]],磷≤1.78 mmol/L,150 pg/mL ≤ PTH ≤ 300 pg/mL,CRP<10 mg/dL, 总Kt/V≥ 1.7/ 周,总Ccr ≥ 50 L/ (周·1.73 m2)。本标准参考了美国肾脏病预后质量倡议(Kidney Disease Outcomes Quality Initiative,KDOQI)指南。
CP 评价标准:根据牙周疾病分类标准[15],将牙龈有炎症和探诊出血,探诊深度≤4 mm,1 mm ≤CAL ≤2mm定义为轻度CP;将牙龈有炎症和探诊出血,4 mm<探诊深度≤6 mm,3 mm ≤CAL ≤4 mm,可能有牙齿轻度松动定义为中度CP;将探诊深度>6 mm,CAL ≥5 mm,多根牙有分叉病变,牙多有松动,炎症明显或发生牙周脓肿定义为重度CP。当CAL 介于2 ~3 mm 和4 ~5 mm时,需结合探诊深度和牙齿松动等表现来判定牙周炎 程度。
铁缺乏情况评价标准[16-17]:功能性铁缺乏定义为TSAT<20%,SF>100 ng/mL;绝 对 铁 缺 乏 定 义 为TSAT<20%,SF ≤100 ng/mL。
1.3 统计学分析
采用EpiDate3.1 建立数据库,SPSS 24.0 进行统计分析。正态分布的定量资料用x—±s描述,非正态分布的定量资料以M(Q1,Q3)描述,组间比较分别采用t检验或Wilcoxon 检验;定性资料用频数(百分数)描述,组间比较采用χ2检验。2 个连续变量之间的相关性采用Pearson 相关系数表示。逐步线性回归分析中纳入的变量是既往研究中与因变量相关以及单因素相关性分析中显示相关的变量。P<0.05 视为差异有统计学意义。
2 结果
2.1 入组患者的基本情况
本研究共获得65 例患者的知情同意,其中6 例患者因全口牙列缺失、1 例因腹透转为血透、1 例因全口烤瓷牙被排除,最终纳入研究的患者共57 例,其中男性31 例,女性26 例;持续性非卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD)40 例,占70%。所有患者均患有不同程度CP,包括中度CP 14 例(24.6%),重度CP 43 例(75.4%),无轻度CP 病例。中度CP 组和重度CP 组患者的基线特征和临床指标见表1。2 组患者的一般特征、腹透充分性相关指标、铁代谢相关指标、炎症相关指标的差异无统计学意义(均P>0.05)。

表1 不同程度CP 患者的一般特征和临床参数Tab 1 General characteristics and clinical parameters of different degrees of CP patients
2.2 不同程度CP 组患者透析充分性指标达标率、铁缺乏、贫血状况的比较
根据透析充分性评价标准,分别比较2 组患者相关指标达标情况以及铁缺乏情况。如表2 所示,2 组患者在总Kt/V、总Ccr、Hb、ALB、TCa、磷、PTH、CRP 达标及铁缺乏情况上比较,差异均无统计学意义(均P>0.05)。表3 显示,不同程度CP 组患者不同程度贫血的分布情况比较,差异无统计学意义(P>0.05)。
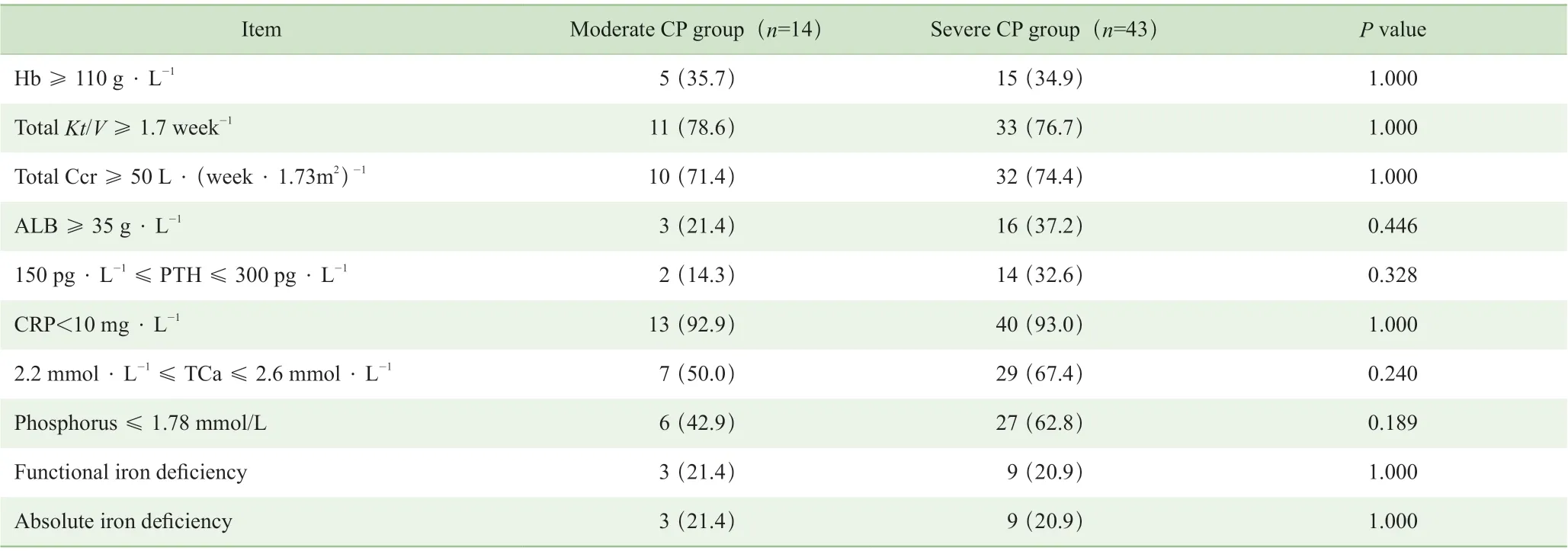
表2 不同程度CP 患者透析充分性相关指标达标率及铁缺乏情况的比较[n (%) ]Tab 2 Comparison of the control rates of related indicators of dialysis adequacy and iron deficiency in the patients with different degrees of CP [n (%)]
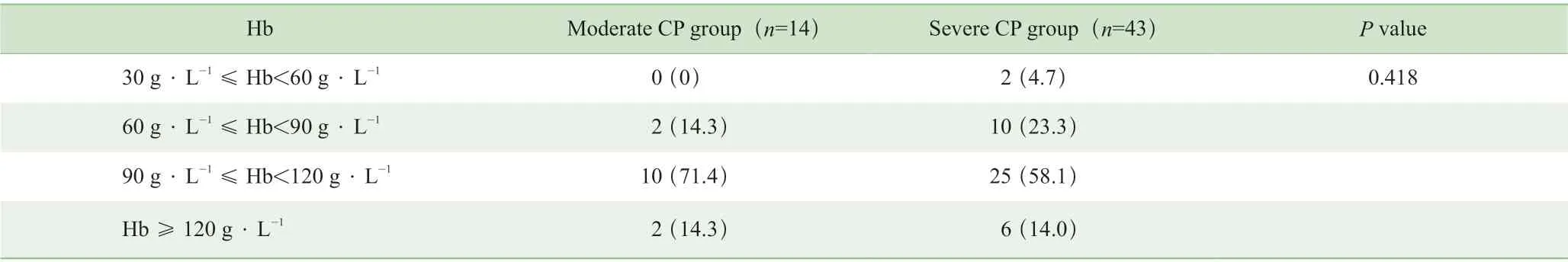
表3 不同程度CP 患者不同程度贫血分布情况的比较[n (%) ]Tab 3 Comparison of anemia in different degrees among the patients with different degrees of CP [n (%)]
2.3 CP 评价指标与腹透相关指标之间的关系
如表4 所示,CP 评价指标与腹透相关指标之间的Pearson 相关性分析结果显示,GI 与PTH、腹透Kt/V呈弱相关,相关系数r分别为-0.277 和0.285(均P<0.05)。而PTH,除GI 外,还与磷(r=0.353,P=0.007)、nPCR相关(r=0.406,P=0.003);腹透Kt/V,除GI 外,还与总Kt/V(r=0.459,P=0.000)、校正钙(r=0.516,P=0.000)、残 肾Ccr(r=-0.344,P=0.009) 及 腹 透Ccr(r=0.773,P=0.000)相关。如表5、表6 所示,在逐步线性回归分析校正其他相关因素后发现,GI 与PTH 及腹透Kt/V无明显相关性。

表4 CP 相关指标与腹透相关指标达标率之间的Pearson 相关系数(r)Tab 4 Pearson correlation coefficient between related indices of CP and peritoneal dialysis (r)

表5 逐步线性回归分析PTH 的独立相关因素Tab 5 Independent factors related to PTH analyzed by stepwise linear regression analysis
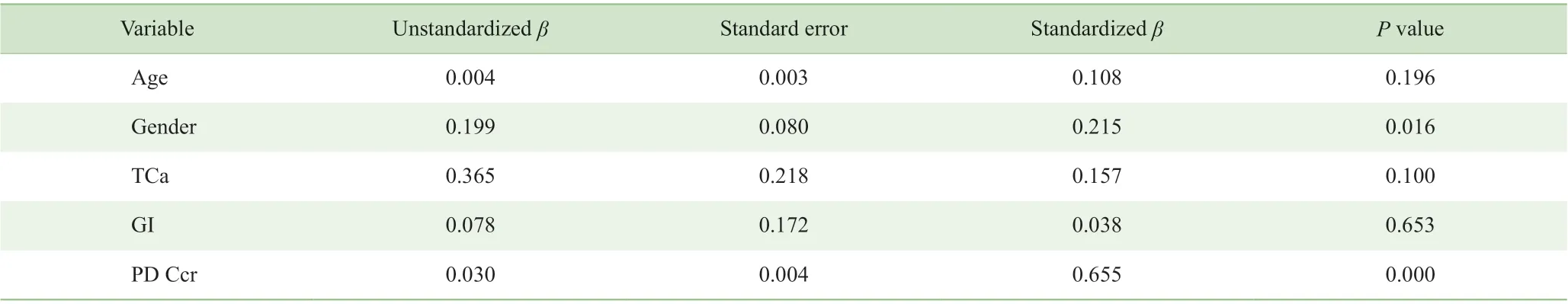
表6 逐步线性回归分析腹透Kt/V 的独立相关因素Tab 6 Independent factors related to PD Kt/V analyzed by stepwise linear regression analysis
3 讨论
CP 是一种慢性炎症状态。患有CP 的健康对照及血透患者均具有更高水平的全身炎症标志物[5,18]。众所周知,IL-6 是铁调素(hepcidin)生成最重要的细胞因子,铁调素-IL-6 轴异常会导致炎症期间的铁缺乏[6],进一步促进炎症性贫血的发生[7]。在本研究中首先观察到所有腹透患者均患有CP,其中重度CP 占75.4%(43 例),比既往国外研究中腹透患者重度CP 的患病率(42%)更高[19]。而我国第4 次全国口腔健康流行病学调查显示35 ~44 岁、55 ~64 岁、65 ~74 岁 年 龄 组CAL ≥4 mm 的 检 出 率分别为33.2%、69.9%和71.3%,提示我国中老年人群牙周健康较差,可能与我国成人牙周疾病知晓率及重视程度低,以及牙周疾病预防率较低有关[20]。此外,腹透患者的唾液中的肝细胞生长因子(hepatocyte growth factor,HGF)水平高于健康人群[21],而HGF 与牙周疾病的发生和发展密切相关[22],具体机制有待进一步研究。
既往研究[23]显示,CP 更严重的血透患者全身炎症标志物也更高,但在本研究中未观察到类似现象。本研究中,不同程度CP 患者间炎症指标的差异均无统计学意义。一项前瞻性研究[24]显示,血透患者的血清炎症标志物水平(如高敏CRP)高于腹透患者,而血透相关的炎症反应增强可能与Th1 有关,因此血透和腹透之间可能存在Th1细胞因子清除的差异。此外,虽然本研究结果显示不同程度CP 组患者的不同程度贫血分布之间未达统计学意义,但重度CP 组比中度CP 组中重度贫血的比例更高(28.0%vs14.3%),提示CP 可能影响了患者贫血的纠正,本研究之所以未得出具有统计学意义的结果可能与样本量较少有关。尽管如此,有meta 分析[25]显示CP 与炎症性贫血密切相关,提示临床上不可忽视CP 对腹透患者贫血的影响。
既往研究已经证实高腹膜溶质转运率(peritoneal small solute transport rate,PSTR)的腹透患者营养状态更差[9],预后不良[26];并且队列研究[8]显示透析液IL-6 浓度与PSTR 显著相关;同时,透析液IL-6 浓度与血浆IL-6水平相关,且血浆IL-6 浓度可独立预测患者预后。本研究中,不同程度CP 患者间nPCR、ALB、IL-6、Kt/V、Ccr 等指标,以及透析充分性相关指标达标率差异均无统计学意义,且CP 相关指标探诊深度及CAL 与透析充分性相关指标之间无相关性,仅GI 与PTH 及腹透Kt/V呈弱相关,但在校正年龄、性别等因素后无显著相关性。虽然既往研究[5]提示患有CP 的非透析CKD 患者较无CP 的患者全身炎症标志物水平更高,但本研究由于缺少无CP 的腹透患者对照,只能观察不同程度CP 对腹透患者炎症因子的影响,亦未能得出CP 对该类患者炎症指标具有影响的结论。有研究[27]显示CAPD 患者与非透析CKD 患者间高敏CRP 水平无明显差异,因此同时患有CP 的腹透患者并未显示更高的炎症标志物水平是否能够归因于腹透对炎症因子的清除,有待进一步研究。
无动力性肾性骨病是CAPD 患者最常见的肾性骨营养不良[28],高钙血症是导致其进展的主要危险因素之一[12-13]。既往研究[10-11]显示,血透患者中CP 更严重的患者具有更高的血清钙、磷水平;但本研究并未得出类似的结果,可能的原因是腹透及血透不同的透析模式在矿物质和骨代谢中发挥的作用不同。CAPD 是一种连续的肾脏替代治疗,与血透患者相比,血清钙、磷和PTH 水平保持相对稳定;有研究[29]显示,与CAPD 患者相比,血透患者的血清钙水平较高;队列研究[30]的结果亦提示延长每周血透时间降低血清磷的同时会升高血清钙,提示血透可能会促进患者形成高钙血症,具体机制不明。而既往合并CP 的血透患者的研究基本未考虑血透本身对钙磷代谢的影响,其设计也仅是横断面研究,有待进一步研究确定CP 对透析患者矿物质、骨代谢调节的影响。
本研究报道了腹透患者中CP 的发病状况及其与透析充分性的相关性,有一定的探索意义,但仍有一些不足:首先,本研究是一项横断面研究,未对CP 患者进行干预,不能建立CP 与透析充分性之间的因果关系;其次,没有考虑到红细胞生成刺激剂、磷结合剂等药物使用造成的偏倚;最后,本研究样本量较少,且缺少合并轻度CP 和未合并CP 的腹透患者,不能确定这2 种类型患者与合并中、重度CP 患者之间的差异,有待后续研究进一步补充 完善。
综上所述,本研究结果显示,腹透患者中、重度CP患病率极高;重度CP 组有发生中、重度贫血的倾向,CP严重程度与腹透患者透析充分性相关指标及达标率之间没有明显相关性。然而,CP 是否影响腹透患者心血管并发症、腹膜感染等的发生,是否影响腹透患者的透析龄和全因死亡率,尚需进一步的队列研究。鉴于腹透患者较高的重度CP 患病率,以及CP 是心血管疾病的独立危险因素,提示临床医师不可忽视腹透患者的牙周疾病,积极改善患者牙周健康可以提高患者的生活质量。
参·考·文·献
[1] Glassock RJ, Warnock DG, Delanaye P. The global burden of chronic kidney disease: estimates, variability and pitfalls[J]. Nat Rev Nephrol, 2017, 13(2): 104-114.
[2] Zhang Q, Li ZX, Wang CX, et al. Prevalence and predictors for periodontitis among adults in China, 2010[J]. Glob Health Action, 2014, 7: 24503.
[3] Sharma P, Dietrich T, Ferro CJ, et al. Association between periodontitis and mortality in stages 3-5 chronic kidney disease: NHANES Ⅲ and linked mortality study[J]. J Clin Periodontol, 2016, 43(2): 104-113.
[4] Fisher MA, Taylor GW, West BT, et al. Bidirectional relationship between chronic kidney and periodontal disease: a study using structural equation modeling[J]. Kidney Int, 2011, 79(3): 347-355.
[5] Bastos Jdo A, Vilela EM, Henrique MN, et al. Assessment of knowledge toward periodontal disease among a sample of nephrologists and nurses who work with chronic kidney disease not yet on dialysis[J]. J Bras Nefrol, 2011, 33(4): 431-435.
[6] Nemeth E, Rivera S, Gabayan V, et al. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin[J]. J Clin Invest, 2004, 113(9): 1271-1276.
[7] Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation[J]. Blood, 2003, 102(3): 783-788.
[8] Lambie M, Chess J, Donovan KL, et al. Independent effects of systemic and peritoneal inflammation on peritoneal dialysis survival[J]. J Am Soc Nephrol, 2013, 24(12): 2071-2080.
[9] Guan JC, Bian W, Zhang XH, et al. Influence of peritoneal transport characteristics on nutritional status and clinical outcome in Chinese diabetic nephropathy patients on peritoneal dialysis[J]. Chin Med J, 2015, 128(7): 859-864.
[10] Naghsh N, Sabet NK, Vahidi F, et al. Relationship between periodontal disease and serum factors in patients undergoing hemodialysis[J]. Open Dent J, 2017, 11: 701-709.
[11] Rodrigues VP, Libério SA, Lopes FF, et al. Periodontal status and serum biomarkers levels in haemodialysis patients[J]. J Clin Periodontol, 2014, 41(9): 862-868.
[12] Sanchez CP. Adynamic bone revisited: is there progress?[J]. Perit Dial Int, 2006, 26(1): 43-48.
[13] Andress DL. Adynamic bone in patients with chronic kidney disease[J]. Kidney Int, 2008, 73(12): 1345-1354.
[14] Payne RB, Little AJ, Williams RB, et al. Interpretation of serum calcium in patients with abnormal serum proteins[J]. Br Med J, 1973, 4(5893): 643-646.
[15] 孟焕新. 牙周病学[M]. 4 版. 北京: 人民卫生出版社, 2012: 170.
[16] Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis[J]. Blood, 2010, 116(23): 4754-4761.
[17] Thomas DW, Hinchliffe RF, Briggs C, et al. Guideline for the laboratory diagnosis of functional iron deficiency[J]. Br J Haematol, 2013, 161(5): 639-648.
[18] Paraskevas S, Huizinga JD, Loos BG. A systematic review and meta-analyses on C-reactive protein in relation to periodontitis[J]. J Clin Periodontol, 2008, 35(4): 277-290.
[19] Brito F, Almeida S, Figueredo C M, et al. Extent and severity of chronic periodontitis in chronic kidney disease patients[J]. J Periodontal Res, 2012, 47(4): 426-430.
[20] Zhao Q, Wang SB, Xu GD, et al. Periodontal health: a national cross-sectional study of knowledge, attitudes and practices for the public oral health strategy in China[J]. J Clin Periodontol, 2019, 46(4): 406-419.
[21] Wilczyńska-Borawska M, Borawski J, Bagińska J, et al. Hepatocyte growth factor in saliva of patients with renal failure and periodontal disease[J]. Ren Fail, 2012, 34(8): 942-951.
[22] Ohshima M, Sakai A, Ito K, et al. Hepatocyte growth factor (HGF) in periodontal disease: detection of HGF in gingival crevicular fluid[J]. J Periodont Res, 2002, 37(1): 8-14.
[23] Oncel M, Akbulut S, Toka Ozer T, et al. Cytokines, adipocytokines and inflammatory markers in patients on continuous ambulatory peritoneal dialysis and hemodialysis[J]. Ren Fail, 2016, 38(7): 1071-1075.
[24] Vilela EM, Bastos JA, Fernandes N, et al. Treatment of chronic periodontitis decreases serum prohepcidin levels in patients with chronic kidney disease[J]. Clinics (Sao Paulo), 2011, 66(4): 657-662.
[25] Brimble KS, Walker M, Margetts PJ, et al. Meta-analysis: peritoneal membrane transport, mortality, and technique failure in peritoneal dialysis[J]. J Am Soc Nephrol, 2006, 17(9): 2591-2598.
[26] Niikura T, Maruyama Y, Nakashima S, et al. Hepcidin/ferritin ratios differ among non-dialyzed chronic kidney disease patients, and patients on hemodialysis and peritoneal dialysis[J]. Ther Apher Dial, 2019, 23(4): 341- 346.
[27] Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD)[J]. Kidney Int Suppl, 2009(113): S1-S130.
[28] Kong XL, Zhang LX, Zhang L, et al. Mineral and bone disorder in Chinese dialysis patients: a multicenter study[J]. BMC Nephrol, 2012, 13: 116.
[29] Zhan ZP, Smyth B, Toussaint ND, et al. Effect of extended hours dialysis on markers of chronic kidney disease-mineral and bone disorder in the ACTIVE Dialysis study[J]. BMC Nephrol, 2019, 20(1): 258.

