人ACE2蛋白结构和功能的生物信息学分析
段瑞芳,武翠玲,王牛牛,任晨霞
血管紧张素转化酶2(Angiotensin I converting enzyme 2, ACE2),该基因编码的蛋白质属于二肽基羧二肽酶的血管紧张素转化酶家族[1],被证明是严重急性呼吸综合征病毒(Sever acute respiratory syndrome coronavirus, SARS-CoV)的功能性受体[2-3],最近又被证明是新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)受体[4]。研究表明ACE2极大地促进了SARS-CoV复制的效率,SARS-CoV S蛋白介导细胞间融合的能力取决于ACE2蛋白的存在[2]。人、小鼠和大鼠对SARS-CoV病毒的感染效率与各物种的ACE2支持病毒复制的能力相关[5-7],阻断ACE2结合SARS-CoV S蛋白的抗体可保护小鼠免受SARS-CoV病毒感染[8]。自2002年SARS-CoV暴发以来,广泛的结构分析揭示了SARS-CoV穗蛋白受体结合域(Receptor-binding domain, RBD)与宿主受体ACE2之间的相互作用,该相互作用调节了SARS-CoV的物种和人类之间的传播。目前已有研究发现,SARS-CoV-2的 RBD序列(包括直接接触ACE2的受体结合基序(Receptor-binding motif, RBM)与SARS-CoV的序列相似,SARS-CoV-2 RBM中的几个关键残基与人ACE2有良好的相互作用,虽然SARS-CoV-2 RBM中的其他几个关键残基与ACE2结合不理想,但这些证件仍表明ACE2为致使人类细胞感染SARS-CoV-2病毒的受体[9]。此外,石正丽课题组的研究报道,确认新型冠状病毒SARS-CoV-2进入细胞的方式与SARS-CoV病毒一致,都是通过ACE2受体介导。他们对不同物种中ACE2是否为介导SARS-CoV-2病毒进入细胞的受体进行研究发现,除小鼠外,SARS-CoV-2病毒可进入人类、中华菊头蝠、果子狸和猪等物种表达ACE2的HeLa细胞,但SARS-CoV-2病毒不能进入未表达ACE2的HeLa细胞中[4]。对72个人体组织的实时定量PCR分析表明,ACE2 mRNA在支气管和肺实质以及心脏,肾脏和胃肠道中高效表达[10]。这也与新型冠状病毒SARS-CoV-2引起呼吸系统、消化道反应为主的症状高度吻合。基于这些研究,对ACE2基因和蛋白进行结构和功能进行生物信息学分析具有重要意义,以期为此次新型冠状病毒SARS-CoV-2的作用机制及治疗提供一定的理论支持。
1 材料与方法
1.1材料 ACE2的氨基酸序列由NCBI数据库中GenBank中下载,检索号为NP_001358344.1。
1.2方法 运用Promoter Scan软件对ACE2基因的启动子与相关转录因子进行预测;分别使用SMOPA、Swiss-Model数据库对ACE2蛋白的二级结构、三级结构进行预测;通过SignalP5.0软件预测出ACE2蛋白信号肽区域;用TMHMM对其跨膜结构进行预测;ACE2蛋白的理化性质与亲疏水性分别用ProtParam、ProtScale进行分析;利用NetNGlyc1.0Server和NetOGlyc4.0Server软件对ACE2蛋白的N-糖基化和O-糖基化位点进行在线分析;经过Netphos3.1aServer分析出ACE2蛋白的磷酸化位点;此外,ACE2蛋白的相关作用蛋白也通过String在线服务器做了预测,并对ACE2的互作蛋白进行GO和KEGG功能富集分析,分析结果利用Image GP作图展示。
2 结 果
2.1ACE2蛋白二级结构预测 获得ACE2蛋白序列后,在SMOPA数据库中对ACE2蛋白质的二级结构进行预测。图1显示为预测结果,其中α螺旋占比超过一半以上达51.18%,α螺旋有利于蛋白质结构的稳定,因此ACE2蛋白二级结构中如此高的α螺旋结构暗示此蛋白构象稳定。无规则卷曲常位于蛋白质的特异性功能部位,常出现在蛋白质表面,无规卷曲在该蛋白二级结构中占比达33.42%,符合ACE2蛋白作为受体蛋白的性质。其次,延伸结构和β转角分别占比11.18%和4.22%。

图1 ACE2蛋白二级结构预测Fig.1 Prediction of secondary structure of ACE2 protein
2.2ACE2蛋白三级结构预测 三级结构预测通过Swiss-Model 数据库进行,首先将目的蛋白在数据库中已有的蛋白进行序列比对后,选择相似度高或同源蛋白质进行自动化比对建模,从而预测未知蛋白质的三级结构,ACE2蛋白三级结构预测的结果如图2所示。
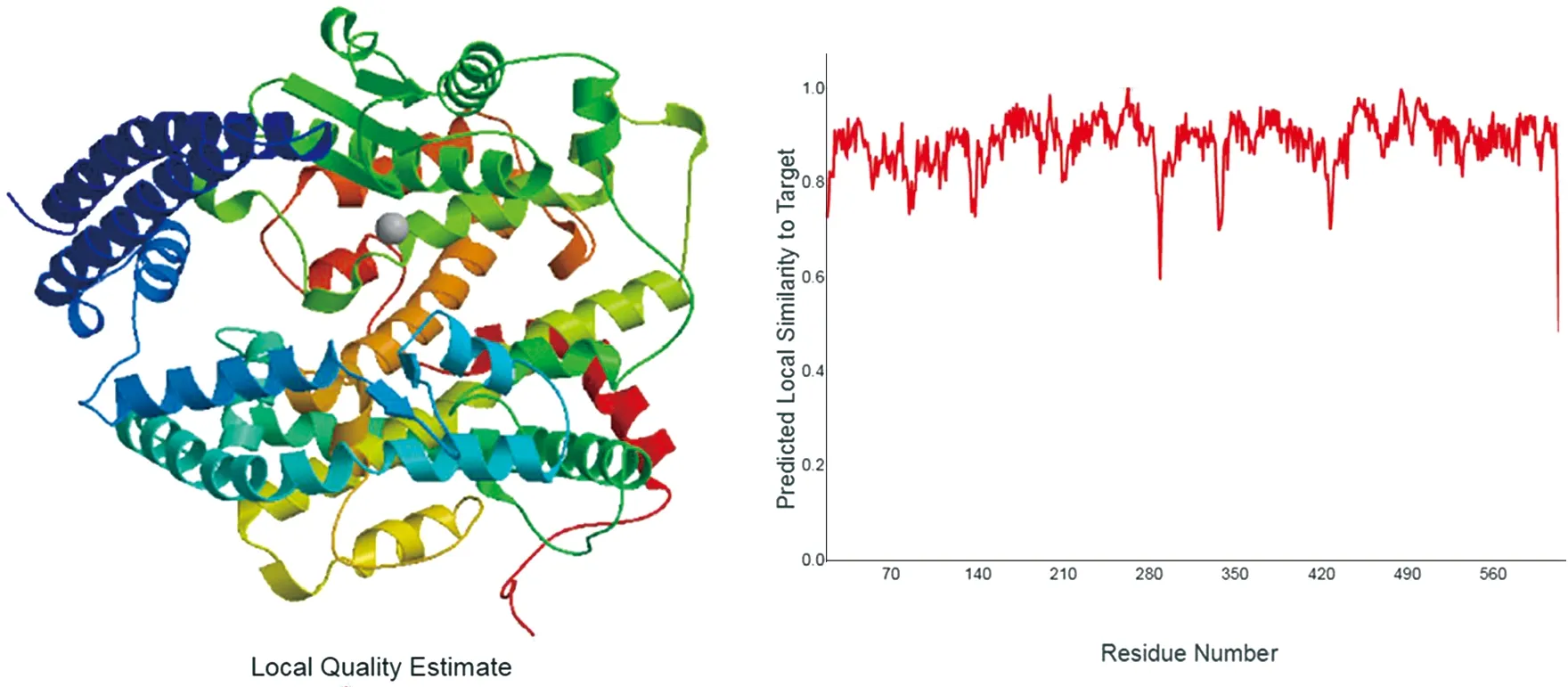
图2 ACE2蛋白三级结构预测及其同源蛋白相似性波形图Fig.2 Prediction of secondary structure of ACE2 protein and homologous protein similarity waveform
2.3ACE2蛋白信号肽序列 SignalP5.0软件用于ACE2蛋白信号肽序列分析,输入ACE2氨基酸序列N端前70个氨基酸,通过预测这段氨基酸序列中是否存在潜在酶切位点,从而预测蛋白是否存在信号肽。如图3所示,ACE2存在信号肽,切割位点位于第19-20位氨基酸残基之间。
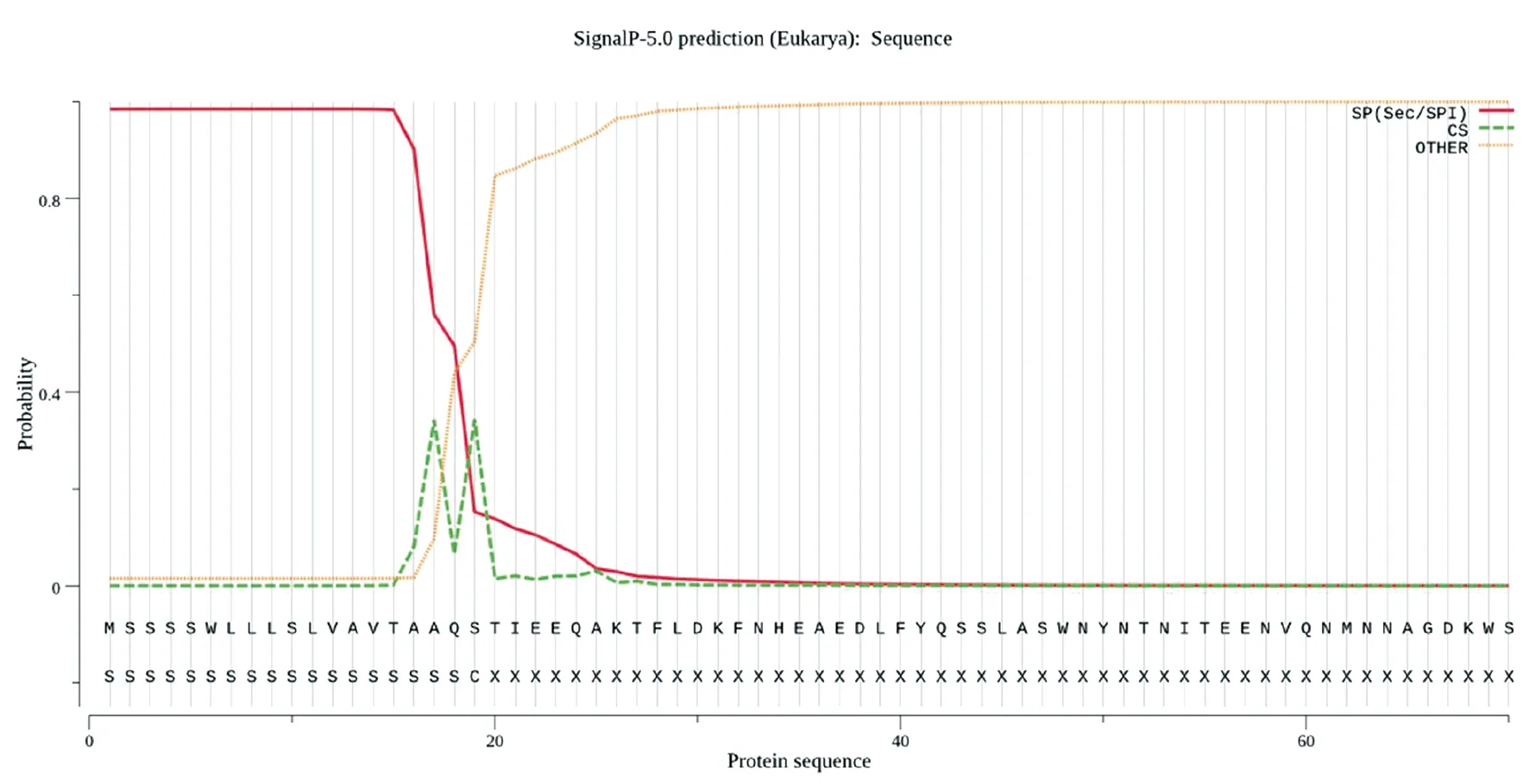
图3 ACE2 蛋白信号肽分析Fig.3 Signal peptide analysis of ACE2 protein
2.4ACE2蛋白跨膜结构分析 TMHMM软件被用于ACE2蛋白的跨膜结构信息预测,结果见图4。预测结果显示,ACE2氨基酸序列中1-740位氨基酸位于细胞膜外,跨膜区位741-761位氨基酸序列,764-805位氨基酸位于细胞内。ACE2蛋白的氨基酸有90%以上位于细胞膜外,此结果与ACE2蛋白成为SARA-Cov和SARS-CoV-2病毒受体的研究结果高度匹配。

图4 ACE2蛋白跨膜区的预测Fig.4 Prediction of transmembrane region of ACE2 protein
2.5ACE2蛋白的理化性质 使用ProtParam软件对ACE2蛋白的理化性质进行预测。ACE2蛋白由805个氨基酸序列组成,蛋白分子量为92 463.04,总分子式为C4170H6358N1092O1222S35,总原子数为12 877,其中带正电荷的氨基酸残基Arg(arginine)和Lys(lysine)占 9.7%(78/805);带负电荷的氨基酸残基 Asp(asparticacid)和Glu(glutamicacid)占 12.3%(99/805)。软件分析显示ACE2蛋白等电点PI=5.36,意味着ACE2蛋白偏酸性。此外,预测结果还显示ACE2蛋白为不稳定蛋白,其预测不稳定指标为40.09。其脂肪系数为80.55,平均亲水性系数-0.375。ACE2蛋白质的亲疏水性通过ProtScale软件分析,结果见图5。其最大的疏水性分值为3.778,亲水性的最大值为-3.311。如图5所示,ACE2蛋白亲水性氨基酸多于疏水性氨基酸,结合其亲水性系数,推测ACE2蛋白为亲水性蛋白。
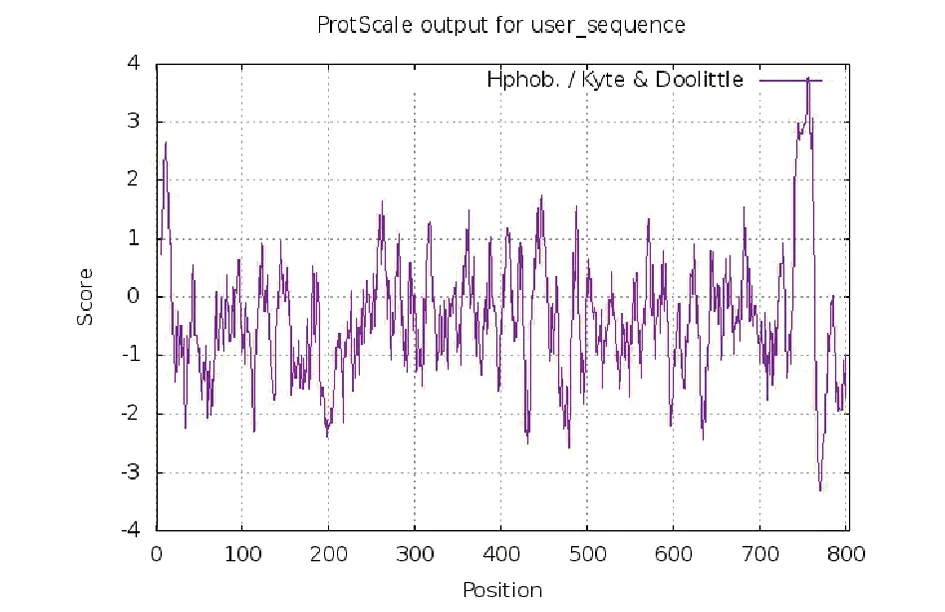
图5 ACE2 蛋白亲疏水性分析Fig.5 Analysis of hydrophilicity and hydrophobicity of ACE2 protein
2.6ACE2蛋白翻译后修饰 蛋白质翻译后修饰使得蛋白具有特定功能,对于真核细胞的生命活动具有重要意义。常见的蛋白质翻译后修饰包括有泛素化、磷酸化、糖基化、甲基化、乙酰化、酯基化等。在此,我们对ACE2蛋白糖基化与磷酸化位点进行分析,结果见图6、7。分析结果显示,ACE2蛋白N-糖基化位点有6个,分别位于第53、90、103、322、432、690位氨基酸(图6)。
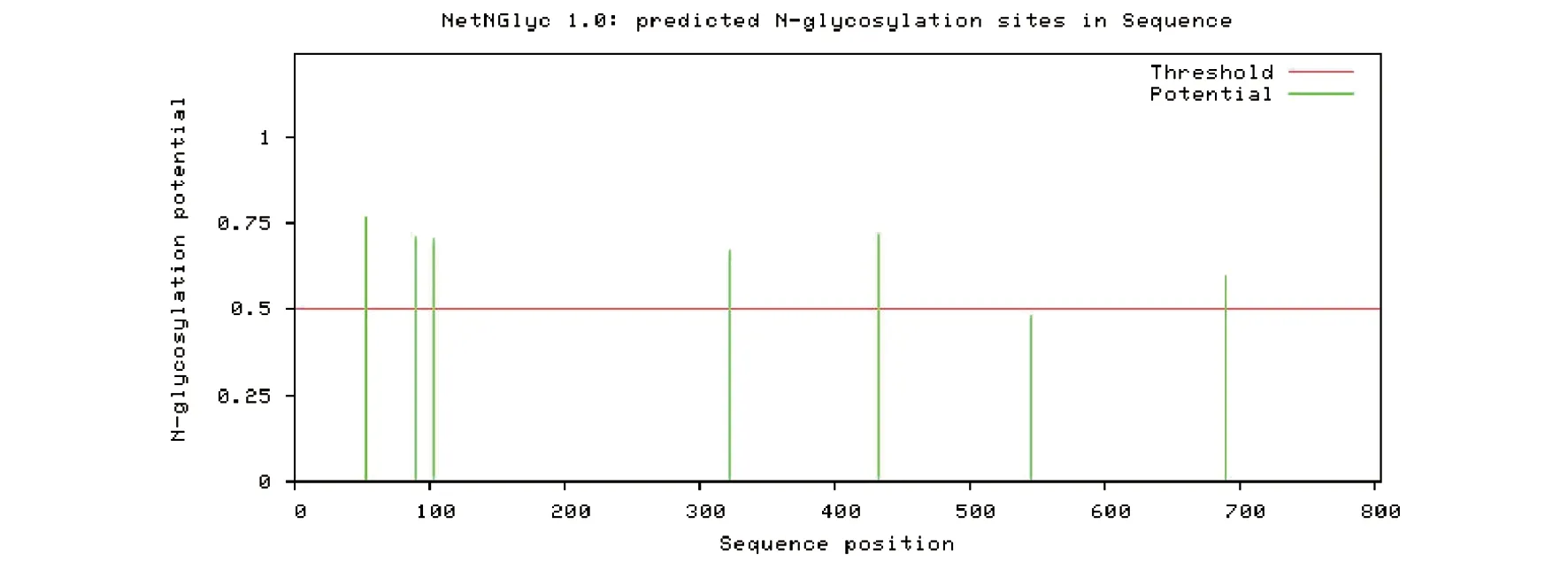
图6 ACE2 蛋白N-糖基化分析Fig.6 ACE2 protein N-glycosylation analysis
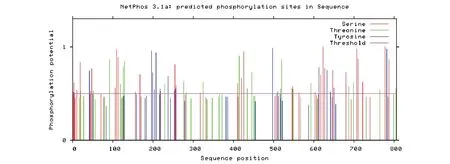
图7 ACE2 蛋白磷酸化的分析Fig.7 Analysis of phosphorylation of ACE2 protein
如图7所示,ACE2蛋白磷酸化位点有77个,分别为第2、3、4、10、19、43、44、47、70、105、106、109、113、128、129、155、167、218、254、257、317、409、420、425、545、547、563、602、617、623、626、646、680、707、709、721、776、787、804位的丝氨酸(serine)位点;第20、52、92、118、125、129、229、276、282、324、414、434、445、496、517、519、548、593、686、698、763、803位的苏氨酸(threonine)位点;以及第41、196、199、202、207、217、237、252、255、497、510、515、613、633、641、649、781位的酪氨酸(tyrosine)位点。
2.7ACE2相互作用网络 利用STRING构建蛋白相互作用网络,发现与ACE2相互作用的蛋白有很多,图8中展示出其中联系密切的30个,分别是 I型血管紧张素受体(Type-1 angiotensin II receptor I, AGTR1);II型血管紧张素受体(Type-2 angiotensin II receptor II, AGTR2);血管紧张素原(Angiotensinogen, AGT);血管紧张素转换酶(Angiotensin-converting enzyme, ACE);肾素(Renin, REN);内皮素1(Endothelin 1, EDN1);内皮素2(Endothelin 2, EDN2);X-脯氨酰氨肽酶2(X-prolyl aminopeptidase 2, XPNPEP2);脯氨酰羧肽酶(ProlylCarboxypeptidase, PRCP);膜金属内肽酶(Membrane metalloendopeptidase, MME);激肽原1(Kininogen 1, KNG1);激肽释放酶B1(Kallikrein B1, KLKB1);谷氨酰胺基肽酶(Glutamyl aminopeptidase, ENPEP);ATPase H+转运辅助蛋白2(ATPase H+ transporting accessory protein 2, ATP6AP2);胰酶1(Chymase 1, CMA1); 阿佩林(Apelin, APLN);凝血因子II(Coagulation factor II, F2);甲基多巴α亚基(Meprin A subunit alpha, MEP1A);甲基多巴β亚基(Meprin A subunit beta, MEP1B);G蛋白亚基alpha q(G protein subunit alpha q, GNAQ);G蛋白耦联受体激酶2(G protein-coupled receptor kinase 2, ADRBK1);G蛋白耦联受体激酶5(G protein-coupled receptor kinase5, GRK5);β抑制蛋白1(Arrestin beta 1, ARRB1);β抑制蛋白2(Arrestin beta 2, ARRB2);胃抑制多肽(Gastric inhibitory polypeptide, GIP);胰高血糖素(Glucagon, GCG);二肽基肽酶4(Dipeptidyl peptidase 4, DPP4);组织蛋白酶G(Cathepsin G, CTSG);表皮生长因子受体(Epidermal growth factor receptor, EGFR);丝裂原激活的蛋白激酶3(Mitogen-activated protein kinase 3, MAPK3)。
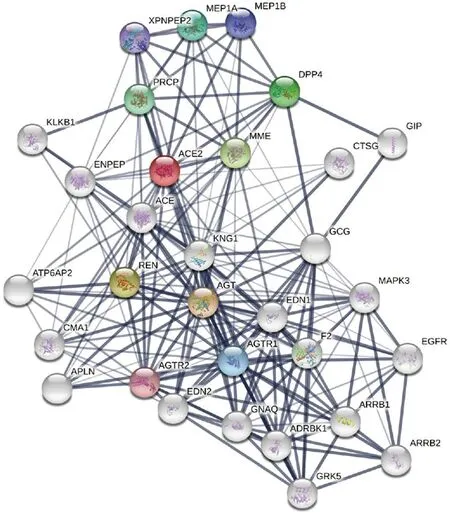
图8 ACE2 蛋白相互作用的预测Fig.8 Prediction of ACE2 protein interaction
2.8ACE2相互作用蛋白功能富集 将STRING的GO和KEGG功能富集结果可视化,如图9所示显著富集到的ACE2相互作用蛋白的生物学过程包括全身动脉血压的激素调节过程(regulation of systemic arterial blood pressure by hormone)、全身动脉血压的调节(regulation of systemic arterial blood pressure)、肾素-血管紧张素对全身动脉血压的调节(regulation of systemic arterial blood pressure by renin-angiotensin)、血液循环(blood circulation)、激素水平调节(regulation of hormone levels)等。显著富集到的ACE2相互作用蛋白主要位于细胞外空间(extracellular space)、细胞质膜(plasma membrane)、囊泡(cytoplasmic vesicle)、胞质囊泡(vesicle)、质膜部分(plasma membrane part)、分泌颗粒(secretory granule)等。显著富集到的ACE2相互作用蛋白的分子功能包括G蛋白耦联受体的结合(G protein-coupled receptor binding)、信号受体结合(signaling receptor binding)、肽链内切酶活性(endopeptidase activity)、肽酶活性(peptidase activity)、催化活性(catalytic activity)、金属肽酶活性(metallopeptidase activity)等。显著富集到的ACE2相互作用蛋白的信号通路包括肾素-血管紧张素系统(Renin-angiotensin system)、蛋白质消化吸收(Protein digestion and absorption)、肾素分泌(Renin secretion)、松弛素信号通路(Relaxin signaling pathway)、趋化因子信号通路(Chemokine signaling pathway)、内吞作用(Endocytosis)、以及心肌细胞的肾上腺素能信号(Adrenergic signaling in cardiomyocytes)等。

图9 ACE2 相互作用蛋白功能富集Fig.9 Function of ACE2 interacting proteins
3 讨 论
目前研究已发现的ACE2蛋白功能主要包括2个方面,其一ACE2被证明是冠状病毒SARS-CoV、SARS-CoV-2、HCoV-NL63(human coronavirus NL63)的受体,是上述3种病毒入侵细胞的必要条件[2,4,11],其二在肾素-血管紧张素系统(Renin-angiotensin system, RAS)中发挥重要作用。本研究通过各种生物信息学软件对ACE2蛋白的详细生物信息学信息进行了分析。结果显示ACE2蛋白为含有信号肽的跨膜蛋白,该蛋白90%以上的结构位于细胞膜外,已有研究表明 SARS-CoV-2 与 ACE2 结合的位置位于胞外段顶端[12],分析结果与其作为细胞外病毒受体的生物学功能相吻合。结构学研究揭示了, SARS-CoV及SARS-CoV-2通过病毒受体结合结构域与ACE2的细胞外催化结构域互动结合,这种互动能够导致细胞内吞、膜融合从而使得SARS-CoV进入宿主细胞[12-13]。而本研究中对ACE2蛋白功能富集分析也发现与ACE2相互作用蛋白主要分布在细胞外、细胞质膜以及囊泡等区域,并且与介导内吞作用的信号通路相关。
对ACE2相互作用蛋白的分析发现,ACE2与多个蛋白发生相互作用,我们在图8中展示了30个。其中有19个蛋白与RAS调节相关,包括ACE、AGT、REN等[14-17];这与ACE2功能富集分析结果吻合,即人ACE2蛋白主要通过参与肾素-血管紧张素系统、肾素分泌、松弛素信号通路、心肌细胞的肾上腺素等信号通路,在全身动脉血压调节、血液循环以及体液调节的生物学过程中发挥作用。其次,相互作用蛋白中有5个与G蛋白耦联受体结合相关,包括GNAQ、GRK5、ADPBK1、ARRB1、ARRB2,而RAS系统调节也被证明与G蛋白耦联受体信号通路相关[18-20]。RAS是机体重要的体液调节系统,血管紧张素转化酶(angiotensin converting enzyme,ACE)作用于 血 管 紧 张 素 I(angiotensin I,Ang I),产生血管紧张素 II (Ang II),进一步激活 G 蛋白耦联受体,从而促血管收缩、促炎、促进细胞凋亡等。ACE2与 ACE属同工酶。ACE2可水解 AngⅡ,产生 Ang(1-7),起到舒张血管、抗心肌肥大、抗炎、抗纤维化、改善心肌重构等保护性作用。正常人体中 ACE2/ACE处于动态平衡,调节机体生理功能[21]。周元琳等[21]研究提到,在SARS-CoV侵染小鼠细胞后,ACE2蛋白水平显著降低,Ang II大量堆积,从而使RAS系统稳态失衡。Imai等[22]发现,在肺组织中,Ang II高表达会增加血管通透性,导致肺水肿肺炎、心肌炎、急性呼吸窘迫综合征等各种疾病。基于SARS-CoV与SARS-CoV-2基因序列、进入细胞的方式及其感染症状的相似性,并且SARS-CoV-2与ACE2结合的亲和力为SARS-CoV的10~20倍[12],推测SARS-CoV-2与大量ACE2结合,使得ACE2蛋白水平急剧减少,进而产生一系列肺部损伤症状。值得注意的是,ACE2蛋白具有丰富的糖基化位点和磷酸化位点,糖基化对其与病毒结合是至关重要的[23],此外与ACE2蛋白相互作用蛋白多为蛋白酶类,推测其可能通过在不同的氨基酸位点发生磷酸化,从而与多种酶蛋白相互作用发挥其生物学功能。
由于ACE2蛋白在介导SARS-CoV-2感染宿主细胞过程中发挥必不可少的作用,并且ACE2蛋白水平的变化对肺部组织损伤有显著影响,ACE2已成为SARS-CoV-2感染的治疗靶点。Liu等人经过研究分析后建议将基于ACE2的肽作为治疗SARS-CoV-2病毒感染的潜在药物靶点[24]。选择性破坏SARS-CoV-2与 ACE2 的结合也是一种选择[25]。并且Wan等[9]的研究发现,SARS-CoV-2可从多种物种(除了大鼠和小鼠)中识别ACE2,他们认为提出可以从受体ACE2入手,研究SARS-CoV-2的中间宿主。因此对于ACE2蛋白作为病毒受体的功能和机制研究是极有价值的。本研究对ACE2蛋白结构和功能进行生物信息学分析,希望能为SARS-CoV-2病毒的攻克提供一些理论基础。
利益冲突:无

