雷公藤红素对卵巢癌细胞增殖、凋亡的影响及作用机制研究
马著妍,吴田田,吴彤,王悦,张蕴莉
(锦州医科大学附属第一医院 检验科,辽宁 锦州 121000)
我国每年约有5.2 万女性被确诊为卵巢癌,约2.2万人死于卵巢癌,并且过去10年卵巢癌发病呈年轻化趋势[1]。卵巢癌具有易增殖、侵袭性高等特点,这也往往是临床治疗失效的原因,因此抑制卵巢癌细胞增殖及侵袭是治疗卵巢癌的要点与难点之一[2-3]。雷公藤红素是从我国传统中药雷公藤中提取的单体,具有良好的安全性。有学者前期研究发现,其抑制肿瘤血管生成、肿瘤增殖及侵袭效果较好[4-7]。同时有报道显示,肿瘤细胞发生凋亡可以有效抑制肿瘤生长[8-9]。 但是,雷公藤红素抑制肿瘤生长是否与细胞凋亡有关鲜有报道。因此,本研究以人卵巢癌细胞株HEYa8作为研究对象,研究雷公藤红素对HEYa8 细胞增殖和凋亡的影响,并探究其分子机制,以期为临床攻克卵巢癌提供新思路。
1 材料与方法
1.1 实验材料及试剂
雷公藤红素购自上海Aladdin 公司,HEYa8 人卵巢癌细胞株购自美国ATCC 公司。培养基DMEM 及胎牛血清FBS 均购自美国Gibco 公司,MTT 试剂购自美国ThermoFisher 公司,IGF-1 购自美国R&D 公司,GSDMS-N 购自美国Santa Cruz Biotechnology 公司,NLRP3、ASC、Caspase-1、IL-18 及CD44 购自美国Abcam 公司,IL-1β、GAPDH、PI3K 及Akt 购自美国Cell Signaling Technology 公司。
1.2 HEYa8 人卵巢癌细胞株培养
将含有12%胎牛血清和1%青链霉双抗的DMEM 培养基培养HEYa8 细胞,置于37℃、5%二氧化碳细胞培养箱培养,根据细胞生长状态换液及传代。
1.3 MTT 法测定雷公藤红素处理的最适浓度及时间
把雷公藤红素浓度分为8 个梯度,分别为0.00、0.05、0.10、0.20、0.40、0.60、1.20 及2.40 mg/L(药物用培养基溶解),并分别作为0.00、0.05、0.10、0.20、0.40、0.60、1.20 及2.40 mg/L 组。同时也把培养时间分为 5 个梯度,分别为0、12、24、48 及72 h。细胞进行 96 孔板铺板,边缘孔用无菌PBS 填充,每组设置6 个重复孔。隔夜培养后第2 天加入梯度药物,随后进行梯度时间培养。每组到时间后加入20μl MTT(5 mg/ml)培 养4 h,终止培养后吸去残液并加入150μl DMSO(37℃震荡10 min)。最后用酶标仪检测490 nm 波长处的吸光度值,得到的数值用Prism 7 软件处理。
1.4 实验分组
本实验分为对照组和雷公藤红素组,对照组为未经任何处理的HEYa8 人卵巢癌细胞,雷公藤红素组根据MTT 结果得到最适处理浓度及时间,应用雷公藤红素处理HEYa8 细胞。在机制实验部分,应用PI3K特异性激动剂(IGF-1)后,分为IGF-1(+)雷(+)组(同时加入IGF-1 和雷公藤红素)、IGF-1(-)雷(+)组(只加入雷公藤红素)和IGF-1(+)雷(-)组(只加入IGF-1)[10]。
1.5 Transwell 法测定细胞迁移、细胞分裂指数及细胞计数
在24 孔板配套的Transwell 小室里接种5×104个/ 孔细胞,用无血清培养基培养,小室以下孔板用血清培养基培养。培养12 h 后,利用0.1%结晶紫染色小室细胞,观察侵袭细胞的数量并拍照计数。细胞培养24 h 后,加入秋水仙素0.1μg/ml 后再培养40 min,随后显微镜下观察1 000 个细胞中分裂期细胞(洋葱状)数量,并用百分比表示。细胞培养24 h 后,用细胞计数仪分别测算两组细胞的数量。
1.6 Western blotting 检测
采用Western blotting 检测凋亡相关蛋白(GSDMS-N、Caspase-1、NLRP3、ASC、IL-1β、IL-18)和PI3K/Akt 信号通路关键节点蛋白(PI3K、Akt、p-PI3K、p-Akt)相对表达量。用预冷PBS 洗净细胞,再用RIPA+PMSF 裂解细胞并提取蛋白,之后进行制胶电泳及转模。孵育一抗过夜,GSDMS-N(1∶500),NLRP3、ASC、Caspase-1 及IL-18(1∶800),IL-1β、GAPDH、PI3K、Akt、p-PI3K 及p-Akt(1∶1 000),之后用TBST 洗净,再孵育相应二抗2 h,随后拍照。所得条带用Image J 软件分析,用Prism 7 软件处理数据。
1.7 免疫荧光双标检测
细胞先用PBS 洗净,随后用4%多聚甲醛溶液固定,再用3% Triton 孵育10 min,GSDMS-N(1∶1 000)过夜,第2 天用相应荧光二抗孵育后再用CD44(1∶1 000)孵育,用相应二抗孵育室温2 h,孵育10 min 的DAPI(1∶1 000)。最后用PBS 清洗,再用荧光显微镜拍照,数据用Image J 及Prism 7 软件分析处理。
1.8 qRT-PCR
采用Trizol 法提取细胞总RNA,逆转录,依据RevertAid RT Reverse Transcription Kit(美国Thermo Fisher 公司)试剂盒说明书将定量1μg 逆转录为cDNA,随后qRT-PCR 检测每组细胞内NLRP3、ASC、IL-1β 及Caspase 1 的表达量。NLRP3 正向引物: 5'-GATCTTCGCTGCGATCAACAG-3'(21 bp),反向引物: 5'-CGTGCATTATCTGAACCCCAC-3'(21 bp), IL-1β 正向引物: 5'-CCTTGTGCAAGTGTCTGA AGC-3'(21 bp),反向引物: 5'-CCCAAGTCAAGGGCT TGGAA-3'(21 bp),ASC 正向引物: 5'-GACGGGGCCA ATACCACAC-3'(18 bp),反向引物: 5'-TCTGTAAC AAAAGTCGTGCTTCT-3'(23 bp),Caspase 1 正向引物: 5'-TGGGTGCAGGCACAATAAATG-3'(21 bp),反向引物: 5'-TTGAGGCAAGTTGAGGGTCTT-3'(21 bp),GAPDH 正向引物: 5'-TGTGGGCATC AATGGATTTGG-3'(21 bp),反向引物: 5'-ACACCA TGTATTCCGGGTCAAT-3'(22 bp)。qRT-PCR 反 应条件: 95℃预变性5 min,95℃变性30 s,37℃退火60 s,72℃延伸120 s,共计40 个循环。荧光半定量分析过程: 依次加入cDNA、引物及Q-PCR Mix,最后进行荧光半定量分析。数据采用Prism 7 软件处理。
1.9 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析或重复测量设计的方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度及培养时间雷公藤红素对HEYa8细胞生存率的影响
不同浓度雷公藤红素作用12、24、36、48 和72 h 的HEYa8 细胞生存率比较,经重复测量设计的方差分析,结果如下: ①不同时间点的细胞生存率比较,差异有统计学意义(F=135.130,P=0.000); ②不同浓度组的细胞生存率比较,差异有统计学意义(F=74.860,P=0.000);③不同浓度组的细胞生存率变化趋势比较,差异有统计学意义(F=2.604,P=0.043)。最终选择0.4 mg/L 浓度雷公藤红素处理24 h 来进行本实验。见表1和图1。

表1 不同浓度组各时间点细胞生存率比较 %
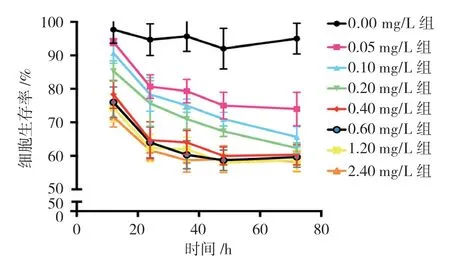
图1 不同浓度组的细胞生存率变化趋势 (±s)
2.2 雷公藤红素对HEYa8 细胞侵袭性及增殖性的影响
雷公藤红素组与对照组侵袭细胞、细胞分裂指数及细胞数量比较,差异有统计学意义(P<0.05),雷公藤红素组侵袭细胞、细胞总的数量较对照组少,而细胞分裂指数低于对照组。见表2和图2、3。
2.3 雷公藤红素对HEYa8 细胞凋亡的影响
雷公藤红素组与对照组凋亡相关蛋白相对表达量比较,差异有统计学意义(P<0.05),雷公藤红素组较对照组高(见表3和图4~6)。雷公藤红素组与对照组CD44/GSDMS-N 双阳性细胞占总细胞百分比分别为(38.33±6.0)%和(61.67±4.4)%,经t检验,差异有统计学意义(t=3.351,P=0.033),雷公藤红素组较对照组低。
表2 雷公藤红素组与对照组侵袭细胞、细胞分裂指数及细胞数量比较 (±s)

表2 雷公藤红素组与对照组侵袭细胞、细胞分裂指数及细胞数量比较 (±s)
组别 侵袭细胞/个 细胞分裂指数/% 细胞数量/个雷公藤红素组 97.70±9.28 27.33±4.48 523.3±233.3对照组 178.30±11.67 52.00±6.65 826.7±328.3 t 值 5.143 3.073 7.534 P 值 0.007 0.037 0.002

图2 雷公藤红素组与对照组侵袭细胞比较

图3 雷公藤红素组与对照组细胞分裂指数比较
表3 雷公藤红素组与对照组凋亡相关蛋白相对表达量比较 (±s)

表3 雷公藤红素组与对照组凋亡相关蛋白相对表达量比较 (±s)
组别 GSDMS-N Caspase 1 NLRP3 ASC IL-1β IL-18雷公藤红素组 0.90±0.03 0.94±0.04 0.88±0.04 0.91±0.04 1.03±0.09 0.95±0.07对照组 0.70±0.06 0.72±0.07 0.52±0.04 0.75±0.03 0.82±0.06 0.78±0.07 t 值 3.102 2.9137 3.875 3.302 2.607 2.573 P 值 0.043 0.038 0.021 0.029 0.041 0.030
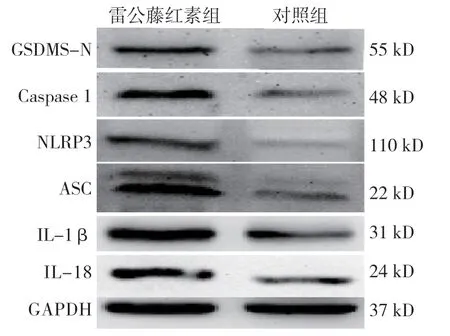
图4 雷公藤红素组与对照组凋亡相关蛋白的表达
2.4 雷公藤红素对PI3K/Akt 信号通路的影响
雷公藤红素组与对照组PI3K/Akt 信号通路关键分子的蛋白相对表达量比较,差异有统计学意义(P<0.05),雷公藤红素组较对照组低。见表4和 图7、8。
2.5 各组NLRP3、IL-1β、ASC 和Caspase 1 mRNA 及蛋白相对表达量的变化
各组NLRP3、IL-1β、ASC 和Caspase 1 mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05),IGF-1(+)雷公藤红素(+)组与IGF-1(-)雷公藤红素(+)组NLRP3、IL-1β、ASC 和Caspase 1 mRNA 相对表达量比较,差异有统计学意义(P<0.05)。各组凋亡关键因子NLRP3、IL-1β、ASC 和Caspase 1 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),IGF-1(+)雷公藤红素(+)组与IGF-1(-)雷公藤红素(+)组NLRP3、IL-1β、ASC 和Caspase 1 蛋白相对表达量比较,差异有统计学意义(P<0.05)。见表5、6 和 图9~11。
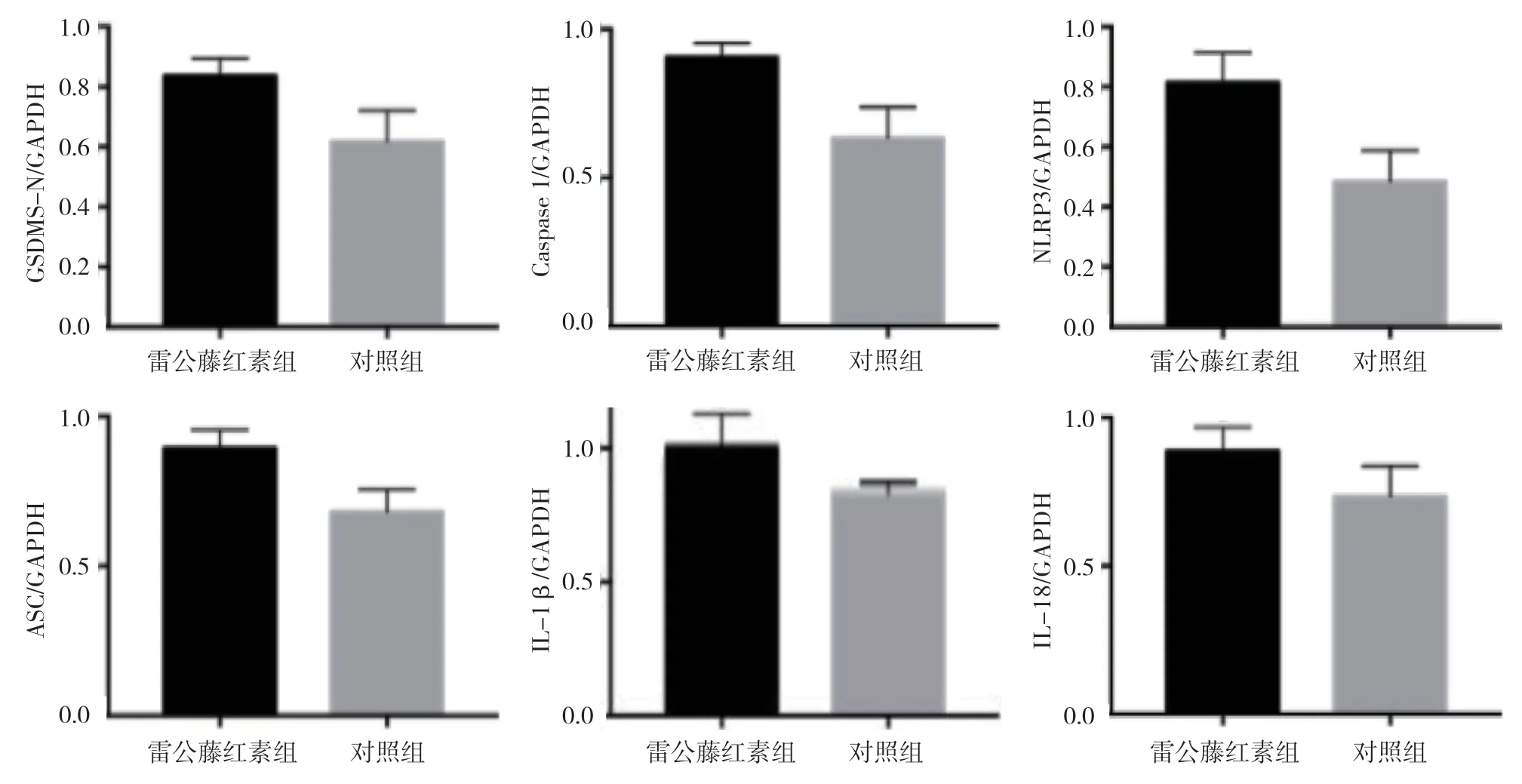
图5 雷公藤红素组与对照组凋亡蛋白相对表达量比较 (±s)

图6 雷公藤红素组与对照组免疫荧光双标检测
表4 雷公藤红素组与对照组PI3K/Akt 信号通路关键分子的蛋白相对表达量比较 (±s)
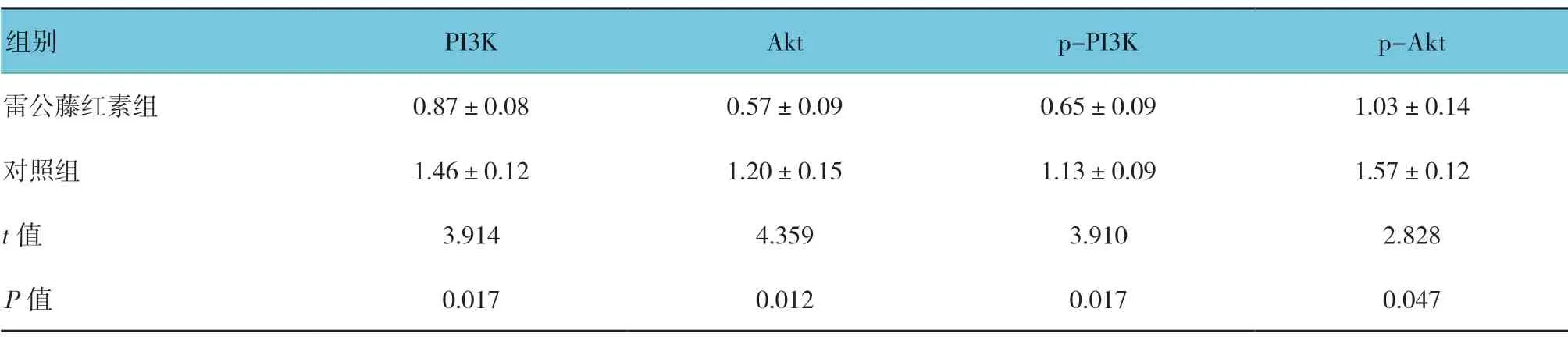
表4 雷公藤红素组与对照组PI3K/Akt 信号通路关键分子的蛋白相对表达量比较 (±s)
组别 PI3K Akt p-PI3K p-Akt雷公藤红素组 0.87±0.08 0.57±0.09 0.65±0.09 1.03±0.14对照组 1.46±0.12 1.20±0.15 1.13±0.09 1.57±0.12 t 值 3.914 4.359 3.910 2.828 P 值 0.017 0.012 0.017 0.047

图7 雷公藤红素组与对照组PI3K/Akt 信号通路关键分子的蛋白相对表达量的变化 (±s)

图8 雷公藤红素组与对照组PI3K/Akt 信号通路关键分子蛋白的表达
表5 各组NLRP3、IL-1β、ASC 和Caspase 1 mRNA相对表达量比较 (±s)

表5 各组NLRP3、IL-1β、ASC 和Caspase 1 mRNA相对表达量比较 (±s)
组别 NLRP3 mRNA IL-1β mRNA ASC mRNA Caspase1 mRNA IGF-1(+)雷(+)组 1.12±0.04 1.12±0.07 1.25±0.19 1.38±0.08 IGF-1(-)雷(+)组 1.60±0.20 1.21±0.08 1.60±0.15 1.80±0.21 IGF-1(+)雷(-)组 0.85±0.03 0.97±0.07 1.00±0.16 0.90±0.08 F 值 9.133 4.100 4.197 12.22 P 值 0.006 0.049 0.047 0.002
表6 各组NLRP3、IL-1β、ASC 和Caspase 1 蛋白相对表达量比较 (±s)

表6 各组NLRP3、IL-1β、ASC 和Caspase 1 蛋白相对表达量比较 (±s)
组别 NLRP3 蛋白 IL-1β 蛋白 ASC 蛋白 Caspase1 蛋白IGF-1(+)雷(+)组 1.02±0.11 1.14±0.04 1.25±0.19 0.88±0.23 IGF-1(-)雷(+)组 2.10±0.46 1.77±0.26 1.60±0.15 1.60±0.25 IGF-1(+)雷(-)组 0.98±0.14 1.20±0.18 1.23±0.15 0.83±0.08 F 值 11.283 4.672 5.349 7.914 P 值 0.004 0.04 0.038 0.019
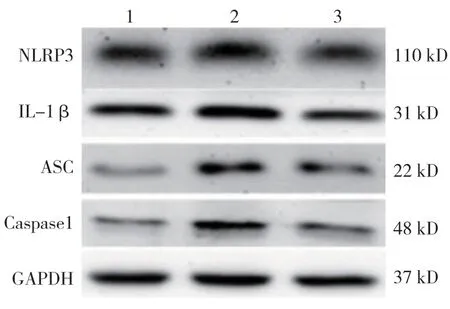
图9 各组蛋白的表达

图10 各组NLRP3、IL-1β、ASC 和Caspase 1 mRNA 相对表达量的变化 (±s)
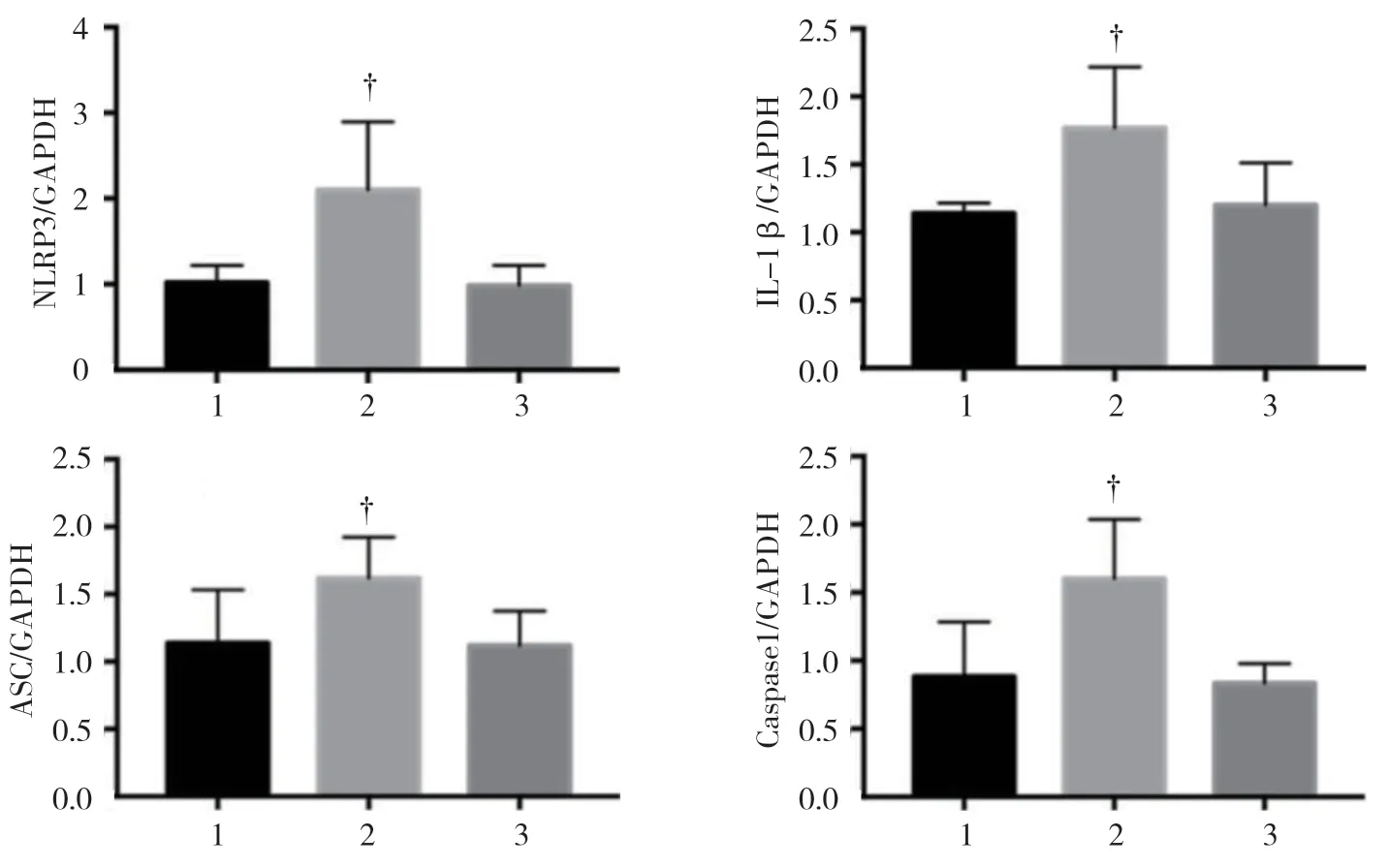
图11 各组NLRP3、IL-1β、ASC 和Caspase 1 蛋白相对表达量的变化 (±s)
3 讨论
卵巢癌因其恶性程度高、侵袭性强等特点,并且一般临床发现已到中晚期,留给患者的选择几乎只有手术与化疗[1-2]。雷公藤红素是具有多种生物活性的天然产物,来源于传统中药雷公藤的根皮,应用历史甚久,毒副作用较弱,目前主要应用在抗癌的抑制肿瘤血管新生方面[3]。虽然何冰玉等[6]和张亚南等[7]前期研究发现,雷公藤红素具有良好的抑制卵巢癌生长的作用,然而抗癌的分子机制还不甚明了。
细胞凋亡是一种新型程序性细胞死亡方式[11]。有研究表示,提高肿瘤细胞凋亡水平可以有效抑制肿瘤生长与增殖,肿瘤细胞凋亡可能是抑制肿瘤细胞生长增殖的新方向[12]。有学者研究发现,提高卵巢癌细胞的凋亡水平可有效抑制肿瘤细胞的侵袭、生长与分裂,这可能与细胞凋亡后α-NETA 杀伤活性被激活等因素有关[13]。笔者研究发现,用雷公藤红素最适合治疗浓度作用HEYa8 细胞,可以降低细胞侵袭性,减少细胞分裂指数并减少总的细胞数量,这与前期研究结果基本吻合,证明了雷公藤红素确实有抑制卵巢癌细胞生长的作用。随后发现,在雷公藤红素作用下细胞凋亡关键因子Caspase 1 水平升高,这可能与雷公藤红素诱导HEYa8 细胞凋亡有关。因为细胞凋亡是一种依赖于Caspase 1 的细胞死亡,Caspase 1 在凋亡中扮演重要角色[14]。其中前体Caspase 1 需要通过NLRP3 小体(包括NLRP3 及ASC 等分子)的切割才能转化为具有活性的Caspase 1,并且Caspase 1 的作用主要是在于活化IL-1β 和IL-18,从而激活细胞自身的炎症反应[15]。然而,IL-1β 和IL-18 等炎症因子还受到GSDMD 的控制,GSDMD 活化成为GSDMD-N后,可以在细胞膜上形成孔道,使细胞内炎症内容物外放[16]。炎症内容物外放后可以导致肿瘤细胞的增殖被抑制,甚至死亡,这也是很多研究报道的细胞凋亡与肿瘤被抑制的机制[12-13]。同样的,笔者发现雷公藤红素可以较好地提升凋亡相关蛋白的水平,也提高了GSDMD-N 阳性细胞的比例,这些都说明雷公藤红素可以提高肿瘤细胞凋亡水平。有研究报道,细胞凋亡的发生可能与经典的PI3K/Akt 信号通路相关,即抑制此信号通路可以有效提高细胞凋亡水平[17-19]。笔者发现雷公藤红素在HEYa8 细胞中可以抑制此信号通路,并且用PI3K 特异性激活剂(IGF-1)激活此通路后,雷公藤红素的促细胞凋亡作用消失,这提示雷公藤红素诱导细胞凋亡可能抑制了PI3K/Akt 信号通路。
综上所述,雷公藤红素具有较好的HEYa8 细胞抑制作用,引起此现象是因为雷公藤红素激活了肿瘤细胞的凋亡,这个过程可能与其抑制PI3K/Akt 信号通路高度相关。然而,本实验的分子机制研究依旧有限,缺乏深层次的在体研究等,还需要进一步实验探索。

