不同剂量司库奇尤单抗治疗中、重度强直性脊柱炎疗效与安全性的Meta分析
蒲晓峰 刘亮 冯碧敏 何成松 王国俊


摘 要 目的:系统评价不同剂量司库奇尤单抗治疗中、重度强直性脊柱炎(AS)的疗效与安全性,为临床治疗AS提供循证参考。方法:计算机检索Medline、PubMed、Cochrane图书馆、Embase、中文科技期刊数据库、中国期刊全文数据库、万方数据库以及ClinicalTrials.gov,检索时限为各数据库建库起至2020年3月。收集不同剂量(75、150、300 mg)司库奇尤单抗(试验组)对比安慰剂(对照组)治疗中、重度AS的随机对照试验(RCT)。对符合纳入标准的临床研究进行资料提取,并采用Cochrane风险偏倚评估工具5.1.0进行质量评价后,采用Rev Man 5.3 统计软件对司库奇尤单抗治疗AS的疗效[在国际社會脊椎关节炎评估标准量表中改善了20%的患者所占比例(ASAS20);ASAS40;与AS相关的6个常规临床领域中,至少5个领域的评分改善≥20%、其余领域没有恶化的患者所占比例(ASAS5/6);从基线到16周时的Bath强直性脊柱炎疾病活动指数(BASDAI)缓解值;规定时间内在4个ASAS领域中国际社会脊椎关节炎评估标准量表得分≤2分的患者所占比例(ASAS PR)]与安全性[因不良反应撤出治疗发生率、严重不良反应发生率、一般不良反应(鼻咽炎、头痛、腹泻)发生率]进行Meta分析。结果:共纳入5项RCT,合计1 624例患者。Meta分析结果显示,试验组患者ASAS20[总体:OR=2.62,95%CI(2.14,3.20),P<0.000 01;75 mg:OR=2.63,95%CI(1.28,5.40),P=0.008;150 mg:OR=2.58,95%CI(2.01,3.32),P<0.000 01;300 mg:OR=2.63,95%CI(1.37,5.06),P=0.004]、ASAS40[总体:OR=2.82,95%CI(2.13,3.74),P<0.000 01;75 mg:OR=3.14,95%CI(1.86,5.31),P<0.000 1;150 mg:OR=2.79,95%CI(1.85,4.20),P<0.000 01;300 mg:OR=2.73,95%CI(1.33,5.58),P=0.006]、ASAS5/6[总体:OR=3.82,95%CI(2.61,5.59),P<0.000 01;75 mg:OR=5.59,95%CI(3.29,9.49),P<0.000 01;150 mg:OR=3.45,95%CI(2.08,5.70),P<0.000 01;300 mg:OR=3.85,95%CI(1.75,8.47),P=0.000 8]、ASAS PR[总体:OR=4.69,95%CI(3.07,7.16),P<0.000 01;75 mg:OR=5.48,95%CI(2.50,11.99),P<0.000 1;150 mg:OR=3.71,95%CI(2.19,6.29),P<0.000 01;300 mg:OR=20.0,95%CI(2.58,155.14),P=0.004]均显著高于对照组,BASDAI缓解值[总体:WMD=-1.15,95%CI(-1.50,-0.79),P<0.000 01;75 mg:WMD=-1.40,95%CI(-2.08,-0.72),P<0.000 1;150 mg:WMD=-1.03,95%CI(-1.52,-0.54),P<0.000 1;300 mg:WMD=-1.20,95%CI(-2.03,-0.37),P=0.005]显著大于对照组,差异均有统计学意义。试验组患者总体[OR=1.77,95%CI(1.22,2.57),P=0.003]以及150 mg剂量亚组[OR=1.84,95%CI(1.18,2.86),P=0.007]的鼻咽炎发生率显著高于对照组,其他安全性指标总体及各剂量下比较差异均无统计学意义(P>0.05)。结论:75、150、300 mg的司库奇尤单抗治疗中、重度AS的疗效和安全性均较好,但150 mg可能会增加鼻咽炎的发生率。
关键词 司库奇尤单抗;中、重度强直性脊柱炎;疗效;安全性;Meta分析
ABSTRACT OBJECTIVE: To evaluate therapeutic efficacy and safety of different doses of Secukinumab in the treatment of medium and severe ankylosing spondylitis (AS), and to provide evidence-based reference for clinical treatment of AS. METHODS: Retrieved from Medline, PubMed, Cochrane Library, Embase, VIP, CJFD, Wanfang database and ClinicalTrials.gov, during the inception to March 2020, randomized controlled trials (RCTs) about different doses of secukinumab (75, 150, 300 mg) versus placebo in the treatment of medium and severe AS were collected. After data extraction of clinical studies met the inclusion criteria, quality evaluation with Cochrane risk bias evaluation tool 5.1.0, Rev Man 5.3 statistical software was used for Meta-analysis of therapeutic efficacy [in the international society for the evaluation of spondyloarthritis scale, the proportion of 20% patients improved (ASAS20);ASAS40;among 6 routine clinical areas related to AS, the scores of at least 5 areas improved by at least 20%, and there was no patients receiving treatment due to deterioration in other areas (ASAS 5/6); remission value of Bath ankylosing spondylitis disease activity index (BASDAI) from baseline to 16th week, the proportion of the patients with the international society for the evaluation of ankylosing spondyloarthritis (ASAS PR) score no higher than 2 in the 4 ASAS fields within the specified time] and safety [the incidence of withdrawal from treatment due to ADR, the incidence of serious ADR, the incidence of general ADR (nasopharyngitis, headache, diarrhea)]. RESULTS: A total of 5 RCTs were included, involving 1 624 patients. Meta-analysis showed that ASAS20 [total: OR=2.62, 95%CI (2.14, 3.20), P<0.000 01; 75 mg: OR=2.63, 95%CI (1.28, 5.40), P=0.008; 150 mg: OR=2.58, 95%CI (2.01, 3.32), P<0.000 01; 300 mg: OR=2.63, 95%CI (1.37, 5.06), P=0.004], ASAS40 [total: OR=2.82, 95%CI (2.13, 3.74), P<0.000 01; 75 mg: OR=3.14, 95%CI (1.86, 5.31), P<0.000 1; 150 mg: OR=2.79, 95%CI (1.85, 4.20), P<0.000 01; 300 mg: OR=2.73, 95%CI (1.33, 5.58), P=0.006], ASAS5/6 [total: OR=3.82, 95%CI (2.61, 5.59), P<0.000 01; 75 mg: OR=5.59, 95%CI (3.29, 9.49), P<0.000 01; 150 mg: OR=3.45, 95%CI (2.08, 5.70), P<0.000 01; 300 mg: OR=3.85, 95%CI (1.75, 8.47), P=0.000 8], ASAS PR [total: OR=4.69, 95%CI (3.07, 7.16), P<0.000 01; 75 mg: OR=5.48, 95%CI (2.50, 11.99), P<0.000 1; 150 mg: OR=3.71, 95%CI (2.19, 6.29), P<0.000 01; 300 mg: OR=20.0, 95%CI (2.58, 155.14), P=0.004] in trial group was significantly higher than control group; BASDAI improvement [total: WMD=-1.15, 95%CI (-1.50, -0.79), P<0.000 01; 75 mg: WMD=-1.40, 95%CI (-2.08, -0.72), P<0.000 1; 150 mg: WMD=-1.03, 95%CI (-1.52, -0.54), P< 0.000 1; 300 mg: WMD=-1.20, 95%CI (-2.03, -0.37), P=0.005] of trial group were significantly higher than those of control group, with statistical significance. The total incidence of nasopharyngitis in trial group [OR=1.77, 95%CI (1.22,2.57), P=0.003] and 150 mg dose subgroup [OR=1.84, 95%CI(1.18, 2.86), P=0.007] was significantly higher than control group, without significant difference in other safety indexes among total and different dose subgroups (P>0.05). CONCLUSIONS: 75 mg, 150 mg and 300 mg of secukinumab are all effective and well tolerated for medium and severe AS patients, and 150 mg of secukinumab may increase the incidence of nasopharyngitis.
KEYWORDS Secukinumab; Medium and severe ankylosing spondylitis; Therapeutic efficacy; Safety; Meta-analysis
强直性脊柱炎(Ankylosing spondylitis,AS)是一種慢性炎症性疾病,主要表现为中轴骨骼和骶髂关节的病变,同时也可影响周围关节与关节外器官系统[1-2]。中、重度AS相关的炎症性背痛和僵硬会导致机体功能性损害和患者生活质量降低[3]。前期流行病学调查资料显示,AS在我国的发病率约为0.3%[4]。AS对患者造成了巨大的心理负担,也导致社会劳动能力的丧失,已成为较严重的公共卫生问题,迫切需要有效且安全的治疗措施来改善患者的健康相关生活质量[5]。根据国际脊椎关节炎协会和欧洲抗风湿联盟的推荐,非甾体类抗炎药(NSAIDs)和疾病修饰类抗风湿药(DMARDs)通常作为传统的一线治疗药物[6]。但是这些传统药物常被报道不能有效改善AS相关症状[7-8]。有研究显示,肿瘤坏死因子α抑制剂(TNFi)和白细胞介素17A(IL-17A)抑制剂等生物制剂能够有效改善AS相关症状,现已被国际脊椎关节炎协会和欧洲抗风湿联盟推荐用于AS的治疗[6-7]。然而,许多患者对TNFi治疗反应不充分或耐受不良,停药后病情易复发,使得该药存在较严重的安全性问题[9-10]。因此,IL-17A抑制剂成为了当前治疗AS患者非常重要的药物之一。司库奇尤单抗(Secukinumab,研究代码:AIN475,商品名:可善挺、Cosentyx,曾译名:苏金单抗)是一种具有高亲和力、全人源的选择性结合并中和IL-17A 的免疫球蛋白(Ig)G1k单克隆抗体,对AS有效且具有良好的耐受性,可作为TNFi治疗的替代药物[11]。司库奇尤单抗在2015年1月被美国FDA批准用于治疗斑块型银屑病,并在2016年1月更新标签用于治疗AS,其推荐剂量方案为150 mg,每4周1次,或300 mg,每4周1次[12]。该药已经在2019年3月被我国药品监督管理局批准用于治疗斑块性银屑病,但尚未获批用于AS的治疗;且笔者在检索文献时发现,也有较多研究使用了75 mg剂量的司库奇尤单抗治疗AS,同时尚未见不同剂量司库奇尤单抗治疗AS的Meta分析。因此,笔者在本研究中采用Meta分析的方法,系统评价不同剂量司库奇尤单抗治疗中、重度AS的疗效与安全性,以期为临床上AS患者的治疗提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外数据库收录的司库奇尤单抗治疗AS的随机对照试验(RCT),语种限定为中文和英文。
1.1.2 研究对象 符合1984年修订后的纽约AS诊断标准,在临床上诊断为中度到重度的AS,并记录有影像学证据(X射线)的患者。患者年龄大于18岁,性别和种族不限,治疗前期使用过NSAIDs但疗效不佳。
1.1.3 干预措施 试验组患者给予不同剂量(75、150、300 mg)司库奇尤单抗;对照组患者给予安慰剂。
1.1.4 结局指标 ①在国际社会脊椎关节炎评估标准量表中改善了20%的患者所占比例(ASAS20);②ASAS40;③与AS相关的6个常规临床领域中,至少5个领域的评分改善≥20%、其余领域没有恶化的患者所占比例(ASAS5/6);④从基线到16周时的Bath强直性脊柱炎疾病活动指数(BASDAI)缓解值,分值减少越多(即缓解值越大)则说明症状改善越明显;⑤规定时间内在4个ASAS领域中国际社会脊椎关节炎评估标准量表(评分为0~10分,分值越高则表明病情越重)得分≤2分的患者所占比例(ASAS PR);⑥因不良反应撤出治疗的发生率;⑦严重不良反应发生率;⑧一般不良反应(鼻咽炎、头痛、腹泻)发生率。其中,①~⑤为疗效指标,⑥~⑧为安全性治疗;①为主要结局指标,②~⑧为次要结局指标。
1.1.5 排除标准 排除病例对照、队列研究、动物实验以及重复发表的研究;排除含有胸部X光检查有感染或恶性进展、曾接触过除TNFi外的任何生物免疫调节剂的患者的研究。
1.2 检索策略
计算机检索Medline、PubMed、Cochrane 图书馆、Embase、中文科技期刊数据库、中国期刊全文数据库、万方数据库。同时查阅ClinicalTrials.gov以获取尚未发表的试验数据。检索时限均为各数据库建库起至2020年3月。采用主题词和自由词的搭配进行检索。中文检索词包括“苏金单抗”“司库奇尤单抗”“可善挺”“强直性脊柱炎”“随机对照试验”;英文检索词包括“Secukinumab”“AIN475”“Cosentyx”“Ankylosing spondylarthritis”“AS”“Spondyloarthritis”“Ankylopoietica”“Randomized controlled trial”“RCT”。
1.3 资料提取和质量评价
数据由两位研究者独立提取,提取信息包括以下条目:第一作者及发表年限、患者基本特征信息、样本量、干预措施、治疗周期以及结局指标。从原始文献中进行提取资料,提取后由两位研究者交叉核对,不一致时讨论解决。
采用Cochrane风险偏倚评估工具5.1.0对纳入的研究进行风险偏倚评估[13],评估项目包括随机序列的产生,分配隐藏,对患者、试验人员实施盲法,对结局评估者实施盲法,结果数据不完整,选择性报告,其他偏倚来源。若纳入文献完全符合上述条目要求时评为A,提示文献的偏倚风险最低;部分满足上述要求时评为B,提示其存在轻中度的偏倚风险;全部都不符合要求时评为C,表示其存在最高的偏倚风险。评估由两位研究者独立进行,不一致时讨论解决,若讨论仍然不能解决分歧则加入第三位研究者进行判断。
1.4 统计学方法
采用Rev Man 5.3 统计软件对数据进行Meta分析。连续性变量的结局采用加权均数差(WMD)及其95%置信区间(CI) 作为效应评估指标,二分类变量的结局使用比值比(OR)及其95%CI作为效应评估指标。使用χ2检验对纳入的研究进行异质性检验,若P<0.1,I 2>50%,则表示有各研究間存在统计学异质性,采用随机效应模型合并效应量进行分析,同时分析异质性来源;反之,则提示各研究间无统计学异质性,采用固定效应模型合并效应量进行分析。根据司库奇尤单抗剂量的不同进行亚组分析。
2 结果
2.1 纳入研究基本信息
共获取到356篇文献,经去掉重复文献、阅读题目与摘要后排除、阅读全文排除后,最终纳入5篇(项)RCT[14-18],合计1 624例患者。文献筛选流程及结果见图1,纳入研究基本信息见表1。
2.2 方法学质量评价结果
3项研究[15-17]提到随机序列具体生成方式,2项[14,18]仅提及随机但未描述具体方法。对于分配隐藏,5项研究[14-18]中均未具体描述,故无法判断其风险。因纳入的文献均为“四盲”(对参与者、护理提供者、研究者、结果评估者均施盲),故纳入研究在盲法这方面的风险较低。4项研究[14-17]对结局资料完整性做了详细描述和解释,且无选择性发表。纳入研究的方法学质量评价结果见图2。
2.3 Meta分析结果
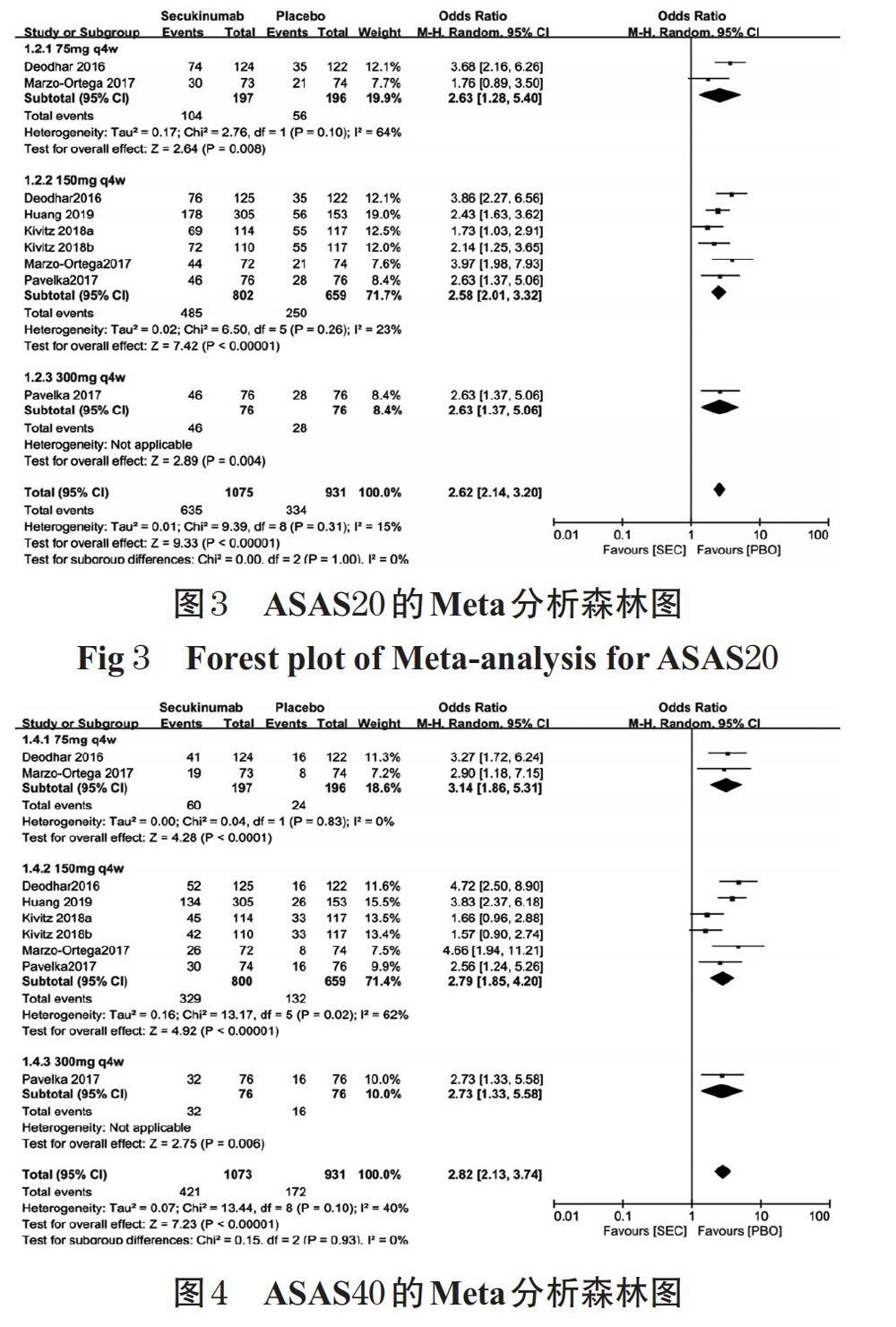
2.3.1 ASAS20 5项研究[14-18](1 624例患者)均报道了ASAS20。各研究间无统计学异质性(P=0.31,I 2=15%),采用固定效应模型合并效应量进行Meta分析,结果见图3。Meta分析结果显示,试验组患者ASAS20显著高于对照组,差异有统计学意义[OR=2.62,95%CI(2.14,3.20),P<0.000 01]。根据司库奇尤单抗的剂量进行亚组分析,结果显示,75 mg[OR=2.63,95%CI(1.28,5.40),P=0.008]、150 mg[OR=2.58,95%CI(2.01,3.32),P<0.000 01]和300 mg[OR=2.63,95%CI(1.37,5.06),P=0.004]的剂量下,试验组患者ASAS20均显著高于对照组,差异均有统计学意义。
2.3.2 ASAS40 5项研究[14-18](1 624例患者)均报道了ASAS40。各研究间无统计学异质性(P=0.10,I 2=40%),采用固定效应模型合并效应量进行Meta分析,结果见图4。Meta分析结果显示,试验组患者ASAS40显著高于对照组,差异有统计学意义[OR=2.82,95%CI(2.13,3.74),P<0.000 01]。根据司库奇尤单抗的剂量进行亚组分析,结果显示,75 mg[OR=3.14,95%CI(1.86,5.31),P<0.000 1]、150 mg[OR=2.79,95%CI(1.85,4.20),P<0.000 01]和300 mg[OR=2.73,95%CI(1.33,5.58),P=0.006]的剂量下,试验组患者ASAS40均显著高于对照组,差异均有统计学意义。
2.3.3 ASAS5/6 5项研究[14-18](1 624例患者)均报道了ASAS5/6。各研究间有统计学异质性(P=0.003,I 2=66%),采用随机效应模型合并效应量进行Meta分析,结果见图5。Meta分析结果显示,试验组患者ASAS5/6显著高于对照组,差异有统计学意义[OR=3.82,95%CI(2.61,5.59),P<0.000 01]。根据司库奇尤单抗的剂量进行亚组分析,结果显示,75 mg[OR=5.59,95%CI(3.29,9.49),P<0.000 01]、150 mg[OR=3.45,95%CI(2.08,5.70),P<0.000 01]和300 mg[OR=3.85,95%CI(1.75,8.47),P=0.000 8]的剂量下,试验组患者ASAS5/6 均显著高于对照组,差异均有统计学意义。由亚组分析结果可知,异质性主要来源于150 mg剂量组(I 2=74%),剔除研究[17]后,异质性降为43%,但合并的效应值改变不大。
2.3.4 BASDAI缓解值 4项研究[14-17](1 166例患者)报道了BASDAI缓解值。各研究间有统计学异质性(P=0.01,I 2=61%),采用随机效应模型合并效应量进行Meta分析,结果见图6。Meta分析结果显示,试验组患者BASDAI缓解值显著大于对照组,差异有统计学意义[WMD=-1.15,95%CI(-1.50,-0.79),P<0.000 01]。根据司库奇尤单抗的剂量进行亚组分析,结果显示, 75 mg[WMD=-1.40,95%CI(-2.08,-0.72),P<0.000 1]、150 mg[WMD=-1.03,95%CI(-1.52,-0.54),P<0.000 1]和300 mg[WMD=-1.20,95%CI(-2.03, -0.37),P=0.005]的剂量下,试验组患者BASDAI缓解值均显著大于对照组,差异均有统计学意义。由亚组分析结果可知,剂量可能不是异质性的主要来源。
2.3.5 ASAS PR 4项研究[14-16,18](1 274例患者)报道了ASAS PR。各研究间无统计学异质性(P=0.64,I 2=0),采用固定效应模型合并效应量进行Meta分析,结果见图7。Meta分析结果显示,试验组患者ASAS PR 显著高于对照组,差异有统计学意义[OR=4.69,95%CI(3.07,7.16),P<0.000 01]。根据司库奇尤单抗的剂量进行亚组分析,结果显示,75 mg[OR=5.48,95%CI(2.50,11.99),P<0.000 1]、150 mg[OR=3.71,95%CI(2.19,6.29),P<0.000 01]和300 mg[OR=20.0,95%CI(2.58,155.14),P=0.004]的剂量下,试验组患者ASAS PR 均显著高于对照组,差异均有统计学意义。
2.3.6 安全性指標 试验组患者总体[OR=1.77,95%CI(1.22,2.57),P=0.003]以及150 mg剂量亚组[OR=1.84,95%CI(1.18,2.86),P=0.007]的鼻咽炎发生率显著高于对照组,其他安全性指标总体及各剂量组比较差异均无统计学意义(P>0.05),详见表2。
3 讨论
AS是一种常见的炎症性关节炎,遗传因素是其发生风险和严重程度的主要决定因素[19]。AS的全基因组关联研究涉及特定的免疫通路,其中就包括IL-17、IL-23通路。IL-17是一种炎症细胞因子,参与防御细菌和真菌感染。IL-17A是IL-17家族的成员之一,相较于其他成员,IL-17A在炎症性疾病中发挥着最重要的作用[19]。IL-17A已显示在AS的发病机制中起着重要的作用,有研究表明,AS患者循环和关节软骨下骨髓中产生IL-17A的细胞数量增加[20]。司库奇尤单抗是第一个用于治疗AS的IL-17A抑制剂,特别是对于那些使用TNFi疗效不佳的中、重度AS患者,司库奇尤单抗也能显示出较好的疗效。
本研究纳入的5项研究均为随机、四盲的RCT,患者基本特征相似,具有可比性。Meta分析结果显示,在疗效方面,75、150、300 mg剂量的司库奇尤单抗在改善患者ASAS20、ASAS40、ASAS5/6、ASAS PR以及BASDAI方面均显著优于安慰剂,提示3种剂量的方案对AS的治疗均具有较好的疗效。在安全性方面,Meta分析结果显示其在严重不良反应、因不良反应撤出治疗、头痛以及腹泻的发生率方面与安慰剂相当。在一般不良反应中鼻咽炎的发生率方面,司库奇尤单抗高于安慰剂,进一步分析发现这一结果主要由150 mg剂量导致,而75、300 mg剂量组和安慰剂组之间无统计学差异,但150 mg剂量组只纳入了一组数据,故鼻咽炎发生率是否与司库奇尤单抗的剂量有关还需要更多的试验数据证明。总体而言,司库奇尤单抗耐受性良好且较安全。该药在多个国家和地区进行了临床试验,其中也包括了在我国进行的试验(Huang F等[18]的研究),研究结果显示出司库奇尤单抗具有良好的疗效和安全性,提示该药的使用可能没有地域或人种的局限性。目前,美国FDA只批准了司库奇尤单抗150、300 mg治疗AS[12],但本研究提示75 mg剂量同样有效且安全性较好,或也可成为临床治疗AS患者的一种选择方案。但这一结论还需要更多设计严格、长期随访的大样本RCT加以验证。
该研究存在的局限性包括:(1)某些疗效性指标存在异质性,通过敏感性分析显示研究[17]可能是导致异质性升高的原因,进一步研究发现其研究中的一组患者在前4周未使用负荷剂量,而另一组患者使用的负荷剂量方案与其他研究不同,这或许是合并研究结果时导致异质性的主要原因。尽管该研究结果显示150 mg 司库奇尤单抗负荷剂量和不使用负荷剂量两种方案对疗效的影响差异没有统计学意义,但在前4周使用不同的剂量方案可能会导致差异的产生,这需要进一步的试验来验证。(2)75 mg和300 mg剂量只纳入了2项或1项研究,故不能合并得出足够大样本的数据,同时也不能进行剂量间的直接比较,无法找出剂量间的差异。因此,未来的临床试验可以设计更多的75、300 mg的剂量组,以充分比较3种剂量间的差异,为司库奇尤单抗临床用药剂量提供有意义的参考。
综上所述,3种剂量的司库奇尤单抗均能有效改善AS患者的症状,并具有良好的耐受和安全性,同时该药的使用无人群地域的限制,或可成为我国AS治疗的一种选择。150 mg司库奇尤单抗会导致一般不良反应鼻咽炎的发生率升高,但需要更多数据来加以评估。后续的临床试验可以设计更多的包含75 mg和300 mg剂量的设计严格、长期随访的大样本RCT,以充分比较3种剂量间的差异,为司库奇尤单抗临床合理用药剂量提供更充分的循证证据。
参考文献
[ 1 ] DOUGADOS M,BAETEN D. Spondyloarthritis[J]. Lancet,2011,377(9783):2127-2137.
[ 2 ] GARG N,VAN DEN BOSCH F,DEODHAR A. The concept of spondyloarthritis:where are we now?[J]. Best Pract Res Clin Rheumatol,2014,28(5):663-672.
[ 3 ] BRAUN J,SIEPER J. Ankylosing spondylitis[J]. Lancet,2007,369(9769):1379-1390.
[ 4 ] NG SC,LIAO Z,YU DT,et al. Epidemiology of spondyloarthritis in the Peoples Republic of China:review of the literature and commentary[J]. Semin Arthritis Rheum,2007,37(1):39-47.
[ 5 ] 吴珊珊,段振华,潘发明.强直性脊柱炎流行病学研究进展[J].安徽医科大学学报,2013,48(8):988-992.
[ 6 ] BRAUN J,VAN DEN BERG R,BARALIAKOS X,et al. 2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis[J]. Ann Rheum Dis,2011,70 (6):896-904.
[ 7 ] VAN DER HEIJDE D,RAMIRO S,LANDEWE R,et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis[J]. Ann Rheum Dis,2017. DOI:10.1136/annrheumdis2016-210770.
[ 8 ] 贺玉杰,刘升云,张磊.来氟米特治疗强直性脊柱炎疗效的Meta分析[J].中国药房,2011,22(16):1498-1501.
[ 9 ] BARALIAKOS X,LISTING J,BRANDT J,et al. Clinical response to discontinuation of anti-TNF therapy in patients with ankylosing spondylitis after 3 years of conti- nuous treatment with infliximab[J]. Arthritis Res Ther,2005,7(3):439-444.
[10] VAN DER HEIJDE D,SCHIFF MH,SIEPER J,et al. Adalimumab effectiveness for the treatment of ankylosing spondylitis is maintained for up to 2 years:long-term results from the ATLAS trial[J]. Ann Rheum Dis,2009,68(6):922-929.
[11] BAETEN D,BARALIAKOS X,BRAUN J,et al. Antiinterleukin-17A monoclonal antibody secukinumab in treatment of ankylosing spondylitis:a randomised,double- blind,placebo-controlled trial[J]. Lancet,2013,382(9906):1705-1713.
[12] Novartis. COSENTYX?(Secukinumab) injection:US prescribing information[EB/OL].(2020-03-23)[2020-04- 15]. https://www.fda.gov/drugs/drug-approvals-and-databases/drug-trials-snapshot-cosentyx-secukinumab.
[13] HIGGINS JP,ALTMAN DG,G?TZSCHE PC,et al. The cochrane collaborations tool for assessing risk of bias in randomised trials[J]. BMJ,2011. DOI:10.1136/bmj.d5928.
[14] DEODHAR AA,DOUGADOS M,BAETEN DL,et al. Effect of Secukinumab on patient-reported outcomes in patients with active ankylosing spondylitis:a phase Ⅲ randomized trial (MEASURE 1)[J]. Arthritis Rheumatol,2016,68(12):2901-2910.
[15] MARZO-ORTEGA H,SIEPER J,KIVITZ A,et al. Se- cukinumab and sustained improvement in signs and symptoms of patients with active ankylosing spondylitis through two years:results from a phase Ⅲ study[J]. Arthritis Care Res:Hoboken,2017,69(7):1020-1029.
[16] PAVELKA K,KIVITZ A,DOKOUPILOVA E,et al. Efficacy,safety,and tolerability of secukinumab in patients with active ankylosing spondylitis:a randomized,double-blind phase 3 study,MEASURE 3[J]. Arthritis Res Ther,2017,19(1):285-288.
[17] KIVITZ AJ,WAGNER U,DOKOUPILOVA E,et al. Efficacy and safety of secukinumab 150 mg with and without loading regimen in ankylosing spondylitis:104-week results from MEASURE 4 study[J]. Rheumatol Ther,2018,5 (2):447-462.
[18] HUANG F,SUN F,WAN W,et al. FRI0414 secukinu- mab provides rapid and significant improvement in the signs and symptoms of ankylosing spondylitis:primary (16-week) results from a phase 3 China-centric study,MEASURE 5[J]. Ann Rheum Dis,2019,78(4):894-895.
[19] HANSON A,BROWN MA. Genetics and the causes of ankylosing spondylitis[J]. Rheum Dis Clin North Am,2017,43(3):401-414.
[20] BLAIR HA. Secukinumab:a review in ankylosing spondylitis[J]. Drugs,2019,79(4):433-443.
(收稿日期:2020-04-29 修回日期:2020-06-20)
(編辑:刘明伟)

