灵芝多糖粗提物对雌二醇诱导小鼠胸腺萎缩的改善作用研究
孙嫣 范新 王刚 朱韵辰
摘 要 目的:研究灵芝多糖粗提物对雌二醇诱导小鼠胸腺萎缩的改善作用。方法:将60只雌性ICR小鼠随机分为正常对照组(生理盐水)、模型组(生理盐水)和灵芝多糖粗提物高、低剂量组(400、100 mg/kg,以生药量计),每组15只。除正常对照组外,其余各组小鼠均隔天腹腔注射雌二醇(0.1 mg/只,共6次)建立胸腺萎缩模型。造模结束后次日,小鼠灌胃给药,每天1次,连续给药14 d。末次给药24 h后,测定小鼠脏器(胸腺、脾)指数以及血浆中丙二醛(MDA)含量和谷胱甘肽S-转移酶(GST)活性,采用苏木精-伊红染色法观察小鼠胸腺、脾组织的病理学变化,采用原位末端标记法检测小鼠胸腺细胞凋亡情况,并采用流式细胞术检测其外周血中T细胞亚群分类。结果:与正常对照组比较,模型组小鼠胸腺指数和外周血中CD3+CD4+T细胞比例、CD4+/CD8+T比值均显著降低(P<0.01),脾指数、血浆中MDA含量、胸腺细胞凋亡水平以及外周血中CD3+CD8+T细胞比例均显著升高(P<0.05或P<0.01);小鼠胸腺皮质和髓质分界模糊、细胞间隙增大、皮質出现部分细胞损伤凋亡,脾组织未见明显病理学变化。与模型组比较,灵芝多糖粗提物高剂量组小鼠胸腺指数、血浆中GST活性以及外周血中CD3+CD4+T细胞比例、CD4+/CD8+比值均显著升高(P<0.05或P<0.01),血浆中MDA含量、胸腺细胞凋亡水平显著降低(P<0.05或P<0.01),且胸腺组织病理学变化明显改善;灵芝多糖粗提物低剂量组小鼠仅血浆中MDA含量显著降低(P<0.01),其余指标/病理学变化均不明显。结论:高剂量(400 mg/kg)灵芝多糖粗提物对雌二醇诱导的小鼠胸腺萎缩具有一定的改善作用。
关键词 灵芝多糖粗提取;雌二醇;胸腺萎缩;免疫调节;小鼠
ABSTRACT OBJECTIVE: To study the improvement effects of Ganoderma lucidum polysaccharides crude extract on estradiol-induced thymus atrophy in mice. METHODS: Totally 60 female ICR mice were randomly divided into normal control group (normal saline), model group (normal saline), G. lucidum polysaccharides crude extract high-dose and low-dose groups (400, 100 mg/kg, by crude drug), with 15 mice in each group. Except for normal control group, other groups were given estradiol intraperitoneally (0.1 mg/mice, 6 times) every other day to establish thymic atrophy model. The next day after modeling finished, they were given relevant medicine intragastrically, once a day, for consecutive 14 d. Twenty-four hours after last medication, organ (thymus, spleen) index, MDA content and GST activity in plasma were determined. HE staining was adopted to observe the pathological changes of thymus and spleen tissue in mice. The thymus cell apoptosis was examined by TUNEL assay, and the T cell subsets in peripheral blood were detected by flow cytometry. RESULTS: Compared with normal control group, the thymus index, proportion of CD3+CD4+T cell in peripheral blood and CD4+/CD8+ ratio were decreased significantly in model group (P<0.01); spleen index, MDA content in plasma and thymocyte apoptosis level as well as the proportion of CD3+CD8+T cell in peripheral blood were all increased significantly (P<0.05 or P<0.01). Thymic cortex and medullary boundary of mice was blurred; the intercellular space was enlarged; some cells were damaged and apoptotic in cortex; no pathological changes were found in the spleen. Compared with model group, thymus index and GST activity in plasma as well as proportion of CD3+CD4+T cell in peripheral blood and CD4+/CD8+ ratio were all increased significantly in G. lucidum polysaccharides crude extract high-dose group (P<0.05 or P<0.01); while MDA content in plasma, the apoptosis level of thymocytes were all decreased significantly (P<0.01 or P<0.05); and the pathological changes of thymus were improved significantly. MDA content in plasma was decreased significantly in G. lucidum polysaccharides crude extract low-dose group (P<0.01), and other indexes/pathological changes were not obvious. CONCLUSIONS: High dose (400 mg/kg) of G. lucidum polysaccharides crude extract can improve the thymus atrophy induced by estradiol in mice.
KEYWORDS Ganoderma lucidum polysaccharide crude extract; Estradiol; Thymus atrophy; Immunomodulation; Mice
灵芝多糖(Ganoderma lucidum polysaccharides)为名贵中药材灵芝的主要药效成分之一,其种类繁多,结构复杂,分子量从几百到几十万不等,到目前为止,被人们发现的灵芝多糖已经超过200种[1]。灵芝多糖主要来源为灵芝子实体多糖、发酵液多糖以及液体发酵产生的菌丝体多糖[2]。灵芝多糖作为一种有效免疫调节剂,能够全面且有效地影响免疫细胞(包括T淋巴细胞、巨噬细胞、B淋巴细胞等)的功能,同时释放趋化因子、生长因子,从而调节机体的适应性免疫[3],其调节机体免疫力的功效已成为研究热点[4]。胸腺作为免疫系統重要的中枢器官,与机体的健康息息相关。但自然衰老、病毒感染、药物诱导以及外伤等均可能会诱导胸腺萎缩,从而导致免疫力下降,加速衰老与疾病的发生[5]。在前期的研究中,笔者发现灵芝孢子粉对胸腺萎缩有一定的改善作用,而灵芝多糖是其主要药效成分之一,故本研究拟探索灵芝多糖对雌二醇诱导小鼠胸腺萎缩的影响,明确灵芝多糖调节免疫的药效作用,为灵芝药用成分的深入开发提供参考。
1 材料
1.1 仪器
ME204E型万分之一分析天平、DM4000型生物显微镜(德国Leica公司);CS120FNX型微量超速冷冻离心机(日本Hitachi公司);M200Pro型酶标仪(瑞士Tecan公司);NovoCyte型流式细胞仪(美国ACEA Biosciences公司)。
1.2 药品与试剂
灵芝菌粉(浙江方格药业有限公司,批号:10141-3-160517);苯甲酸雌二醇注射液[上海全宇生物科技(驻马店)动物药业有限公司,批号:190504,规格:4 mg ∶ 2 mL];丙二醛(MDA)含量检测试剂盒、谷胱甘肽-S-转移酶(GST)活性检测试剂盒(北京索莱宝科技有限公司,批号:20200218、20200316);原位末端标记法(TUNEL)凋亡检测试剂盒(上海碧云天生物技术有限公司,批号:080919190826);CD3-别藻蓝蛋白(APC)、CD4-藻红蛋白(PE)、CD8-异硫氰酸(FITC)抗体(美国Biogems公司,批号:80E041705122、60E271706122、50M281710- 112);其余试剂均为分析纯,水为实验室自制三蒸水。
1.3 动物
健康ICR小鼠60只,雌性,体质量18~20 g,购自浙江省医学科学院实验动物中心,实验动物生产许可证号:SCXK(浙)2019-0002,质量合格证号:1912180039。动物饲养于屏障级动物房,环境温度为18~26 ℃、相对湿度为40%~70%、光照明暗交替(各12 h)、每小时通风22次。实验方案符合《浙江省实验动物管理办法》对动物伦理的要求。
2 方法
2.1 灵芝多糖粗提物的制备
取灵芝菌粉80 g,加1 600 mL水,超声(功率:300 W,频率:40 kHz)提取2次(第1次提取1 h、第2次提取0.5 h),过滤,合并2次滤液。将滤液60 ℃减压浓缩至1 g/mL(以生药量计)的药液,加入95%乙醇400 mL调溶液的醇体积分数为80%,混匀,4 ℃下静置24 h,然后以4 000 r/min离心20 min,弃去上清液。取沉淀,冷冻干燥即得灵芝多糖粗提物,得率为5%。用硫酸蒽酮法[6]测得其多糖含量为15%。
2.2 分组、造模与给药
将60只小鼠根据体质量按随机分组表分为4组,每组15只,分别为正常对照组(生理盐水)、模型组(生理盐水)和灵芝多糖粗提物高、低剂量组(400、100 mg/kg,以生药量计)[7]。模型组和灵芝多糖粗提物高、低剂量组小鼠隔天腹腔注射苯甲酸雌二醇注射液(0.1 mg/只)1次,共注射6次(造模用时11 d);正常对照组小鼠不作任何实验操作。于造模完成后次日开始给药,每天给药1次,连续给药14 d。
2.3 取材与样本处理
末次给药24 h后,称定小鼠体质量并从眼内眦取血(约0.5 mL),将血样置于乙二胺四乙酸二钾(EDTA-2K)抗凝管中,涡旋摇匀,备用。取血后将小鼠脱颈椎处死,取出胸腺和脾,称质量,将胸腺和脾组织置于福尔马林溶液中固定,用于后续病理学检测。
2.4 小鼠脏器指数测定
根据“2.3”项下测定的末次给药24 h后小鼠体质量和脏器(胸腺、脾)质量计算其脏器指数:脏器指数=脏器(胸腺、脾)质量(mg)/末次给药24 h后体质量(g)。
2.5 小鼠血浆中MDA含量和GST活性检测
取适量抗凝血,以3 000 r/min离心15 min,然后取上层血浆,根据相应试剂盒说明书操作,检测血浆中MDA含量和GST活性。
2.6 小鼠胸腺、脾组织的病理学变化观察
将小鼠胸腺、脾组织置于福尔马林溶液中固定1周后取出,常规制作石蜡切片(厚度5 μm),行苏木精-伊红(HE)染色,然后于显微镜下观察胸腺和脾组织的病理学变化。
2.7 小鼠胸腺细胞凋亡检测
采用TUNEL法进行检测。取“2.6”项下各组小鼠胸腺组织石蜡切片(每组选3个组织样本),置于防脱载玻片上,55 ℃下烤片2 h,然后按照TUNEL凋亡检测试剂盒(显色法)说明书进行操作,检测胸腺组织中胸腺细胞的凋亡情况(镜下可见凋亡细胞被染色成棕褐色)。使用Image J 1.52a软件根据阳性染色面积进行半定量分析。每个组织随机选取2个面积相同的视野并计算选择视野下阳性染色面积的相对面积百分比(即阳性染色面积占总面积的百分比),用来表示细胞凋亡水平。
2.8 小鼠外周血中T细胞分类检测
取100 μL小鼠抗凝血(每组取10个样本进行测定),加入CD3-APC、CD4-PE、CD8-FITC荧光抗体,充分混匀,室温下避光孵育15 min。孵育结束后,加入1 mL红细胞裂解液,混匀,室温下避光处理15 min,然后以500×g离心5 min,弃去上清液;加入1 mL常温无菌磷酸盐缓冲液(PBS)清洗后,再次以500×g离心5 min,弃去上清液;加入0.5 mL常温无菌PBS重悬后,采用流式细胞仪进行检测,分析外周血中T细胞亚群比例。
2.9 统计学方法
采用SPSS 20.0软件进行数据分析。计量资料以x±s表示,多样本均数间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
3 结果
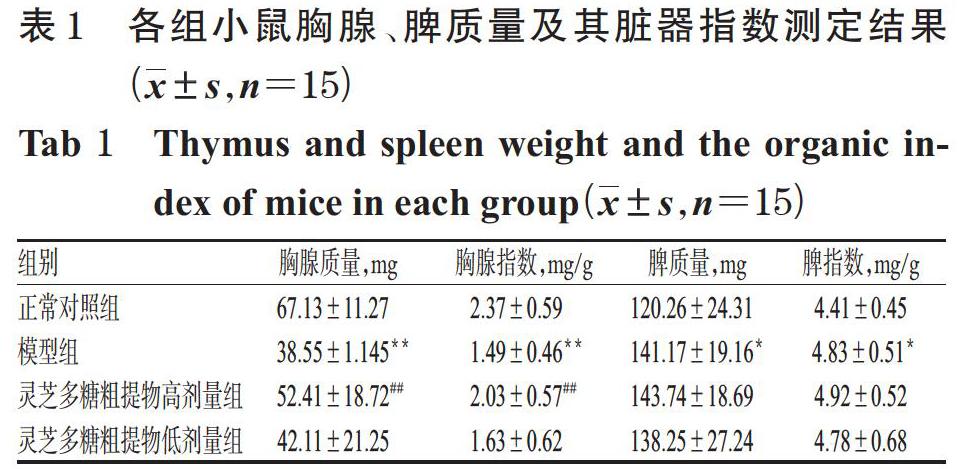
3.1 小鼠脏器质量和脏器指数测定结果
与正常对照组比较,模型组小鼠胸腺质量、胸腺指数均显著降低(P<0.01),脾质量和脾指数均显著升高(P<0.05)。与模型组比较,灵芝多糖粗提物高剂量组小鼠胸腺质量、胸腺指数显著升高(P<0.01)。各组小鼠胸腺、脾质量及其脏器指数测定结果见表1。
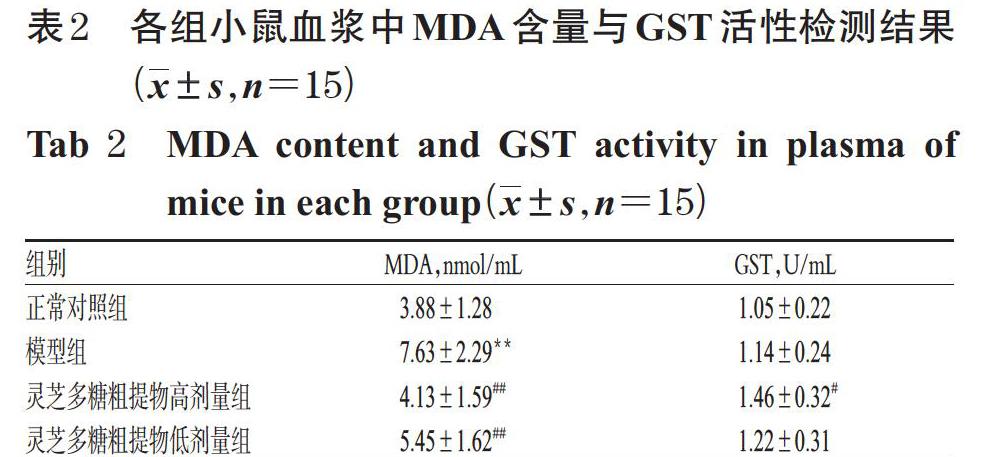
3.2 小鼠血浆中MDA含量和GST活性检测结果
与正常对照组,模型组小鼠血浆中MDA含量显著升高(P<0.01)。与模型组比较,灵芝多糖粗提物高、低剂量组小鼠血浆中MDA含量均显著降低(P<0.01),且灵芝多糖粗提物高剂量组小鼠血浆中GST活性显著升高(P<0.05)。各组小鼠血浆中MDA含量与GST活性检测结果见表2。
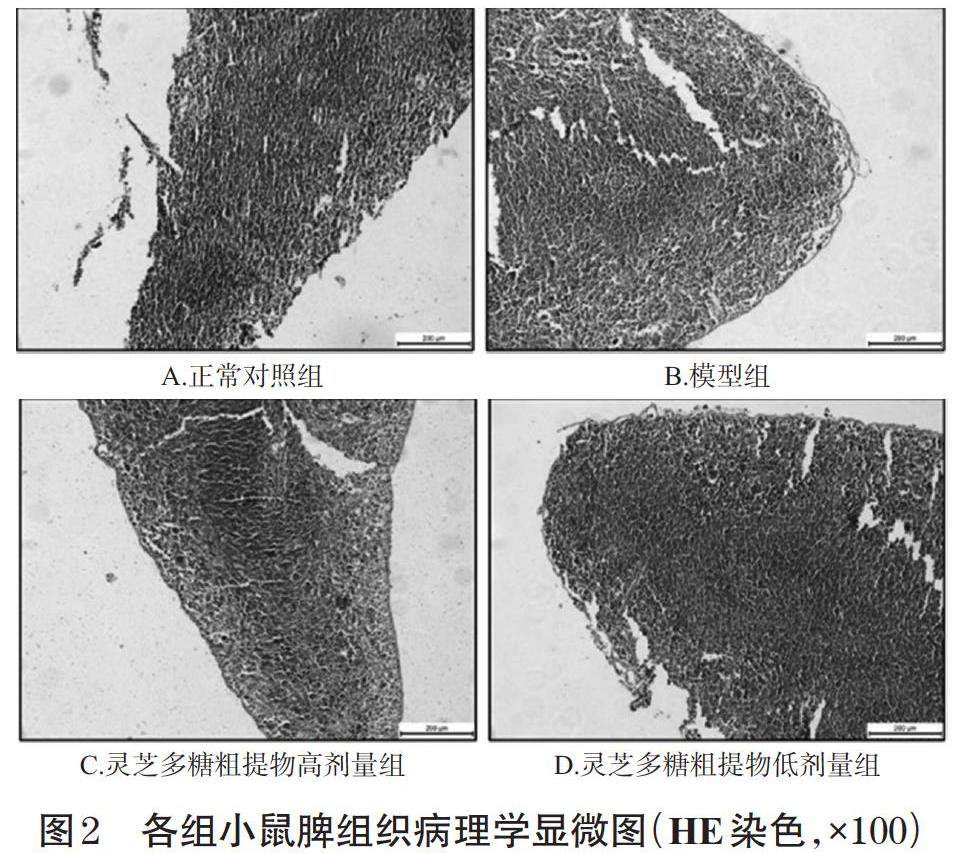
3.3 小鼠胸腺和脾组织病理学变化观察结果
3.3.1 胸腺组织 正常对照组小鼠胸腺组织皮质髓质分界明显,皮质区淋巴细胞排列整齐,髓质区可见胸腺小体。模型组小鼠胸腺组织皮质变薄,其中胸腺细胞数明显减少、结构疏松,细胞间隙增大,可见大量网状上皮细胞,皮质分界较为模糊。灵芝多糖粗提物高剂量组小鼠胸腺组织皮质与髓质分界较为清晰,细胞排列规整。灵芝多糖粗提物低剂量组小鼠胸腺组织病理学变化虽较模型组有一定改善,但皮质髓质分界仍不够清晰,细胞间隙仍较大。各组小鼠胸腺组织病理学显微图见图1。
3.3.2 脾组织 各组别小鼠的脾组织被膜均完整,白髓、红髓组织均清晰,淋巴小结分布均无显著变化,HE染色结果显示各组间未见明显差异。各组小鼠脾组织病理学显微图见图2。
3.4 小鼠胸腺细胞凋亡检测结果
与正常对照组比较,模型组小鼠胸腺细胞凋亡水平显著升高(P<0.01),皮质、髓质均出现了细胞凋亡。与模型组比较,灵芝多糖粗提物高剂量组小鼠胸腺细胞凋亡水平显著降低(P<0.05)。各组小鼠胸腺组织细胞凋亡显微图见图3,细胞凋亡水平测定结果见图4。
3.5 小鼠外周血中T细胞分类检测结果
与正常对照组比较,模型组小鼠外周血中CD3+CD4+T细胞比例和CD4+/CD8+比值均显著降低(P<0.01),CD3+CD8+T细胞比例显著升高(P<0.05)。与模型组比较,灵芝多糖粗提物高剂量组小鼠外周血中CD3+CD4+T細胞比例和CD4+/CD8+比值均显著升高(P<0.01)。各组小鼠外周血流式细胞仪分析结果见图5,T细胞亚群检测结果见表3。
4 讨论
在本研究中,模型组小鼠胸腺质量及胸腺指数显著降低,而脾质量及脾指数显著升高。在小鼠受到雌二醇刺激出现胸腺萎缩后,机体免疫力随之下降,故笔者认为,此时脾脏增大是机体为了提高自身免疫水平而出现的代偿性增长,故脾脏HE染色结果中也未发现组织出现病变。MDA含量是反映机体抗氧化潜在能力的重要指标,可反映血液系统中氧自由基的水平[8]。GST是体内解毒系统的组成部分,该指标可用于评价药物干预后,是否可以增强机体的解毒水平[8]。本研究结果显示,高剂量灵芝多糖粗提物可以明显降低血浆中MDA含量,从而减轻氧化作用;并且其还可显著提高血浆中GST活性,从而提升机体的解毒能力。根据胸腺组织的病理学观察结果以及胸腺细胞凋亡检测结果来看,高剂量灵芝多糖粗提物可一定程度地减轻模型小鼠胸腺细胞的损伤,改善其胸腺组织的萎缩,但对小鼠脾指数并无显著改善,这说明灵芝多糖粗提物对该模型小鼠脾脏无明显影响。
胸腺作为哺乳动物T细胞分化、发育和成熟的主要场所,为T细胞的发育提供了一个完善而复杂的微环境,可有序地调控T细胞的成熟和迁移[5]。胸腺作为机体免疫系统的关键器官之一,在青少年时期发育达到顶峰,随着年龄的增长,胸腺每年约以3%的体积逐渐萎缩,中老年后胸腺逐渐脂肪化,功能也随之减弱,这也是老年人免疫力低下、更容易患病的原因之一[9-10]。同时,外界因素如病毒感染、疾病、药物以及激素水平变化等都是造成胸腺萎缩的诱因,胸腺的萎缩将会造成机体抵抗力的进一步下降[11-12]。若以抑制胸腺萎缩作为药物研究的方向,将会对疾病的治疗以及维持机体的健康起到积极的作用。
T细胞亚群间的比值是反映机体细胞免疫功能的重要指标,在分析发病机制、观察疗效及监测预后中具有重要意义[13]。T细胞亚群主管细胞免疫,具有抵抗病毒和调节免疫系统功能的作用,其细胞功能取决于T细胞总值(CD3+)及其亚群(CD4+、CD8+)的相对组成。正常情况下,T细胞亚群间互相拮抗达到平衡;当免疫失衡时,T细胞亚群的比值变化紊乱,则易引发疾病[14]。CD4+是诱导与辅助的T细胞,是调控免疫反应的枢纽细胞;CD8+是抑制与毒杀的T细胞,是免疫反应直接杀伤性细胞。CD4+/CD8+比值可反映机体免疫功能的情况,当该比值下降时则表明机体免疫处于被抑制的状态[15]。本研究结果显示,模型组小鼠外周血中CD3+CD4+T细胞比例较正常对照组显著下降,CD3+CD8+T细胞比例较正常对照组显著上升。这说明在雌二醇作用下,起诱导与辅助作用的CD3+CD4+T细胞受到了抑制,导致CD4+/CD8+比值降低,机体免疫力下降。灵芝多糖粗提物高剂量组小鼠给药后外周血中CD3+CD4+T细胞比例和CD4+/CD8+比值较模型组显著升高,这说明灵芝多糖粗提物可提高CD3+CD4+T细胞的转化,从而调控机体免疫力;而灵芝多糖粗提物低剂量的调控效果相对不明显。
综上所述,本文研究了灵芝多糖粗提物对雌二醇诱导的小鼠胸腺萎缩的影响,发现高剂量(400 mg/kg)灵芝多糖粗提物对该模型小鼠的胸腺萎缩具有一定的改善作用。由于临床上并无针对胸腺萎缩症状的药物,故本研究未设置阳性药物组。此外,本研究所用的灵芝多糖为粗提物,在后期研究中,笔者将会通过优化工艺,对更高纯度灵芝多糖的药效及其改善胸腺萎缩作用的可能机制开展进一步研究。
参考文献
[ 1 ] 解修超,贾少杰,彭浩,等.灵芝多糖液体发酵调控及药理作用研究进展[J].陕西理工大学学报(自然科学版),2018,34(6):65-70.
[ 2 ] 王颖,魏佳韵,吴思佳,等.灵芝多糖结构特征及药理作用的研究进展[J].中成药,2019,41(3):627-635.
[ 3 ] 谢怡琼,王琪瑞,孙思雅,等.灵芝的药理作用和临床应用研究进展[J].临床医学研究与实践,2020,5(10):191- 193.
[ 4 ] 陈文华,程显好,谭会颖,等.灵芝多糖的药理作用及其机制研究进展[J].中国药房,2018,29(24):3446-3450.
[ 5 ] 曾艳,宋银宏.年龄依赖性胸腺萎缩的相关因素[J].中国免疫学杂志,2019,35(23):2932-2935.
[ 6 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:188-189.
[ 7 ] 李建军.灵芝多糖免疫调节作用与抗肿瘤作用的关系及作用机制的研究[D].广州:第一军医大学,2007.
[ 8 ] YANG ZW,WANG J,LI JG,et al. Antihyperlipidemic and hepatoprotective activities of polysaccharide fraction from Cyclocarya paliurus in high-fat emulsion-induced hyperlipidaemic mice[J]. Carbohyd Polym,2017. DOI:10. 1016/j.carbpol.2017.11.033.
[ 9 ] MAJUMDAR S,NANDI D. Thymic atrophy:experimental studies and therapeutic interventions[J]. Scand J Immunol,2018,87(1):4-14.
[10] ASPINALL R,MITCHELL W. Reversal of age-associated thymic atrophy:treatments,delivery,and side effects[J]. Exp Gerontol,2008,43(7):700-705.
[11] XAVIER AM,ANUNCIATO AKO,ROSENSTOCK TR,et al. Gene expression control by glucocorticoid receptors during innate immune responses[J]. Front Endocrinol:Lausanne,2016. DOI:10.3389/fendo.2016.00031.
[12] PALMER S,ALBERGANTE L,BLACKBURN CC,et al. Thymic involution and rising disease incidence with age[J]. PNAS,2018,115(8):1883-1888.
[13] 馬锡慧,肖漓.淋巴细胞亚群成员研究进展[J].中华细胞与干细胞杂志,2017,7(3):168-172.
[14] AMUNULLA A,VENKATESAN R,RAMAKRISHNAN H,et al. Lymphocyte subpopulation in healthy and di- seased gingival tissue[J]. J Indian Soc Periodontol,2008,12(2):45-50.
[15] ZHANG HP,WU T. CD4+T,CD8+T counts and severe COVID-19:a meta-analysis[J]. J Infect,2020. DOI:10. 1016/j.jinf.2020.06.036.
(收稿日期:2020-05-12 修回日期:2020-07-12)
(编辑:林 静)

