lncRNA DLX6⁃AS1通过靶向miR⁃16⁃5p/NUCKS1调控皮肤鳞状细胞癌细胞A431增殖、迁移和侵袭
郑云鹏 蔡丙杰 李旭阳 李冬芹 尹光文
郑州大学第一附属医院皮肤科450052
长 链 非 编 码RNA(long non ⁃ coding RNAs,lncRNA)和微小RNA(microRNA,miRNA)均属于非编码RNA,均参与肿瘤的发生发展过程[1]。皮肤鳞状细胞癌(简称皮肤鳞癌)是常见的皮肤恶性肿瘤[2],手术、放疗和化疗联合治疗是晚期皮肤鳞癌的经典治疗方式,靶向和免疫治疗是其治疗的新方式[3]。研究表明,lncRNA、miRNA可能在皮肤鳞癌的发生、转移中发挥作用[4⁃5]。有报道显示,长链非编码生长停滞特异性蛋白6 反义RNA1(growth stasis specific protein 6 antisense RNA 1,lncRNA DLX6⁃AS1)在多种恶性肿瘤中高表达,其高表达与细胞增殖和侵袭有关[6⁃7],但lncRNA DLX6⁃AS1在皮肤鳞癌中的作用尚不清楚。miR⁃16⁃5p在乳腺癌[8]和肾癌[9]中低表达,影响癌细胞的增殖、迁移和侵袭。核酪蛋白激酶和细胞周期蛋白依赖性激酶底物1(nuclear ubiquitous casein and cyclin ⁃ dependent kinase substrate1,NUCKS1)在胃癌中高表达,可促进癌细胞的侵袭[10]。我们通过在线工具starBase预测发现,lncRNA DLX6⁃AS1和miR⁃16⁃5p存在结合位点,且NUCKS1可能是miR⁃16⁃5p的靶基因,然而miR⁃16⁃5p和NUCKS1在皮肤鳞癌中的表达和作用尚不清楚。因此,我们探讨lncRNA DLX6⁃AS1靶向miR⁃16⁃5p/NUCKS1对皮肤鳞癌细胞增殖、迁移和侵袭的影响。
材料与方法
一、材料
人皮肤角质形成细胞株HaCaT细胞(细胞株号CVCL_0038)和皮肤鳞癌A431 细胞(细胞株号CVCL_0037)产自美国模式培养物集存库。DMEM高糖培养基、胎牛血清和胰蛋白酶(美国Hyclon 公司),NUCKS1抗体、细胞周期蛋白D1(Cyclin D1)抗体、基质金属蛋白酶(MMP)2 抗体和MMP9 抗体(美国Santa cruze公司),山羊抗兔IgG-辣根过氧化物酶(HRP,北京百奥莱博科技有限公司);Lipofectamine 2000 转染试剂、Total RNA 提取试剂盒、逆转录试剂盒和实时荧光定量PCR[qRT⁃PCR试剂盒,宝生物工程(大连)有限公司],双荧光素酶报告系统(dual⁃luciferase reporter assay system)(美国Promega 公司),lncRNA DLX6⁃AS1 抑制物(si⁃DLX6⁃AS1,5′⁃GATCGTAGGCTAACACATCCATGG AATCAAGAGTTCCATGGATGTGTTAGCCTATTTTT TGA⁃3′)、miR⁃16⁃5p 模拟物(miR⁃16⁃5p,5′⁃GCGGTTATAAATGCACGACGAT⁃3′)、miR⁃16⁃5p抑制物(anti⁃miR⁃16⁃5p,5′⁃CACCAATATTTACGTGCT GCTA⁃3′)、NUCKS1抑制物(si⁃NUCKS1,5′⁃GAAGG TTGTTGATTACTCACAGTTT ⁃ 3′)和 相 应 对 照[DLX6⁃AS1⁃NC(5′⁃GATCGATCCGATGTCGGTATA AGAACTCAAGAGGTTCTTATACCGACATCGGATT TTTTTGA⁃3′)、miR⁃NC(5′⁃ATTTGCCAGGTCGGAA TG⁃3′)、anti⁃miR⁃NC(5′⁃UCACAACCUCCUAG AAAGAGUAGA⁃3′)、NUCKS1⁃NC(5′⁃CTAGTACTT ACGTTATGGAAGTTTG⁃3′)](上海吉玛制药有限公司),细胞培养板(美国Corning公司),CCK8试剂盒、BCA蛋白浓度测定试剂盒、β肌动蛋白抗体(上海碧云天生物技术有限公司),全自动酶标仪和Real⁃time PCR仪(美国Bio⁃Rad公司)。
二、细胞培养
将A431细胞和HaCaT细胞分别培养在含10%胎牛血清、100 U/ml 青霉素和100 mg/L 链霉素的DMEM高糖培养液中,置于37 ℃、5%CO2培养箱中培养,每2天换液1次,1∶3消化传代。
三、qRT⁃PCR 检测lncRNA DLX6⁃AS1、miR⁃16⁃5p和NUCKS1mRNA的表达
取对数生长期HaCaT 和A431 细胞,用Total RNA提取试剂盒提取总RNA,根据反转录试剂盒说明书反转录合成cDNA,然后以cDNA 为模板,按照实时荧光定量PCR 试剂盒说明书操作,以U6 或GAPDH为内参,检测lncRNA DLX6⁃AS1、miR ⁃ 16 ⁃ 5p 和NUCKS1 mRNA的表达。引物由上海吉玛制药有限公司合成,序列见表1。反应条件为:95 ℃30 s,60 ℃30 s;72 ℃30 s,共40 个循环。使用2-ΔΔCt法分析HaCaT和A431细胞中lncRNA DLX6⁃AS1、miR⁃16⁃5p和NUCKS1 mRNA的相对表达。
四、Western 印 迹 检 测NUCKS1、Cyclin D1、MMP⁃2和MMP⁃9蛋白的相对表达水平
取对数生长期HaCaT 和A431 细胞,裂解液裂解细胞,提取总蛋白,使用BCA 法对蛋白进行定量。目的蛋白沸水浴变性处理,取上清液上样电泳,经转膜、封闭后,将膜转移至NUCKS1 抗体、Cyclin D1抗体、MMP2抗体、MMP9抗体和β肌动蛋白抗体(1∶1 000 稀释)溶液,于4 ℃孵育过夜,用磷酸盐吐温缓冲液洗膜3 次,将膜转移至相应的山羊抗兔IgG⁃HRP二抗稀释液(1∶1 000)中,孵育2 h。通过超敏ECL发光试剂盒显影、定影、曝光。使用Quantity One 4.6 软件分析条带灰度值,以目的蛋白条带与β肌动蛋白条带的比值表示蛋白的相对表达水平。
五、双荧光素酶报告系统实验
用starBase 预测DLX6⁃AS1 与miR⁃16⁃5p 及miR⁃16⁃5p 和NUCKS1 之间的互补序列,根据互补序列设计合成有互补结合位点的WT⁃DLX6⁃AS1、WT⁃NUCKS1序列和无互补结合位点的MUT⁃DLX6⁃AS1、MUT⁃NUCKS1 序列(图1),并通过DNA 连接酶将其克隆至荧光载体上,构建荧光素酶报告基因质粒(上海吉玛制药有限公司),根据Lipofectamine 2000 转染试剂说明书,分别与miR⁃16⁃5p、miR⁃NC共转染至A431 细胞,转染48 h 后按照双荧光素酶报告基因检测试剂盒要求操作,检测细胞的萤火虫荧光素酶活性和海肾荧光素酶活性,以二者的比值表示报告DLX6⁃AS1基因的表达水平。
六、调节DLX6⁃AS1、miR⁃16⁃5p、NUCKS1 的表达对A431细胞的影响
用胰蛋白酶消化对数生长期A431细胞,以1×l06/ml 接种于6 孔板,根据Lipofectamine 2000 转染试剂说明书,转染si⁃DLX6⁃AS1、si⁃NUCKS1 干扰A431细胞DLX6⁃AS1、NUCKS1表达,分别转染miR⁃16⁃5p、anti⁃miR⁃16⁃5p 上调和敲减A431 细胞miR⁃16⁃5p 的表达,转染8 h 后更换培养基,继续培养48 h,采用qRT⁃PCR和Western 印迹检测转染效率,确定转染成功后用于后续实验研究。
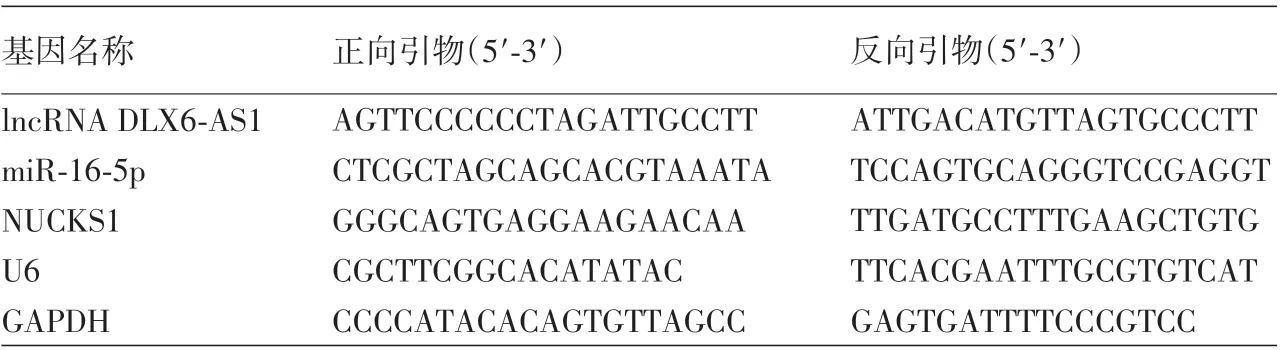
表1 实时荧光定量逆转录PCR引物信息

图1 根据长链非编码RNA DLX6⁃AS1 与微小RNA⁃16⁃5p(miR⁃16⁃5p)之间和miR⁃16⁃5p与NUCKS1之间的互补序列设计的序列 1A:长链非编码RNA DLX6⁃AS1与微小RNA⁃16⁃5p(miR⁃16⁃5p)之间的互补核苷酸序列;1B:miR⁃16⁃5p与NUCKS1之间的互补核苷酸序列。WT序列为有互补结合位点的序列;MUT序列为无互补结合位点的序列
1.干扰DLX6⁃AS1表达对A431细胞的影响:取转染si⁃DLX6⁃AS1、DLX6⁃AS1⁃NC 的A431 细胞,采用qRT⁃PCR 检测miR⁃16⁃5p、NUCKS1 mRNA 的表达,CCK8实验检测细胞存活率,Transwell实验检测细胞迁移和侵袭能力,Western 印迹检测NUCKS1、Cyclin D1、MMP2和MMP⁃9的相对表达水平。
CCK8实验:取各组A431细胞,稀释为2×104/ml,以100 μl/孔接种于96 微孔板中,每孔加入10 μl CCK8溶液,在培养箱中培养2 h,酶标仪测定450 nm吸光度(A 值)。细胞存活率=实验组A 值/对照组A值×100%。
Transwell实验检测细胞迁移和侵袭能力:迁移实验中,取各组A431 细胞,弃上清液,用无血清培养液重悬细胞,饥饿培养过夜,收集细胞,稀释为2×105/ml,取100 μl 细胞加入Transwell 上层小室,下层加入含胎牛血清的DMEM 培养液,培养24 h,棉签拭去上层小室未迁移的细胞,采用甲醛固定迁移细胞,结晶紫染色,拍照,显微镜下计数10个200倍视野,计算各组的迁移细胞均数。侵袭实验中,将Transwell 上层小室的培养液更换为1∶6 比例稀释的Matrigel基质,余步骤同迁移实验。
2.过表达miR⁃16⁃5p对A431细胞的影响:取转染miR⁃16⁃5p、miR⁃NC的A431细胞,采用qRT⁃PCR检测miR⁃16⁃5p 的表达,CCK8 实验检测细胞存活率,Transwell 实验检测细胞迁移和侵袭能力,Western 印迹法检测NUCKS1、Cyclin D1、MMP2 和MMP9的相对表达水平。
3. 敲低NUCKS1 对A431 细胞的影响:取转染si⁃NUCKS1、NUCKS1⁃NC 的A431 细胞,分别采用CCK8 实验检测细胞存活率,Transwell 实验检测细胞迁移和侵袭能力,Western 印迹检测NUCKS1、Cyclin D1、MMP2和MMP9的相对表达水平。
4.低表达lncRNA DLX6⁃AS1后敲减miR⁃16⁃5p对A431细胞的影响:取转染si⁃DLX6⁃AS1后分别转染anti⁃miR⁃16⁃5p、anti⁃miR⁃NC 的A431 细胞,采用qRT⁃PCR 检测miR⁃16⁃5p 的表达,CCK8 实验检测细胞存活率,Transwell实验检测细胞迁移和侵袭能力,Western 印迹检测Cyclin D1、MMP2 和MMP9 的相对表达水平。
5.低表达lncRNA DLX6⁃AS1、敲减miR⁃16⁃5p后抑制NUCKS1 对A431 细胞的影响:取转染si⁃DLX6⁃AS1 和anti⁃miR⁃16⁃5p 后分别转染si⁃NUCKS1、NUCKS1⁃NC 的A431 细 胞,分 别 采 用CCK8 实验检测细胞存活率,Transwell 实验检测细胞迁移和侵袭能力,Western 印迹检测NUCKS1、Cyclin D1、MMP2和MMP9的相对表达水平。
七、统计学处理
用SPSS21.0 软件对实验数据进行统计分析,所有数据均以±s 表示。两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
一、A431 与HaCaT 细胞中lncRNA DLX6⁃AS1、miR⁃16⁃5p、NUCKS1的表达
A431细胞中lncRNA DLX6⁃AS1的相对表达水平高于HaCaT 细胞(P<0.001),miR⁃16⁃5p 的相对表达水平低于HaCaT 细胞(P < 0.001),NUCKS1 mRNA 和蛋白的相对表达高于HaCaT 细胞(均P<0.001)。见图2、表2。
二、双荧光素酶报告系统验证lncRNA DLX6⁃AS1 与miR⁃16⁃5p、miR⁃16⁃5p 与NUCKS1 的靶向结合能力
共转染WT⁃DLX6⁃AS1后,miR⁃16⁃5p组细胞相对荧光素酶活性低于miR⁃NC 组(t = 14.87,P <0.05);共转染WT⁃NUCKS1后,miR⁃16⁃5p组细胞相对荧光素酶活性亦低于miR⁃NC 组(t = 12.94,P <0.05);而共转染MUT⁃DLX6⁃AS1、MUT⁃NUCKS1后,miR⁃16⁃5p组细胞相对荧光素酶活性与miR⁃NC组差异均无统计学意义(P>0.05)。见图3。
三、低表达lncRNA DLX6⁃AS1 对A431 细胞的影响
si⁃DLX6⁃AS1 组细胞DLX6⁃AS1 表达水平(0.30 ± 0.03)低于DLX6⁃AS1⁃NC 组(1.00 ± 0.11,t = 18.42,P < 0.001),miR⁃16⁃5p 表达水平(3.01 ±0.31)高于DLX6⁃AS1⁃NC 组(1.02±0.10,t=18.33,P < 0.001),细胞存活率(55.13% ± 5.50%)低于DLX6⁃AS1⁃NC组(100.27%±10.05%,t=11.82,P<0.001);si⁃DLX6⁃AS1 组细胞NUCKS1、Cyclin D1、MMP2 和MMP9 蛋白表达量均低于DLX6⁃AS1⁃NC组(均P<0.05,图4A、4B),细胞迁移和侵袭细胞数亦低于DLX6⁃AS1⁃NC组(均P<0.05,图4C、4D)。
四、高表达miR⁃16⁃5p对A431细胞的影响
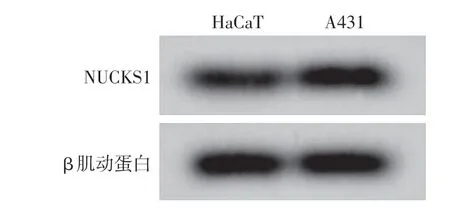
图2 Western 印迹检测HaCaT 和A431 细胞中NUCKS1 的表达 A431细胞中NUCKS1蛋白表达水平高于HaCaT细胞
表2 HaCaT和A431细胞中lncRNA DLX6⁃AS1、miR⁃16⁃5p和NUCKS1 mRNA及蛋白的表达比较(±s)

表2 HaCaT和A431细胞中lncRNA DLX6⁃AS1、miR⁃16⁃5p和NUCKS1 mRNA及蛋白的表达比较(±s)
注:n=9
组别HaCaT细胞A431细胞t值P值lncRNA DLX6⁃AS1 1.00±0.10 2.43±0.24 16.50<0.001 miR⁃16⁃5p 1.05±0.11 0.28±0.03 20.26<0.001 NUCKS1 mRNA 1.04±0.12 3.76±0.38 20.48<0.001 NUCKS1蛋白0.36±0.04 0.89±0.09 16.14<0.001
miR⁃16⁃5p 组A431 细胞miR⁃16⁃5p 表达水平(3.56 ± 0.36)高 于miR⁃NC 组(1.00 ± 0.12,t =20.24,P < 0.05),细胞存活率(65.73% ± 6.58%)低于miR⁃NC 组(100.27% ± 10.05%,t = 8.62,P <0.05);miR⁃16⁃5p 组NUCKS1、Cyclin D1、MMP2 和MMP9 表达水平均低于miR⁃NC 组(均P<0.05,图5A、5B),迁移和侵袭细胞数亦低于miR⁃NC 组(均P<0.05,图5C、5D)。
五、敲低NUCKS1对A431细胞的影响
si⁃NUCKS1组细胞存活率(54.03%±5.40%)低于NUCKS1⁃NC 组(100.10% ± 10.01%,t = 12.15,P < 0.05);si⁃NUCKS1 组细胞中NUCKS1、Cyclin D1、MMP2 和MMP9 表达水平均低于NUCKS1⁃NC组(均P<0.05,图6A、6B),迁移和侵袭细胞数亦低于NUCKS1⁃NC组(均P<0.05,图6C、6D)。
六、低表达lncRNA DLX6⁃AS1 后敲减miR⁃16⁃5p对A431细胞的影响
共转染si⁃DLX6⁃AS1后,anti⁃miR⁃16⁃5p组miR⁃16⁃5p 表达水平(0.34 ± 0.04)低于anti⁃miR⁃NC 组(1.00 ± 0.12,t = 15.65,P < 0.05),细胞存活率(137.33%±13.75%)高于anti⁃miR⁃NC组(100.35%±10.05%,t = 6.51,P < 0.05),anti⁃miR⁃16⁃5p 组Cyclin D1、MMP2 和MMP9 相对表达水平均高于anti⁃miR⁃NC 组(均P < 0.05,图7A、7B),迁移和侵袭细胞数均高于anti⁃miR⁃NC 组(P < 0.05,图7C、7D)。
七、低表达lncRNA DLX6⁃AS1、敲减miR⁃16⁃5p后抑制NUCKS1表达对A431细胞的影响
低表达lncRNA DLX6⁃AS1、敲减miR⁃16⁃5p后,si⁃NUCKS1 组细胞存活率(73.86% ± 7.38%)低于NUCKS1⁃NC 组(137.33% ± 13.75%,t = 12.20,P <0.05);si⁃NUCKS1 组NUCKS1、Cyclin D1、MMP2 和MMP9 蛋白表达量均低于NUCKS1⁃NC 组(P <0.05,图8A、8B),迁移和侵袭细胞数均低于NUCKS1⁃NC组(P<0.05,图8C、8D)。
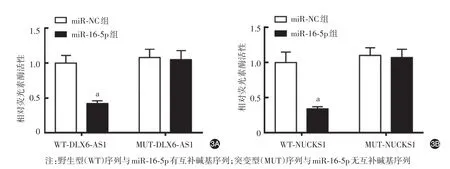
图3 双荧光素酶报告系统验证lncRNA DLX6⁃AS1与miR⁃16⁃5p(3A)及miR⁃16⁃5p与NUCKS1(3B)的靶向结合能力 a:miR⁃NC组与miR⁃16⁃5p组比较,P<0.05
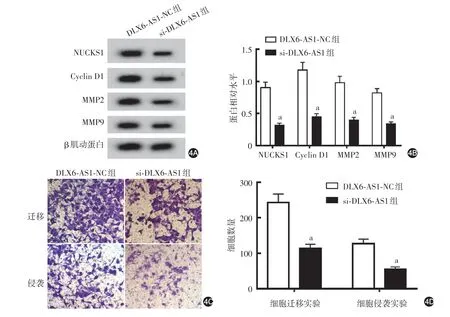
图4 干扰lncRNA DLX6⁃AS1表达对A431细胞的影响 4A、4B:Western印迹检测NUCKS1、Cyclin D1、MMP2和MMP9蛋白相对水平的代表电泳图和统计图;4C、4D:Transwell实验检测细胞迁移和侵袭能力的代表性细胞图和统计图。a:n=9,两组比较,P<0.05。lncRNA DLX6⁃AS1:长链非编码生长停滞特异性蛋白6反义RNA1;NUCKS1:核酪蛋白激酶和细胞周期蛋白依赖性激酶底物1;Cyclin D1:细胞周期蛋白D1;MMP:基质金属蛋白酶
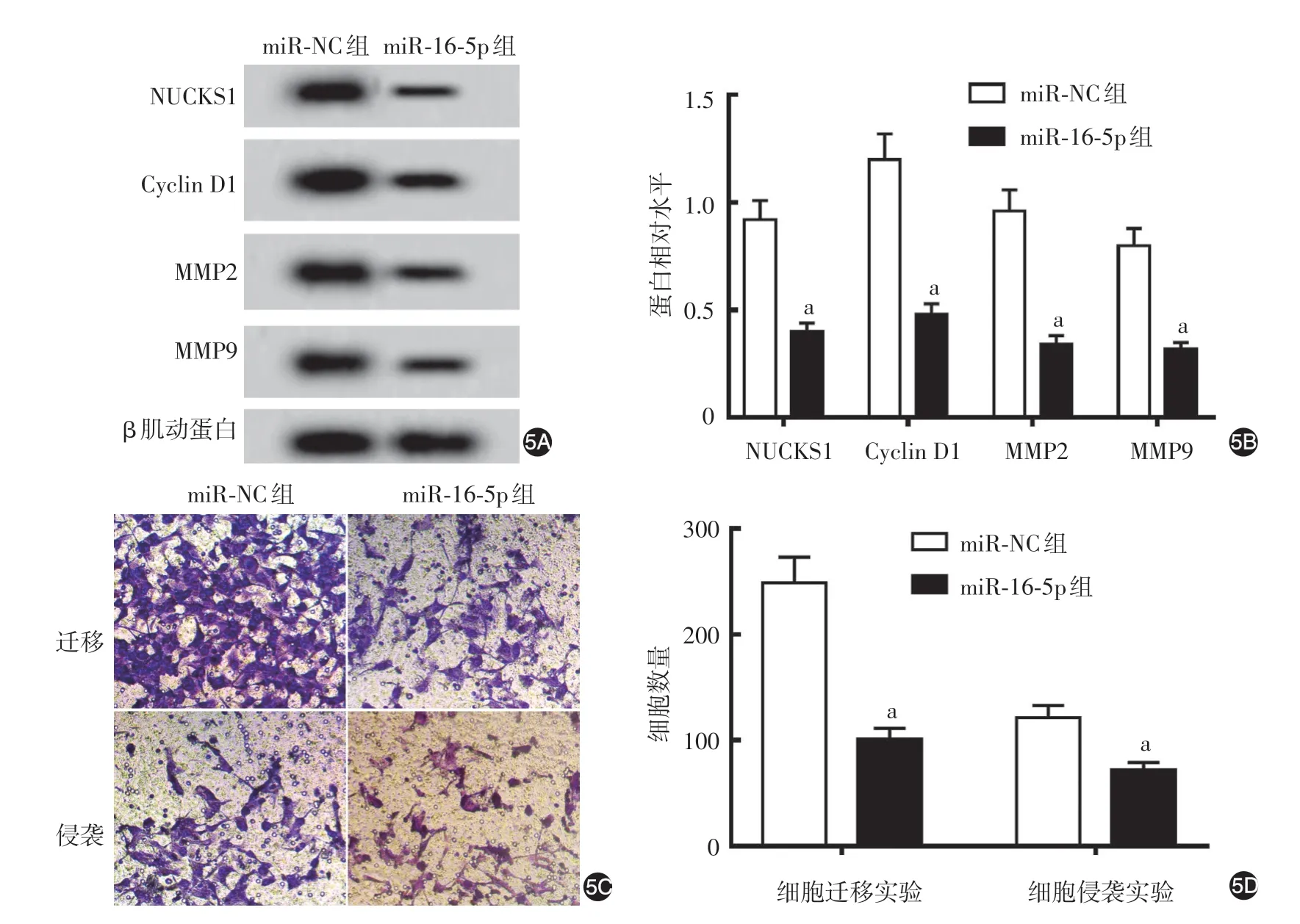
图5 转染miR⁃16⁃5p对A431细胞的影响 5A、5B:Western印迹检测NUCKS1、Cyclin D1、MMP2和MMP9蛋白相对水平的代表电泳图和统计图;5C、5D:Transwell实验检测细胞迁移和侵袭能力的代表性细胞图和统计图。a:n=9,两组比较,P<0.05。NUCKS1:核酪蛋白激酶和细胞周期蛋白依赖性激酶底物1;Cyclin D1:细胞周期蛋白D1;MMP:基质金属蛋白酶
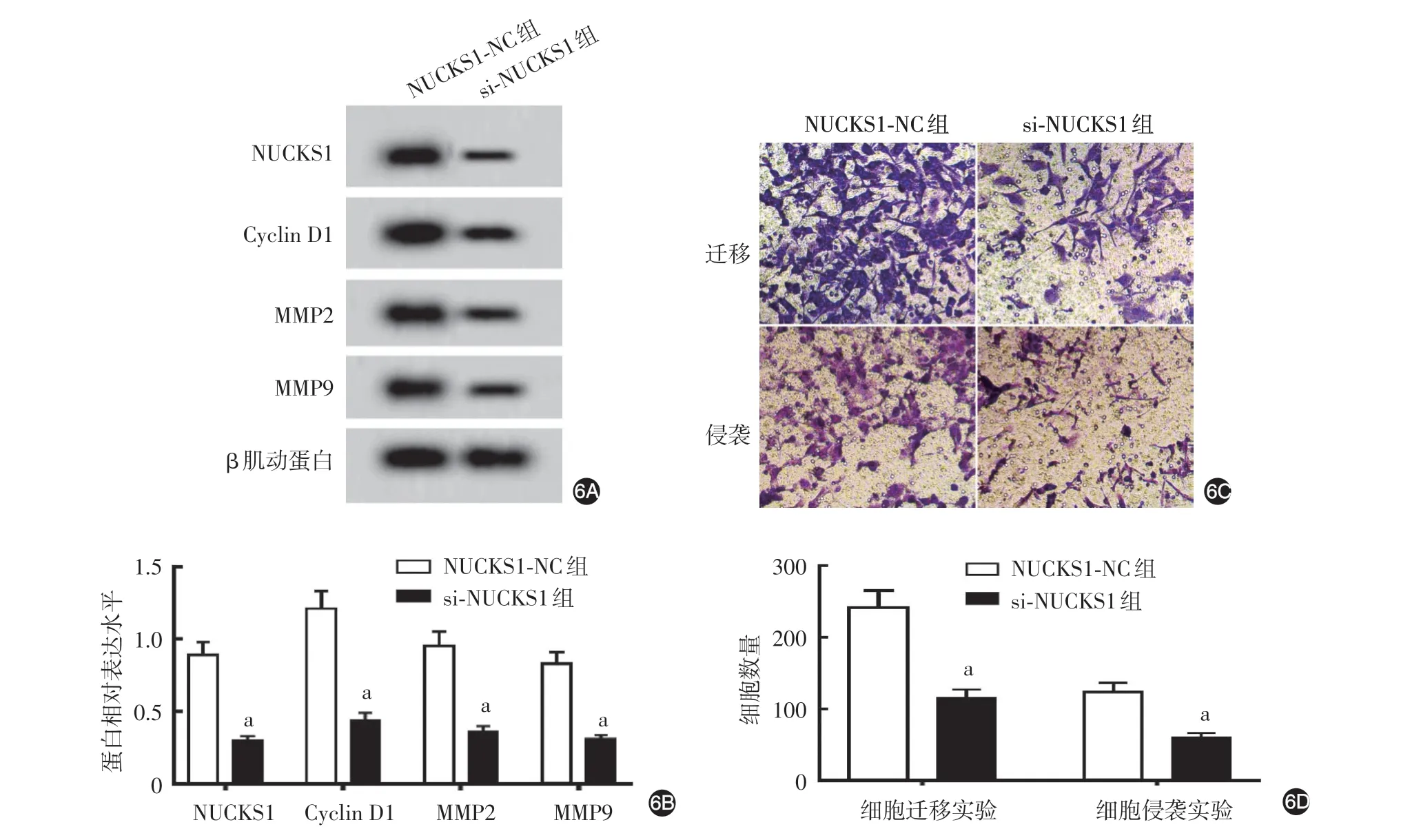
图6 敲低NUCKS1的表达对A431细胞的影响 6A、6B:Western印迹检测NUCKS1、Cyclin D1、MMP2和MMP9蛋白相对水平的代表电泳图和统计图;6C、6D:Transwell实验检测细胞迁移和侵袭能力的代表性细胞图和统计图。a:n=9,两组比较,P<0.05。NUCKS1:核酪蛋白激酶和细胞周期蛋白依赖性激酶底物1;Cyclin D1:细胞周期蛋白D1;MMP:基质金属蛋白酶

图7 低表达lncRNA DLX6⁃AS1后敲减miR⁃16⁃5p对A431细胞的影响 7A、7B:Western印迹检测Cyclin D1、MMP2和MMP9蛋白表达水平的代表电泳图和统计图;7C、7D:Transwell实验检测细胞迁移和侵袭能力的代表性细胞图和统计图。a:n=9,两组比较,P<0.05。lncRNA DLX6⁃AS1:长链非编码生长停滞特异性蛋白6反义RNA1;NUCKS1:核酪蛋白激酶和细胞周期蛋白依赖性激酶底物1;Cyclin D1:细胞周期蛋白D1;MMP:基质金属蛋白酶

图8 低表达lncRNA DLX6⁃AS1、敲减miR⁃16⁃5p 后抑制NUCKS1 表达对A431 的影响 8A、8B:Western 印迹检测NUCKS1、Cyclin D1、MMP2和MMP9蛋白相对表达水平的代表电泳图和统计图;8C、8D:Transwell实验检测细胞迁移和侵袭能力的代表性细胞图和统计图。a:n=9,两组比较,P<0.05。lncRNA DLX6⁃AS1:长链非编码生长停滞特异性蛋白6反义RNA1;NUCKS1:核酪蛋白激酶和细胞周期蛋白依赖性激酶底物1;Cyclin D1:细胞周期蛋白D1;MMP:基质金属蛋白酶
讨 论
以往研究显示,lncRNA DLX6⁃AS1、miR⁃16⁃5p、NUCKS1 在多种癌症中异常表达,可参与癌症的发生、发展,然而其对皮肤鳞癌的影响还不清楚。本研究检测lncRNA DLX6⁃AS1、miR⁃16⁃5p 和NUCKS1 在HaCaT 与A431 细胞中的表达水平,结果显示,lncRNA DLX6⁃AS1、NUCKS1 在A431 细胞中表达上调,而miR⁃16⁃5p下调表达,提示其可能具有相关性。为研究它们之间是否具有相互作用关系,我们通过starBase 预测发现,miR⁃16⁃5p 与lncRNA DLX6⁃AS1以及NUCKS1均有结合位点,推测lncRNA DLX6⁃AS1 可能靶向调控miR⁃16⁃5p,而miR⁃16⁃5p 可能靶向调控NUCKS1,进一步通过双荧光素酶报告实验进行验证,证实了starBase 预测的结合关系。
为进一步研究lncRNA DLX6⁃AS1 对鳞癌细胞生物学行为的影响,我们干扰lncRNA DLX6⁃AS1表达,发现Cyclin D1、MMP2 和MMP9 蛋白表达水平降低,细胞增殖及迁移和侵袭活性降低。Cyclin D1 是细胞周期正调控相关蛋白,其表达水平与细胞增殖呈正相关[11];MMP2 和MMP9 是细胞迁移、侵袭相关蛋白,其表达水平与细胞迁移、侵袭呈正相关[12]。结果提示,低表达lncRNA DLX6⁃AS1 可抑制皮肤鳞癌增殖和转移。既往文献报道在食管鳞癌中lncRNA DLX6⁃AS1 表达上调,敲除lncRNA DLX6⁃AS1可抑制癌细胞的增殖、迁移和侵袭,促进细胞凋亡[13]。本实验结果与既往研究结果相符。
已有研究证实,miR⁃16⁃5p 在脊索瘤[14]、乳腺癌[15]、肝癌[16]等恶性肿瘤中均表达下调,且调控癌细胞的增殖、迁移和侵袭。本研究通过调控miR⁃16⁃5p 的表达探讨其对皮肤鳞癌细胞的影响,过表达miR⁃16⁃5p 后Cyclin D1、MMP2 和MMP9 蛋白表达水平降低,细胞增殖及迁移和侵袭活性降低,提示过表达miR⁃16⁃5p可抑制A431细胞增殖、迁移和侵袭。本研究表明,lncRNA DLX6⁃AS1 靶向调控miR⁃16⁃5p,而敲减miR⁃16⁃5p 的同时低表达lncRNA DLX6⁃AS1,Cyclin D1、MMP2和MMP9蛋白表达水平升高,细胞增殖及迁移和侵袭活性升高,说明敲减miR⁃16⁃5p 逆转了低表达lncRNA DLX6⁃AS1对A431细胞增殖、迁移和侵袭的抑制作用,进一步表明lncRNA DLX6⁃AS1 可能通过靶向负调控miR⁃16⁃5p影响A431细胞增殖、迁移和侵袭。
另外,本研究发现,NUCKS1在A431细胞中高表达,与肝细胞癌[17]、宫颈鳞癌[18]中的表达趋势相同。为研究NUCKS1 对A431 细胞的影响,我们抑制NUCKS1的表达,发现A431细胞的增殖、迁移和侵袭亦受到抑制,说明NUCKS1在皮肤鳞癌细胞的增殖和转移中具有重要作用。进一步实验发现,低表达NUCKS1 可部分逆转敲减miR⁃16⁃5p 和lncRNA DLX6⁃AS1 低表达对A431 细胞增殖、迁移和侵袭的影响,根据以上结果,推测在皮肤鳞癌中lncRNA DLX6⁃AS1通过调控miR⁃16⁃5p/NUCKS1发挥致癌作用。
综上,本研究表明,低表达lncRNA DLX6⁃AS1可通过靶向上调miR⁃16⁃5p进而下调NUCKS1的表达,抑制A431细胞的增殖、迁移和侵袭。本研究的不足之处为只针对皮肤鳞癌细胞A431进行了体外研究,未进行相应的动物实验,后续将进行相应的动物体内实验,为皮肤鳞癌的临床研究提供更多的数据支持。
利益冲突所有作者均声明不存在利益冲突

