高通量测序分析白切鸡菌群多样性
宋相宇,李 鸣,王虎虎,徐幸莲,蔡林林
(南京农业大学 江苏高校肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
白切鸡又叫白斩鸡,属于中国传统酱卤肉制品的一种,具有“爽滑弹嫩”的食用品质,深受消费者喜爱。为了最大限度地保持鸡肉的新鲜口感和风味,白切鸡在加工过程中加热温度低、时间短,甚至很难达到巴氏杀菌的要求,因此白切鸡成品极易腐败变质[1]。包装方式及贮藏温度对白切鸡中的微生物生长繁殖具有极大影响,因此,探明白切鸡贮藏期间的菌群多样性是控制细菌繁殖、延长货架期的基础。
目前绝大多数研究主要集中于包装方式及贮藏温度对生鲜肉中微生物菌群结构及货架期的影响,结果表明不同气调包装方式结合低温贮藏(0~4 ℃)能够有效降低鸡肉[2-3]、羊肉[4-5]、牛肉[6-7]中微生物菌落数,延长产品的货架期。目前常用的菌相分析鉴定手段为微生物传统培养以及聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)分子生物技术相结合的方法[8-9],但是这些方法自身存在很大的局限性,比如自然状态下环境中的大部分微生物都无法通过分离培养而得到,因此经过微生物传统培养方式分析得到的微生物菌相信息单调、不全面,而PCR-DGGE技术虽然相对前者对菌株的鉴定速度更快,但依旧受到结果信息不全面的制约[10]。高通量测序技术不断发展,以16S rDNA特定可变高通量测序最为典型,是近年研究菌群多样性的新手段[11-12]。16S rDNA为编码原核生物核糖体小亚基rRNA的DNA序列,具有10 个保守区域和9 个高变区域(V1~V9),其中保守区在细菌间差异不大,高变区具有属或种的特异性[13]。对16S rDNA某个高变区进行测序,可用于食品微生物菌群结构多样性的快速分析,已成功应用于猪肉[14]、鸡肉[15-16]等生鲜肉品微生物菌群多样性分析,而对于肉制品的研究较少。基于此,本实验以传统酱卤肉制品白切鸡为研究对象,结合Illumina Miseq高通量测序技术分析不同包装及贮藏温度下白切鸡菌群结构及变化规律,为后期靶向抑制其腐败及延长货架期提供理论依据。
1 材料与方法
1.1 材料与试剂
雪山草母鸡整鸡胴体(日龄115 d,净质量约1 kg)购于常州立华大型肉鸡屠宰公司。
DNA提取试剂盒 德国QIAGEN公司;DNA凝胶回收试剂盒 杭州AxyPrep公司;GelRed染料 美国Biotium公司。
1.2 仪器与设备
SMART500气调包装机 西班牙ULMA公司;H P P 2 6 0 恒温恒湿箱、I C P 2 6 0 生化培养箱 德国Memmert公司;WH-2连续点动微型漩涡混合仪 上海沪西分析仪器厂;J2-MI高速冷冻离心机、Microfuge 20R高速冷冻离心机 美国Beckmen公司;9700型PCR仪美国ABI公司;QuantiFluor™-ST蓝色荧光定量系统美国Promega公司。
1.3 方法
1.3.1 样品制备
白切鸡制作工艺:原料生鲜鸡→沸腾卤水中浸提(3 次,2~3 s/次)→冰水冲洗→浸煮(95 ℃)→冰水冷浸→包装→成品鸡,将熟制后的白切鸡样品置于聚乙烯托盘中,采用空气托盘(AP)、100% N2气调(MN)和30% CO2+70% N2气调(MC)3 种方式包装,分别置于(4.0±0.1)℃(冷鲜温度)、(12.0±0.1)℃(市场低温货柜实际温度)下贮藏。取生鲜鸡、新鲜白切鸡(贮藏0 d)和各处理组在贮藏中期及末期时的样品各3 盒测定相关指标,具体取样时间及样品编号见表1。

表 1 样品处理方式及取样时间Table 1 Sample processing methods and sampling times
1.3.2 菌体的收集
采用洗脱法[17]收集样品中的微生物,并加以改进。在无菌环境中打开样品,迅速放入装有约200 mL生理盐水(氯化钠质量浓度0.85 g/100 mL)的均质袋中,密封后双手充分揉捏约10 min使鸡肉捏碎、鸡骨揉断。随后将均质袋中的样品-洗涤液混合物置于拍打式均质机中,选择第2力度(6 次/s)拍打30 s,进行4 次,使样品得到充分洗涤均质。样品-洗涤液混合物经无菌滤纸简单过滤后,将滤液倒入无菌离心管中,4 ℃、2 000 r/min离心5 min,取上清液于新离心管中在4 ℃下12 000 r/min离心5 min,去除上清液,将沉淀富集并于-20 ℃保存备用。
1.3.3 总DNA的提取
采用DNA快速提取试剂盒按产品说明书进行对所有样品进行DNA抽提,并用质量分数1%琼脂糖凝胶电泳检测提取效果。
1.3.4 PCR扩增及高通量测序
按指定测序区域(16S rDNA V3~V4区),合成带有barcode的特异引物。每个样本3 个重复,将同一样本的PCR产物混合后用质量分数2%琼脂糖凝胶电泳检测,使用DNA凝胶回收试剂盒切胶回收PCR产物。使用QuantiFluor™-ST蓝色荧光定量系统对PCR产物进行荧光定量,并进行相应比例的混合。构建Illumina PE250文库后上机由上海灵恩生物科技有限公司进行高通量测序。
1.3.5 生物学信息分析
首先将利用Illumina PE250平台测序得到的PE reads根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行可操作分类单元(operational taxonomic units,OTU)聚类分析和物种分类学分析,基于OTU可以进行物种多样性指数分析,以及对测序深度的检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计分析。
1.4 数据处理与分析
所有实验重复4 次。所得数据用Excel软件和SAS V8.02软件进行统计。采用OriginPro 8软件作图,采用SPSS 9.0软件对数据进行相关性分析,采用EZinfo 3.0软件进行主坐标分析。
2 结果与分析
2.1 样品Alpha多样性分析结果
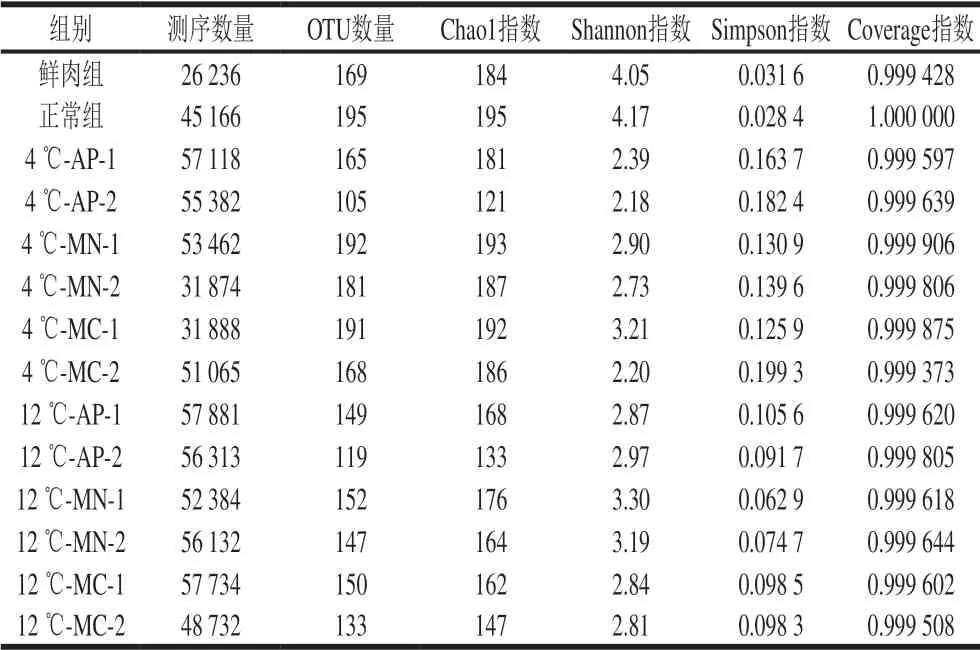
表 2 白切鸡微生物菌群Alpha多样性分析Table 2 Alpha diversity analysis of microbial flora in soft-boiled chicken
根据97%相似性水平下的OTU信息,采用Alpha多样性指标的Chao1、Shannon及Simpson指数对样品微生物物种丰富度和均匀度进行评估[18]。群落丰富度用Chao1指数描述,其值越高表明群落物种的丰富度越高,而Shannon指数和Simpson指数可以反映样品的群落多样性程度,Shannon指数越高、Simpson指数越低,表明群落物种的多样性越高。由表2可以看出,所有样品的OTU覆盖率(Coverage指数)都达99.9%以上,说明本次实验所建立的文库可以比较真实、有效地反映样本微生物的多样性。从所有样本测序结果抽取的OTU数量中,最多的为195,最少的为105,样品包装处理后得到的OTU数量较正常组样本减少,说明包装处理能有效降低样本中的微生物种类。但所有样本之间的细菌菌群多样性较为相似,OTU数量相差不大。其中,正常组样本Chao1指数均大于其他样本,说明正常组样本的菌群丰度最高,而4 ℃-AP-2样本的丰度最低;正常组样本Shannon指数高于其他样本,且Simpson指数低于其他样本,说明其菌群多样性最高。Shannon-Wiener曲线[19]可以反映各样本在不同测序数量时的微生物多样性,当曲线趋向平坦时,说明测序数据量足够大,可以反映样品中绝大多数的微生物信息。本实验所有样本的曲线都随着横坐标的延长而逐渐稳定,说明测序数据量合理,所含菌种数较多。
2.2 Beta多样性分析结果
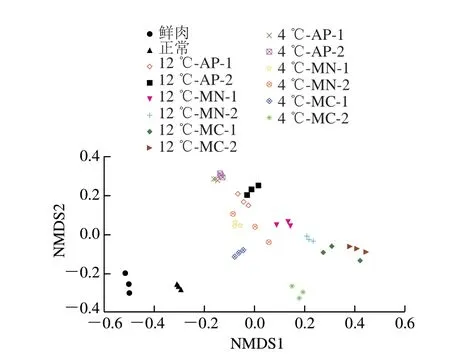
图 1 白切鸡微生物菌群NMDS分析图Fig. 1 NMDS analysis of microbial flora in soft-boiled chicken
Beta多样性主要分析了样本与样本间微生物群落组成的相似性[20]。非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析法是评估Beta多样性的方式之一,它以点的形式将样本包含的物种信息反映在多维空间上,通过点与点之间的距离体现样本间的差异程度[21]。由图1可以看出,每组内各个样品点分布区域比较密集,样品个体差异性较小,每组内3 个样品微生物群落结构相似,平行性较好。4 ℃下贮藏,除MN-2处理组中3 个点所形成的圆形面积略大,其余各组所形成的圆形面积小,说明样品平行性好。包装方式与贮藏温度变化时,各组圆圈交集较少,群落组成出现差距,此时不同处理发挥了作用,对白切鸡菌群群落结构产生影响,使实验组与对照组区分明显。
2.3 物种组成分析结果
2.3.1 基于门分类水平的分析结果
经物种组成分析可得知一个或多个样本在各分类水平上比对情况。采用统计学的分析方法,能观测样本在门、纲、目、科、属的群落结构[18]。实验共得到2 216 类OTU,且这些OTU都属于细菌域,包括5 个门、40 个属,本实验重点分析了门和属水平。
由图2 可知,各组样本生成的OT U 主要由4 个门构成:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria),其中变形菌门和厚壁菌门在42 个样品中占主导地位。鲜肉组和正常组两种优势菌门分别占细菌总序列的88.50%和92.00%,4 ℃下AP组、MN组和MC组的占比(所有时间的平均值,下同)分别为99.85%、98.65%和96.70%,12 ℃下3 个处理组的占比更达到了99.9%,所有组别在两个温度下的变形菌门和厚壁菌门丰度之和平均占96.93%,说明包装处理有效降低了白切鸡中菌群的多样性。此外,处理组样本中嗜热菌门(Thermophila)丰度极低,可能与贮藏温度较低有关。

图 2 白切鸡微生物菌群门水平物种组成分析柱状图Fig. 2 Histogram obtained from microbial floral composition analysis of soft-boiled chicken at the phylum level

图 3 白切鸡微生物菌群属水平物种组成分析柱状图Fig. 3 Histogram obtained from microbial floral composition analysis of soft-boiled chicken at the genus level
2.3.2 基于属分类水平的分析结果
包装方式及贮藏温度对白切鸡属水平菌群组成的影响结果如图3所示。为方便分析,选取丰度排名在前50的属进行聚类,以便发现部分物种在不同样品中的聚集信息。由图4可知,假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、链球菌属(Streptococcus)、嗜冷菌属(Psychrophila)和乳杆菌属(Lactobacillus)等为鲜肉组中相对丰度较高的菌属。AP组贮藏末期,尤其是4 ℃-AP-2处理组,样品中的菌相较为单调,假单胞菌属成为绝对优势腐败菌,其与环丝菌属(Brochothrix)等共同抑制了其他非优势菌的生长。而含30% CO2的气调包装处理组在贮藏末期的菌相对较复杂,假单胞菌属不再是绝对优势腐败菌,造成CO2气调包装处理组样品腐败的主要优势菌属包括环丝菌属、沙雷菌属(Serratia)和肉杆菌属(Carnobacterium)等,同时嗜酸菌乳球菌属(Lactococcus)和乳杆菌属的相对丰度也比托盘包装处理组更高。

图 4 白切鸡微生物菌群属水平热图Fig. 4 Heatmap obtained from microbial floral composition analysis of soft-boiled chicken at the genus level
包装方式及贮藏温度会影响白切鸡菌群属水平上的组成。原料鸡和新鲜白切鸡两个处理组中样品的微生物种类及相对丰度比较相似。所有托盘包装中样品的假单胞菌属都是相对丰度最大的菌属,尤其在4 ℃下贮藏时,12 ℃下AP组较4 ℃不动杆菌属相对丰度更高。在MN及MC气调包装中,微生物的相对丰度则明显与AP处理组不同,假单胞菌属不再是绝对的优势菌属,尤其在MC处理组,假单胞菌属的相对丰度在贮藏末期不足10%。此外,在MC及MN气调包装中,环丝菌属及沙雷菌属为主要的优势菌属,12 ℃条件同4 ℃条件相比,前者中肠杆菌属(Enterobacteriaceae)相对丰度约为15%,而后者中肠杆菌属也是其低丰度优势菌群之一,12 ℃下MC及MN处理组中优势腐败菌还包括克吕沃尔菌属(Kluyvera),而4 ℃条件下该包装样品中的优势腐败菌为肉杆菌属,说明贮藏温度同样显著影响着贮藏末期白切鸡中的微生物组成。
2.4 物种主坐标分析结果

图 5 不同包装及贮藏条件下白切鸡的微生物群落结构比较Fig. 5 Comparison of microbial community structures of soft-boiled chicken under different packaging and storage conditions
主坐标分析(principal co-ordinates analysis,PCoA)是一种非约束性的数据降维分析方法,用来研究样本群落组成的相似性或差异性[22]。图中点的距离越近表示菌群结构越相似。由图5可知,PC1为46.86%,PC2为32.46%,PC1与PC2的综合差异能够解释全部结果的81.00%,可以用来解释组间差异。从图5可以看出,同一处理组不同平行的点比较聚集,说明样品测序结果的重复性较好。鲜肉组及正常组无论是在PC1还是PC2上的投影都能够同其他处理组显著区分开。此外,不同包装、不同贮藏温度样品在贮藏中期及末期所含物种的主成分逐渐分开,在不同象限聚集,说明不同处理组样品的菌群结构随着贮藏时间延长逐渐表现出差异。AP组的样品在PC1上能同绝大多数气调包装的样品显著区分,并且在4 ℃贮藏中期及末期样品重复的间聚集性很高,表明该两组样品中出现了优势菌群,并且抑制了其他菌的生长。MN和MC气调包装的样品在不同温度下贮藏中期及末期的菌种差异同样主要体现在PC1上,但同一气调包装不同处理、不同阶段间的物种变化趋势无明显规律。
3 讨 论
微生物是影响白切鸡品质和食用安全性的主要因素,而包装方式和贮藏温度对微生物的种类及数量有极大影响。因此,通过分析不同包装及贮藏温度下白切鸡的菌群结构,从而为企业生产和消费者提供指导是非常有必要的。
不同处理组菌群之间差异较大,尤其在属水平上。原料生鲜鸡以及新鲜白切鸡处理组中样品的微生物种类和相对丰度比较相似,可见白切鸡中的微生物主要来源于原料鸡,并且加工工艺限制、原料鸡清洗不完善等原因,使得白切鸡所含微生物的种类十分繁杂[23]。12 ℃ AP组中不动杆菌属丰度较4 ℃处理组高,不动杆菌属是严格的需氧非发酵革兰氏阴性球菌[24],黏附性极强,是鸡胴体天然携带的微生物。Carvalheira等[25]从超市购买的鸡肉中提取出不动杆菌,并对其流行情况进行了研究,发现该菌并非嗜冷菌,因此可能在12 ℃下更有利于不动杆菌属的生长。而在MN及MC气调包装中,假单胞菌属不再是绝对的优势菌属,尤其是MC处理组。假单胞菌是有氧贮存和气调包装冷鲜肉中常见的腐败微生物[26-27],其含有复杂丰富的酶系统比如蛋白分解酶和耐热酶,所以其适应性和致腐能力较强,即使在低温条件下也能生长繁殖。Andreani等[28]报道有氧环境和富含蛋白的食品能加速假单胞菌属的生长繁殖,从而加速食品的腐败,同时,在禽肉及加工肉制品中假单胞菌属主要包括草莓假单胞菌(Pseudomonas fragi)、隆德假单胞菌(Pseudomonas lundensis)和荧光假单胞菌(Pseudomonas fluorescens)3 种,其中草莓假单胞菌从肉中分离出的比例最高,为56.7%~79.0%[29]。还有研究表明,无氧环境中较高的CO2浓度在8 ℃几乎完全抑制荧光假单胞菌的生长[30]。因此,MC气调包装中,在缺氧和CO2抑菌作用的双重作用下,假单胞菌属的生长繁殖得到了很好的抑制。在MC气调包装中,环丝菌属及沙雷菌属为主要的优势菌属,有研究报道,沙雷菌属及环丝菌属不论在有氧还是无氧条件下都能够生长繁殖[31-33],无氧包装对其抑制效果不为明显,其中热杀索丝菌(Brochothrix thermosphacta)也是原料肉中主要的一种污染菌,具有很强分解蛋白和脂肪的能力[34],在猪肉、牛肉、羊肉及腌制肉中均存在[35]。周富裕[36]研究表明,环丝菌属是气调包装酱卤肉制品中的主要腐败菌之一,与本实验结果相似。12 ℃下MC处理组中优势腐败菌还包括肠杆菌属和克吕沃尔菌属,唐雪婷等[37]研究表明,低温对接种的肠杆菌科生长有明显的抑制作用。
4 ℃下MC气调包装末期处理组样品腐败的优势菌属还包括肉杆菌属,该菌属能够分解糖类产生乳酸,降低环境pH值,使得乳球菌属和乳杆菌属的相对丰度也较托盘包装处理组更高。乳球菌属和乳杆菌属具有较强的耐酸能力[38],大部分的乳球菌和乳杆菌在缺氧的环境下能够生长繁殖,而在托盘包装中可能会因受到其他菌群的制约无法大量繁殖,因此乳球菌属和乳杆菌属往往也会成为缺氧条件下禽肉制品的一种优势腐败菌。
4 结 论
采用Illumina MiSeq高通量测序技术分析了包装方式及贮藏温度对白切鸡中微生物菌群结构的影响,发现不同处理对样品的微生物多样性产生了较大影响。托盘包装中,不论在12 ℃还是4 ℃下优势菌属均为假单胞菌属;MC处理组4 ℃贮藏末期优势菌属包括肉杆菌属,表明低温贮藏的白切鸡存在一定的致病风险;MC包装在4 ℃下贮藏能够有效减少白切鸡微生物菌群的多样性。

