木犀草素及其黄酮苷的抗炎、抗氧化作用
王 伟,何 平,江小明
(武汉食品化妆品检验所,湖北 武汉 430012)
木犀草素(luteolin,lut)是一类典型C6-C3-C6结构的黄酮类化合物,广泛存在于抗炎植物原料中[1-6]。木犀草素通常以黄酮苷形式存在,如黄酮氧苷结构的木犀草苷(cynaroside,cyn)[2-4],以及黄酮碳苷结构的荭草素(orientin,ori)[7]与异荭草素(homoorientin,homo)[8]。木犀草素及其黄酮苷具有广泛生理活性,如抗炎[2,9]、抗氧化[10]、抗肿瘤[11]、抑制肥胖[12]、缓解II型糖尿病[12]等。而抗炎、抗氧化活性是黄酮类化合物发挥抗肿瘤、抑制肥胖、II型糖尿病等生理活性的基础[13]。
黄酮类化合物发挥抗炎活性的主要场所在免疫细胞(其中主要是巨噬细胞),黄酮类化合物对巨噬细胞炎性反应的抑制活性可通过抑制核转录因子κB(nuclear factor κB,NF-κB)信号通路实现[14]。黄酮类化合物在不同水平抑制NF-κB信号通路下调炎症介质的产生。Hamalainen等[15]研究NO/诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和NF-κB抑制的相关性发现,在巨噬细胞模型中类黄酮在减少iNOS产生的同时也抑制了NF-κB蛋白家族的转录活性;槲皮素[16]、白藜芦醇[17]、甘草素[18]、漆黄素[19]、木犀草素[20]等在相似的作用浓度下对NF-κB信号通路上游关键调控蛋白κB抑制因子α亚基(α inhibitor of κB,IκBα)具有相似的抑制活性;桑色素[21]、漆黄素[22]均可通过抑制NF-κB信号通路经典途径的直接上游靶点IκB激酶β亚基(IκB kinase β,IKKβ)从而抑制IKK对IκB的激活作用,进而抑制NF-κB信号通路。
另一方面,Kelch样ECH相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)/核因子E2相关性因子2(nuclear factor erythroid 2 related factor 2,Nrf2)信号通路是迄今发现最重要的黄酮类化合物抗氧化信号通路[23-24]。黄酮类化合物主要通过该信号通路降低细胞氧化应激水平发挥抗氧化活性。其通过促使Keap1-Nrf2解偶联,促进Nrf2解离并发生核移位与抗氧化反应元件(antioxidant response element,ARE)结合,调控一系列抗氧化物质如谷胱甘肽血红素氧合酶(heme oxygenase-1,HO-1)、还原型辅酶II醌氧化还原酶(nicotinamide adenine dinucleotide phosphat quinone oxidoreductase 1,NQO1)等表达,进而发挥抗氧化作用[25-26]。这是低利用率的黄酮类化合物可在机体内发挥高抗氧化活性的重要原因。
研究表明木犀草素及其黄酮苷具有较好的抗炎和抗氧化活性,然而,木犀草素及其黄酮苷能否在发挥抗炎活性的同时发挥抗氧化活性,其抗炎、抗氧化活性的两条主要信号通路之间是否存在交叉作用尚鲜见报道。因此,本实验基于人源巨噬细胞THP-1,从分子水平探究木犀草素及其黄酮苷抑制NF-κB信号通路而发挥的抗炎作用,及对Nrf2转录活性的激活作用,解析木犀草素及其黄酮苷的抗炎作用、抗氧化活性及作用机制,为开发天然来源的抗炎、抗氧化活性成分提供依据,为木犀草素作为天然抗氧化剂的拓展应用提供指导。
1 材料与方法
1.1 材料与试剂
THP-1单核巨噬细胞 上海细胞库;木犀草素上海阿拉丁生化科技股份有限公司;木犀草苷、荭草素、异荭草素(均为色谱级,纯度≥98%) 上海源叶生物科技有限公司;NF-κB抑制剂BAY 11-7082 美国MCE公司;RPMI培养基 美国HyClone公司;胎牛血清 澳大利亚AusGeneX公司;青链霉素溶液(100×)杭州吉诺生物医药技术有限公司; 噻唑蓝(methyl thiazolyl tetrazolium,MTT)、脂多糖(lipopolysaccharide,LPS)、豆蔻佛波醇乙酯(phorbol 12-myristate13-acetate,PMA)、β-巯基乙醇 美国Sigma公司;高纯总RNA提取试剂盒 北京艾德莱生物科技有限公司;浆蛋白与核蛋白提取试剂盒、Western Blot分析试剂 美国AspenTech公司;PrimeScriptTMreagent Kit with gDNA Eraser反转录试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)SYBR Premix ExTaqTMII荧光定量试剂盒 日本TaKaRa公司;肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-1β酶联免疫吸附检测试剂盒北京欣博盛生物科技有限公司;所有分析用有机溶剂均为国产分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
Multifuge X1R高速冷冻离心机、全波长读数仪美国Thermo Fisher Scientific公司;ECLIPSE TS100倒置显微镜 日本尼康公司;SW-CJ-1FD超净操作台 苏州安泰空气技术有限公司;N60超微量分光光度计 德国Implen公司;DW-86L626超低温冰箱 青岛海尔集团公司;24 孔细胞培养板、细胞刮刀、细胞冻存管 美国Corning公司;25 cm2及75 cm2细胞培养瓶 德国Greiner公司;Biospectrometer紫外分光光度计 德国Eppendorf公司;MG96G PCR仪 杭州朗基科学仪器有限公司;ChemiDoc MP凝胶成像系统 美国Bio Legend公司;qTOWER2.2荧光定量PCR仪 德国Analytik Jena公司;DYY-8C凝胶电泳仪、DYY-6C电泳仪、DYCZ-400D转移电泳仪槽、DYCZ-24DN垂直电泳槽、WD-9405A脱色摇床 北京市六一仪器厂;T GL-16c 台式离心机上海安亭科学仪器厂;TGL-16冷冻离心机 湖南湘仪实验室仪器开发有限公司;IMS-20制冰机 常熟市雪科电器有限公司;HH-W-600水浴锅 金坛市江南仪器厂;AX-II暗匣 广东粤华医疗器械厂有限公司;LiDE110 DYY-6C扫描仪 日本Canon公司;0.45 μm聚偏氟乙烯膜 美国Millipore公司;医用X射线胶片美国Kodak公司。
1.3 方法
1.3.1 细胞培养
细胞培养方法参考Lund等[27]的方法并略作调整。THP-1单核巨噬细胞以RPMI完全培养基培养,培养基由10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、0.1 μmol/L的β-巯基乙醇组成,细胞于5% CO2、相对湿度90%、37 ℃ CO2恒温培养箱培养,每24 h于倒置显微镜下观察,当密度达到70%~80%左右时进行分瓶传代。
1.3.2 MTT实验
采用MTT法[19]测定黄酮类化合物对THP-1单核巨噬细胞的毒性作用。
稀释细胞悬液,加入PMA试剂(0.1 μmol/L),接种100 μL细胞到96 板中,使其将密度为3×104个/孔,同时留一列不接种细胞(设为空白组1),细胞培养板放入CO2培养箱中使之贴壁。12 h后小心吸去上清液,以温热的磷酸盐缓冲液(phosphate buffered saline,PBS)轻轻清洗细胞,弃去PBS,加入新鲜RPMI完全培养基,静息24 h。
小心吸去静息24 h的细胞上清液,加入新的培养液,培养液分为样品组:含10%胎牛血清的RPMI完全培养基培养细胞,培养液中轻轻加入5 μmol/L黄酮类化合物溶液(lut、cyn、ori、homo)或10 μmol/L NF-κB抑制剂Bay-11-7082(Bay组,阳性对照);CK组:含10%胎牛血清的RPMI完全培养基培养细胞,培养液不加黄酮类化合物溶液;空白组2:不含胎牛血清的RPMI完全培养基培养细胞,培养液不加黄酮类化合物溶液。处理后的细胞板放入CO2培养箱中培养24 h,样品组与空白组均设8 个平行。
小心吸去细胞培养板内上清液,轻轻加入配制好的MTT溶液(质量浓度为0.5 mg/mL),放入CO2培养箱中避光孵育3~4 h。小心吸去细胞培养板中MTT溶液,以150 μL二甲亚砜溶解细胞中甲瓒结晶,于37 ℃振荡孵育10 min,在酶标仪上读取490 nm波长处吸光度,按下式计算细胞存活率。

式中:AT为样品组在490 nm波长处的吸光度;AN为空白组1在490 nm波长处的吸光度;AC为空白组2在490 nm波长处的吸光度。
1.3.3 酶联免疫吸附测定法检测TNF-α、IL-6、IL-1β水平
稀释细胞悬液,接种2 mL细胞到12 孔板中,使其密度为5×106个/孔,待细胞覆盖孔板底部80%~90%时,加入PMA试剂(终浓度为0.1 μmol/L),放入CO2培养箱中使之贴壁。培养12 h后小心吸去上清液,以温热的PBS轻轻清洗细胞,去PBS,加入新鲜RPMI完全培养基,静息24 h。
以不含血清的RPMI培养液稀释黄酮类化合物母液,使其终浓度为5 μmol/L,小心吸去细胞培养板上清液,加入新的培养液,培养液分为样品组(分组及处理方式同1.3.2节);LPS组:含10%胎牛血清的RPMI完全培养基培养细胞,培养液不加黄酮类化合物溶液;CK组:含10%胎牛血清的RPMI完全培养基培养细胞,培养液不加黄酮类化合物溶液和LPS。处理后的细胞培养板放入CO2培养箱中培养,3 h后取出12 孔板,样品组和LPS组加入LPS(LPS终质量浓度为1 μg/mL),CK组不加LPS,将12 孔板放回细胞培养箱,培养12 h。收集细胞上清液,采用酶联免疫吸附检测试剂盒测定细胞上清液中TNF-α、IL-6、L-1β水平。
1.3.4 荧光定量PCR法检测TNF-α、IL-6、IL-1βmRNA的含量
采用荧光定量PCR法[28]相对定量细胞中TNF-α、IL-6、IL-1βmRNA。稀释细胞悬液,接种2 mL细胞到12 孔板中,使其密度为5×106个/孔,待细胞覆盖孔板底部80%~90%时,加入PMA试剂(终浓度为0.1 μmol/L),放入CO2培养箱中使之贴壁。培养12 h后小心吸去上清液,以温热的PBS轻轻清洗细胞,弃去PBS,加入新鲜RPMI完全培养基,静息24 h。
以不含血清的RPMI培养液稀释黄酮类化合物母液,使其终浓度为5 μmol/L,小心吸去细胞培养板上清液,细胞处理同1.3.3节。以TRIzol试剂裂解细胞收集细胞样品。采用荧光定量PCR法测定各处理组细胞中TNF-α、IL-6、IL-1βmRNA水平。
样品中RNA提取、反转录、定量方法分别按试剂盒说明书操作。各指标引物信息见表1。

表 1 荧光定量PCR引物信息Table 1 Primer sequences used for quantitative PCR
1.3.5 Western Blot法检测NF-κB信号通路关键蛋白相对含量
1.3.5.1 Western Blot法检测P-IκBα、P-IKKβ相对含量
稀释细胞悬液,接种2 mL细胞到6 孔板中,使其密度为1×107个/孔,待细胞覆盖孔板底部80%~90%时,加入PMA试剂(终浓度为0.1 μmol/L),放入CO2培养箱中使之贴壁。培养12 h后小心吸去上清液,以温热的PBS轻轻清洗细胞,去PBS,加入新鲜RPMI完全培养基,静息24 h。
以不含血清的RPMI培养液稀释黄酮类化合物母液,使其终浓度为5 μmol/L,小心吸去细胞培养板上清液,分别加4 种黄酮类化合物溶液或10 μmol/L NF-κB抑制剂Bay;保留部分孔板不加黄酮类化合物,设置为CK组和LPS组,放入CO2培养箱中培养。3 h后取出细胞培养板,样品组和LPS组加入LPS(LPS终质量浓度为1 μg/mL),CK组不加LPS,将细胞培养板放回细胞培养箱,培养30 min。以RPMI裂解液裂解细胞收集细胞总蛋白样品,并采用Western Blot法测定总蛋白中P-IκBα、P-IKKβ含量[29]。分析抑制剂和黄酮类化合物对LPS刺激下THP-1单核巨噬细胞中P-IκBα和P-IKKβ影响,以CK组对含量记为0.000,LPS组对含量记为1.000。
1.3.5.2 Western Blot法检测P65蛋白相对含量
稀释细胞悬液,接种5 mL细胞到直径6 cm的细胞培养皿中,使其将密度为5×106个/孔,待细胞覆盖孔板底部80%~90%时,加入PMA试剂(终浓度为0.1 μmol/L),放入CO2培养箱中使之贴壁。培养12 h后小心吸去上清液,以温热的PBS轻轻清洗细胞,弃去PBS,加入新鲜RPMI完全培养基,静息24 h。
以不含血清的RPMI培养液稀释黄酮类化合物母液,使其终浓度为5 μmol/L,小心吸去细胞培养板上清液,细胞处理同1.3.5.1节。按试剂盒说明分别收集提取细胞质与细胞核蛋白样品,采用Western Blot法测定样品中P65相对含量[29]。
1.3.6 Western Blot法检测Nrf2、HO-1蛋白相对含量
细胞处理同1.3.5.2节,按试剂盒说明分别收集提取细胞质与细胞核蛋白样品,采用Western Blot法测定蛋白中Nrf2、HO-1相对含量[29]。
1.4 数据处理与分析
实验结果表示为平均值±标准差,采用SAS 8.0软件最小显著差法进行多重比较,分析数据显著性差异,P<0.05表明差异显著,P<0.01表明差异极显著。
2 结果与分析
2.1 黄酮类化合物对TPH-1单核巨噬细胞的毒性作用

表 2 5μmol/L黄酮类化合物对THP-1单核巨噬细胞的毒性作用Table 2 Toxicity of 5μmol/L flavonoids on THP-1 macrophages
由表2可知,在作用浓度下,与CK组对比,5 μmol/L的黄酮类化合物对THP-1单核巨噬细胞无细胞毒性作用(P>0.05)。Bay-11-7082是NF-κB抑制剂,其推荐使用浓度为10 μmol/L左右,因此,实验时,对10 μmol/L的Bay抑制剂细胞毒性进行评价,10 μmol/L的Bay抑制剂对THP-1单核巨噬细胞无细胞毒害作用。
2.2 黄酮类化合物对THP-1单核巨噬细胞炎性模型细胞因子IL-6、IL-1β、TNF-α水平的影响
TNF-α是一种细胞因子,本质上是一种信号蛋白,参与调控机体的炎症反应,也是炎性反应早起的主要细胞因子之一,主要由单核巨噬细胞受到炎性刺激后产生,LPS是诱导TNF-α产生的较强刺激剂[30]。当THP-1被诱导形成单核巨噬细胞后经LPS刺激,细胞内TNF-α含量显著提高,TNF-α是判断炎性发生的重要炎症因子之一[31]。
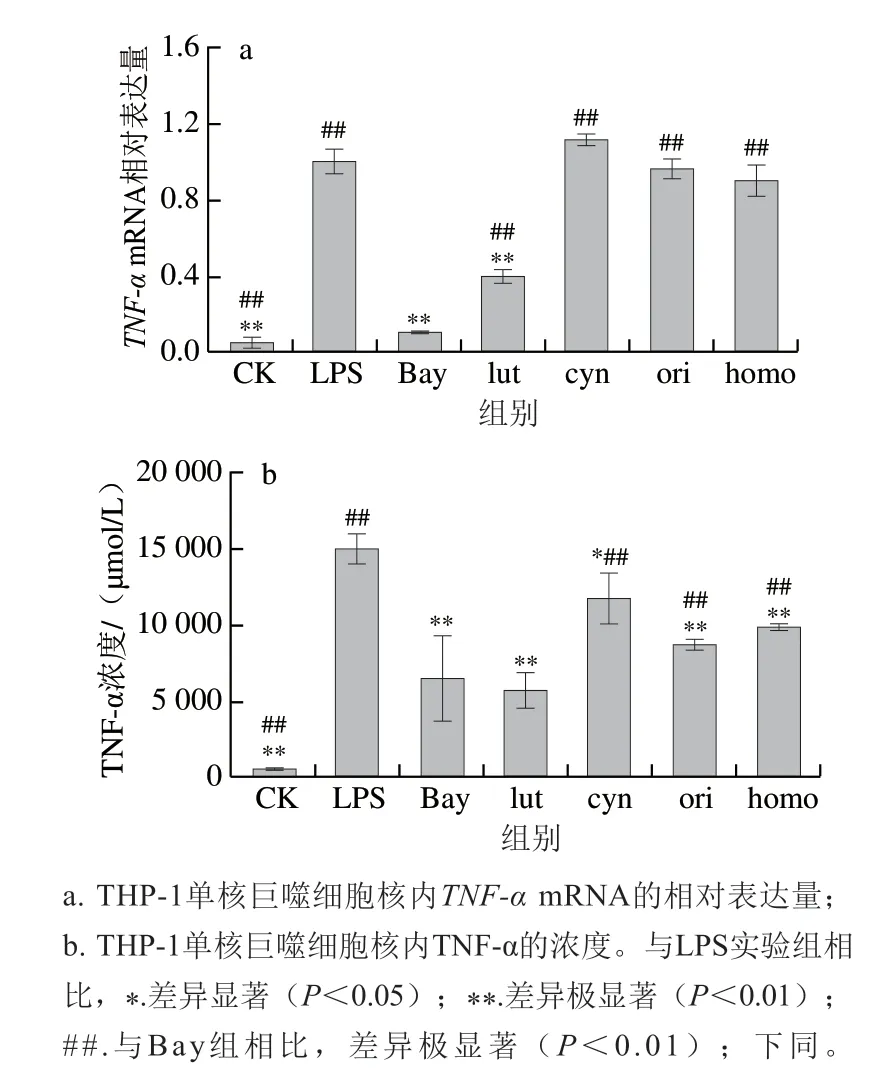
图 1 4 种黄酮类化合物对LPS刺激下THP-1单核巨噬细胞中TNF-α的影响Fig. 1 TNF-α contents of THP-1 macrophages pretreated with 4 flavonoids before being stimulated with LPS
在本实验中,经过LPS刺激后,THP-1单核巨噬细胞内TNF-αmRNA(图1a)和上清液中TNF-α(图1b)的含量极显著上升(P<0.01)。与LPS刺激组相比,木犀草素及NF-κB抑制剂Bay均可显著降低细胞内TNF-αmRNA和上清液中TNF-α的表达,同Bay抑制剂类似,木犀草素可通过抑制NF-κB信号通路发挥抗炎活性,且5 μmol/L的木犀草素对TNF-α的抑制作用与10 μmol/L抑制剂Bay的抑制作用相当(P>0.05)。木犀草苷、荭草素、异荭草素均可显著降低细胞中上清液中TNF-α的表达(图1b)(P<0.05,P<0.01)。
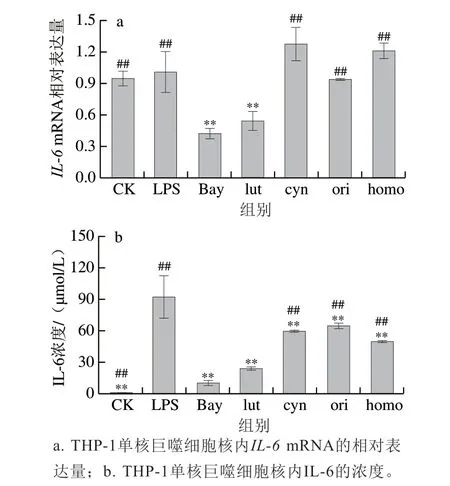
图 2 4 种黄酮类化合物对LPS刺激下THP-1单核巨噬细胞中IL-6的影响Fig. 2 IL-6 contents of THP-1 macrophages pretreated with 4 flavonoids before being stimulated with LPS
NF-κB信号通路激活后,NF-κB蛋白家族迅速进入细胞核打开各种κB依赖性基因的表达,如IL-6和IL-1β,同时IL-6和IL-1β可以反馈调控NF-κB。
IL-6是一种多效性的促炎因子。如图2所示,经过LPS刺激后,THP-1单核巨噬细胞上清液中IL-6浓度极显著上升(P<0.01),木犀草素和Bay均可极显著抑制细胞内IL-6mRNA和上清液中IL-6的表达(P<0.01),且木犀草素对IL-6的抑制作用与抑制剂Bay相当(P>0.05)。木犀草苷、荭草素、异荭草素均可极显著降低细胞中上清液中IL-6的表达(P<0.01)。
IL-1β是IL-1的主要成分[32],是一种多功能的炎症因子,主要表现在致炎和对组织的胶原降解的破坏作用。如图3所示,LPS作用于THP-1单核巨噬细胞后,胞内IL-1β浓度极显著增高(P<0.01)。
木犀草素及其黄酮苷对IL-1β的抑制作用较其对TNF-α和IL-6的弱,木犀草素对细胞内IL-1βmRNA的表达具有显著抑制作用(P<0.05),荭草素对细胞上清液液中IL-1β表现出显著抑制作用(P<0.05)。

图 3 4 种黄酮类化合物对LPS刺激下THP-1单核巨噬细胞中IL-1β的影响Fig. 3 IL-6 contents of THP-1 macrophages pretreated with 4 flavonoids before being stimulated with LPS
2.3 黄酮类化合物对THP-1单核巨噬细胞炎性模型P-IκBα、P-IKKβ信号通路的调控作用

图 4 黄酮类化合物对LPS刺激下THP-1单核巨噬细胞P-IκBα、P-IKKβ的影响Fig. 4 P-IκBα and P-IKKβ contents of THP-1 macrophages pretreated with flavonoids before being stimulated with LPS
由图4可见,阳性对照组NF-κB抑制剂Bay的预处理可以抑制IκBα和IKKβ发生磷酸化,降低P-IκBα和P-IKKβ的含量。木犀草素、木犀草苷、荭草素、异荭草素均可以下调细胞中P-IκBα和P-IKKβ的产生,木犀草素及其黄酮苷对于抑制IκBα和IKKβ发生磷酸化具有较好的作用。
2.4 黄酮类化合物对THP-1单核巨噬细胞炎性模型中P65调控作用
同样通过计算相对比率分析抑制剂及黄酮类化合物对LPS刺激下THP-1单核巨噬细胞核和细胞质中P65的影响。LPS作用30 min后,细胞核和细胞质中P65较大程度地增加(图5)。阳性对照组NF-κB抑制剂Bay的预处理抑制了P65的生成,同时抑制了P65含量的核移位,这可以直接抑制NF-κB核转录因子调控的炎性介质的表达。木犀草苷、荭草素和异荭草素也可以通过抑制P65入核而发挥抗炎活性。
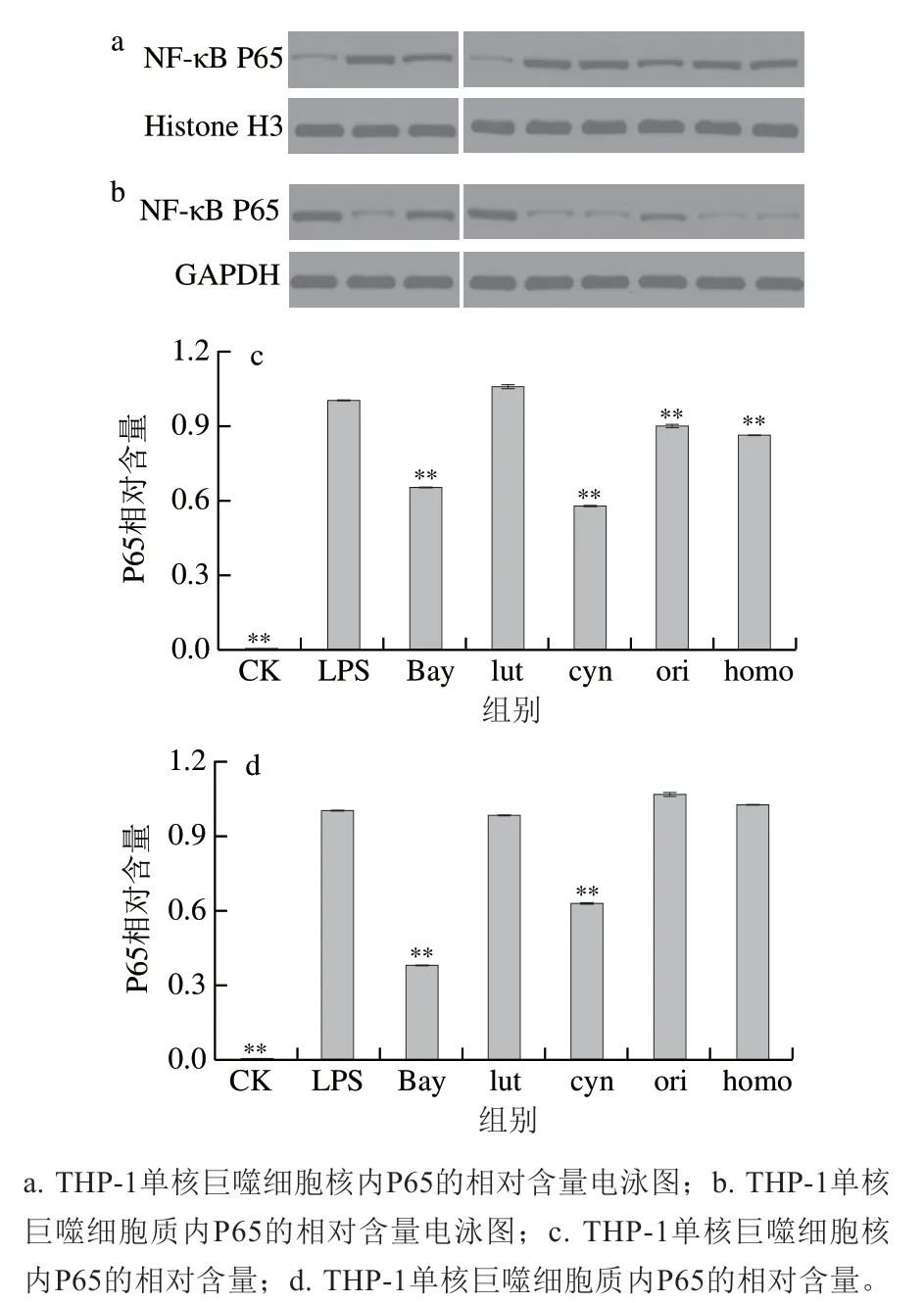
图 5 黄酮类化合物对LPS刺激下THP-1单核巨噬细胞核内与胞浆中P65的影响Fig. 5 P65 contents in THP-1 macrophages pretreated with flavonoids before being stimulated with LPS
2.5 黄酮类化合物对THP-1单核巨噬细胞炎性模型中Nrf2和HO-1的调控作用
LPS刺激后,较CK组相比,细胞中总Nrf2表达量降低,细胞核中Nrf2相对含量显著减少,而细胞质中Nrf2相对含量显著增多,表明LPS诱导的炎性反应中,Nrf2发生核移位程度低,LPS刺激THP-1单核巨噬细胞建立的炎性细胞中细胞内源Keap1-Nrf2抗氧化系统受到一定程度抑制。
Bay-11-7082作为NF-κB抑制剂可以显著提高细胞中Nrf2的表达,但不能使表达的Nrf2进入细胞核,启动抗氧化系统,发挥抗氧化活性。而荭草素不仅可以显著促进细胞中Nrf2的表达,还可以显著促进Nrf2发生核移位;木犀草苷、异荭草素同Bay类似,仅可促进Nrf2的表达(P<0.01)。

图 6 黄酮类化合物对LPS刺激下THP-1单核巨噬细胞核内与胞浆中Nrf2的影响Fig. 6 Nrf2 contents of THP-1 macrophages pretreated with flavonoids before being stimulated with LPS
LPS增强了细胞内产生氧化应激反应,为增强细胞内抗氧化活性,HO-1表达增多(P<0.01)。在作用12 h后,荭草素中HO-1表达量处于较低水平,可能是由于其通过显著促进细胞中Nrf2的表达,显著促进Nrf2发生核移位(图6c、e),黄酮类化合物发挥了一定的抗氧化活性,细胞内氧化水平已经得到控制(图7b),因而细胞内HO-1表达处于较低水平;木犀草素、木犀草苷、异荭草素3 种黄酮类化合物对HO-1的表达具有下调作用,这可能是经过黄酮类化合物的预处理后,抑制了IκBα和IKKβ发生磷酸化反应,直接抑制了NE-κB信号通路,较强程度上抑制了细胞内炎性反应(图6),细胞氧化应激水平不高,HO-1表达量较低。

图 7 黄酮类化合物对LPS刺激下THP-1单核巨噬细胞HO-1的影响Fig. 7 HO-1 contents of THP-1 macrophages pretreated with flavonoids before being stimulated with LPS
3 讨 论
NF-κB信号通路是目前发现的最关键的抗炎信号通路之一,它是参与炎症和先天免疫应答的主要效应通路[33]。许多参与炎症反应启动的炎性介质与细胞因子在转录水平上受到NF-κB的调控,如TNF-α、IL-6、IL-1β等炎性因子。本研究发现木犀草素黄酮碳苷荭草素可极显著地抑制促炎因子TNF-α、IL-6、IL-1β的蛋白表达,且荭草素通过抑制NF-κB信号通路关键调控蛋白上游调控器IKKβ、上游调控蛋白IκBα的活性及下游调控蛋白P65的活性发挥抗炎活性,表现出了更好的NF-κB信号通路抑制活性,发挥了极强的抗炎活性。
Nrf2是细胞抗氧化应激的关键核转录因子,正常状态下,Nrf2与Keap1呈结合形式,存在于细胞浆中,处于稳定状态,细胞核内Nrf2处于较低水平[34]。在氧化应激条件下,Nrf2与Keap1解离转译,大量的Nrf2迅速发生核移位,并激活多种抗氧化酶如HO-1等表达。激活的HO-1能够催化血红素分解释放出胆绿素,胆绿素在胆绿素还原酶作用下进一步降解为具有强大抗氧化能力的胆红素[35]。HO-1在氧化应激水平增高时表达则明显增高,迅速对沉积的血红素做出反应,催化血红素代谢产生胆绿素,通过抗氧化活性的调节细胞内氧化/抗氧化的平衡[36]。实验中荭草素使细胞处于较低水平的氧化应激水平,发现其主要通过可以显著促进细胞中Nrf2的表达,显著促进Nrf2发生核移位,发挥了较强的抗氧化活性。
具有IKKβ抑制活性可能是荭草素同时发挥抗炎、抗氧化活性的基础。IKKβ可与抗氧化信号通路Keap1-Nrf2中Keap1蛋白通过一段保守基序直接结合,抑制IKKβ或IKK复合体的活性,降低其对IκB的激活活性,这种Keap1介导IKKβ泛素化并降解的反应只发生在高等哺乳动物中[37]。在Keap1敲除的人巨噬细胞中,IKK复合体和NF-κB家族的总量及磷酸化程度均显著升高,NF-κB信号通路活化程度升高[38],证明IKKβ的存在与Keap1蛋白结合可抑制NF-κB信号通路的活化。类似地,本研究中荭草素通过抑制IKKβ上游调节器抑制NF-κB信号通路,发挥了抗炎活性,进一步地实验发现,荭草素促进Nrf2表达及核移位,使细胞中HO-1处于较低水平,发挥了一定的抗氧化活性。即IKKβ作为荭草素抑制NF-κB信号通路并激活Nrf2的交叉靶点发挥了抗炎/抗氧化双重生物活性。
此外,荭草素是以木犀草素为黄酮苷元母核,在C8位形成的黄酮碳苷,研究发现相同浓度下,荭草素在发挥抗炎活性和抗氧化活性时,其活性强于木犀草素,较木犀草素表现出更高的生物利用度。有研究表明II相代谢酶中的葡萄糖醛酸转移酶引起的首过效应是黄酮类化合物生物利用度低的重要原因[39]。木犀草素在体内易被代谢称为葡萄糖醛酸代谢产物,而被排出细胞而无法发挥药理作用[40]。李烨[41]的研究也发现,在人、大鼠肝微粒体反应体系中,木犀草素的葡萄糖醛酸代谢代谢速率均高于荭草素。这可能是相同浓度下,荭草素较木犀草素发挥了更强抗炎、抗氧化活性的原因。
4 结 论
木犀草素及其黄酮苷具有较好的抗炎活性,其中黄酮碳苷荭草素可以通过抑制NF-κB信号通路关键调控蛋白上游调控器P-IKKβ、上游调控蛋白IκBα的活性及下游调控蛋白P65的活性,下调细胞因子TNF-α、IL-6、IL-1β,发挥较强的抗炎活性;同时荭草素通过促进Nrf2核转录因子的表达和核移位发挥较好的抗氧化活性,IKKβ可能是荭草素抑制NF-κB信号通路并激活Nrf2发挥抗炎/抗氧化双重生物活性的交叉靶点;荭草素较木犀草素发挥了更强的抗炎、抗氧化活性,原因可能是其较木犀草素具有更低的代谢速率和更高的生物利用度。

