猕猴桃皮多酚对高脂膳食大鼠脂代谢紊乱的调节作用
苏天霞,袁敏兰,周 艳,孙晓红,张清海
(1.贵州医科大学公共卫生学院,环境污染与疾病监控教育部重点实验室,贵州 贵阳 550025;2.贵州医科大学食品科学学院,贵州 贵阳 550025)
随着居民膳食结构中高热量食物的比例不断增加,以及日常活动趋于静态化,导致超重和肥胖的发病率逐年上升[1],且呈现出年轻化、不可控的趋势[2]。据报道,长期的高脂膳食(high fat diet,HFD)会导致能量的摄入和消耗不平衡,多余的能量转变为脂肪储存在体内,最终导致机体发生肥胖和脂代谢紊乱[3],继而大大增加心血管疾病、高脂血症、2型糖尿病等多种慢性代谢性疾病的发病率,严重影响患者的生活质量[4]。因此,研究如何有效预防和改善脂代谢紊乱的方法受到全社会的关注。当前预防肥胖、调节脂代谢紊乱的方法存在安全性低、疗效不佳等问题[5-6]。故从天然产物中开发安全、高效的药物已成为研究的焦点。植物多酚是自然界最常见的一大类植物活性物质,因其安全性高,且具有抗氧化、抗炎、抗病毒、调节糖脂代谢等多种生物活性而颇受关注[7-9]。
大量研究报道,多种植物多酚在预防和调节脂代谢紊乱过程中发挥重要作用。Fernando等[10]研究证实蔓越莓多酚具有改善肥胖小鼠的糖脂代谢、缓解肝脂肪变性的作用;Kim等[11]以1 g/kgmb的剂量灌胃小鼠匙羹藤多酚4 周,发现小鼠的体质量以及血清中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平与高脂组比显著降低,腹部脂肪含量显著下降;Nilanjan等[12]研究发现辣木种子多酚提取物能够消耗高脂膳食小鼠体内多余的能量,维持能量代谢平衡,从而改善肝脂代谢紊乱,预防肥胖的发生。但是植物酚类化合物的组成和含量因其种类、产地、部位等不同存在较大差异[13-14],而目前国内外关于猕猴桃皮多酚的研究大多集中在对多酚的提取、成分分析、体外抗氧化等方面[15-16],基于动物实验探索猕猴桃皮多酚的功能报道较少,这在一定程度上影响了猕猴桃皮多酚的开发利用。因此,本实验以SD大鼠为研究对象,探索猕猴桃皮多酚对高脂膳食大鼠脂代谢的影响及可能的作用机制,为猕猴桃皮多酚是否可作为调节脂代谢紊乱的功能因子提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性健康SD大鼠,体质量(160.00±15.46)g,生产许可证号:SYXK(黔)2018-0001,由贵州医科大学实验动物中心提供。大鼠基础饲料购于贵州医科大学实验动物中心,高脂饲料含80%(质量分数,下同)基础饲料、9.5%猪油、0.5%胆固醇、10%蛋黄粉[17]。
TG、TC、LDL-C、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、游离脂肪酸(free fatty acids,FFA)、苏木精-伊红(hematoxylin and eosin,HE)染色试剂盒 南京建成生物工程研究所;动物组织总RNA提取试剂盒(TRIzol试剂) 江苏碧云天生物技术有限公司;去基因组反转录试剂盒、反转录聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 上海索莱宝生物公司;其他试剂均为分析纯;引物由上海生工生物技术有限公司合成,引物序列见表1。
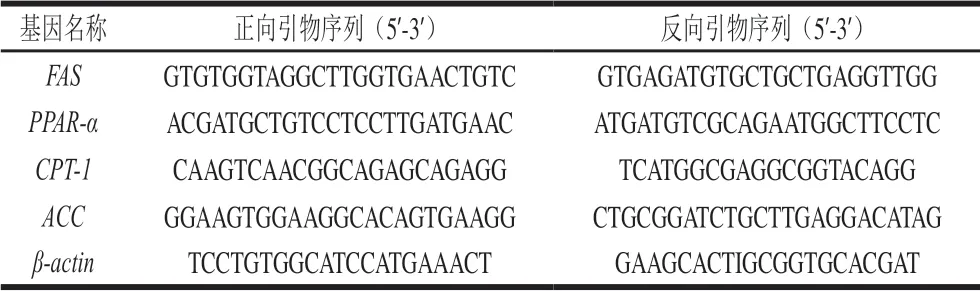
表 1 PCR引物设计序列Table 1 Primer sequences used for PCR
猕猴桃皮多酚提取物实验室自制(猕猴桃皮原料由贵州修文三圣金果公司提供),猕猴桃皮经过烘干、粉碎后,采用实验室前期优化的提取方法提取猕猴桃皮多酚[18],提取条件为:甲醇体积分数为60%、料液比1∶30、超声提取时间20 min、温度60 ℃、功率450 W,提取完成后进行过滤、旋转蒸发,最终冻干得到猕猴桃皮多酚的提取物,经Folin-Ciocalteu法检测猕猴桃皮多酚提取物中多酚质量分数为65.4%。动物实验时猕猴桃皮多酚提取物配制成总酚质量浓度为10 mg/mL溶液,通过高效液相色谱法测得猕猴桃皮中含7 种多酚物质(单位为mg/mL),分别为原儿茶酸6.45、表儿茶素1.60、七叶亭0.53、没食子酸0.086、绿原酸0.082、对-香豆酸0.074、儿茶素0.068。
1.2 仪器与设备
ABIViiA7荧光定量PCR仪 美国ABI公司;MK-3酶标仪、冷冻离心机 美国Thermo公司;721可见分光光度计 上海精密科学仪器公司;旋转蒸发仪 上海亚荣生化仪器厂;超声清洗器 江苏昆山美美超声仪器有限公司;数显式电热恒温水浴锅 天津市泰斯特仪器公司;光学显微镜 日本Nikon公司。
1.3 方法
1.3.1 动物饲养及分组
将40 只SPF级雄性SD大鼠用正常饲料预饲喂1 周后,按体质量随机分为5 组,每组8 只:正常组(NC组)、高脂组(HF组)和猕猴桃皮多酚低(50 mg/(kgmb·d),LKP组)、中(75 mg/(kgmb·d),MKP组)、高(100 mg/(kgmb·d),HKP组)剂量干预组。正常组饲喂普通饲料,其余4 组饲喂高脂饲料。连续灌胃9 周,每日一次,猕猴桃皮多酚干预组按照相应的浓度进行灌胃,NC组、HF组灌一定体积蒸馏水。
饲养条件:实验大鼠饲养于清洁级动物房,同室分笼,每组3 笼,每笼3~4 只,环境温度控制在(23±2)℃,相对湿度55%~58%,12 h/12 h昼夜循环光照,保持饲养环境卫生。实验期间所有动物均自由摄食和饮水,每周同一时间称量并记录体质量。
1.3.2 样本的采集及处理
9 周后实验结束、大鼠宰杀前禁食12 h,称体质量,用10%水合氯醛给大鼠进行麻醉,麻醉状态心脏取血入非抗凝管中,4 ℃、3 000 r/min离心10 min,取上层血清,-80 ℃保存备用。立即解剖大鼠,在冰浴上迅速取肝、内脏脂肪,包括肠系膜、腹周、睾周、肾周脂肪,精确称质量并记录,肝脏用冷生理盐水洗涤,洗净血水,去掉筋膜血管等附着物,用滤纸拭干,称质量。取100 mg左右肝脏组织置于TRIzol试剂中,剪碎,-80 ℃保存,用于总RNA的提取;取部分肝组织浸入10%中性多聚甲醛溶液中固定,4 ℃保存备用。剩余肝组织液氮冷冻后,-80 ℃保存。
1.3.3 大鼠生长指标的测定

1.3.4 血生化水平的测定
采用试剂盒法测定血清中TC、TG、LDL-C、HDL-C、FFA的浓度,具体方法按照试剂盒的说明书进行。
1.3.5 肝脏指标的测定
1.3.5.1 肝脏组织形态学观察
HE染色:甲醛固定超过24 h以上的肝脏组织进行乙醇梯度脱水,二甲苯透明,浸入石蜡包埋,预冷后切片(厚度5 μm)[19]。严格按照试剂盒说明书将切片进行HE染色,滴少许中性树胶封片,自然通风晾干,收集并进行镜检(400×),观察肝脏组织形态变化。
1.3.5.2 肝脏脂代谢相关基因mRNA表达量测定
TRIzol法提取肝脏中的总RNA,加入适量DEPC水稀释,通过测定溶液A260nm/A280nm确定所得RNA的纯度,比值在1.8~2.0时用于下一步实验。严格按照去基因组反转录试剂盒说明书操作,消除提取产物中的基因组DNA,并将RNA逆转成cDNA。
按照试剂盒说明书在冰上配制10 μL反应体系。该体系包含荧光染料TB Green Premix ExTaqII(2×)5 μL,正向及反向引物(10 μmol/L)各0.5 μL,cDNA溶液1 μL,灭菌水3 μL。设置3 个复孔,使用ABIViiA7荧光定量PCR仪进行扩增,扩增条件参考童鑫等的方法[20],并有所改动,收集荧光信号时,退火温度为58 ℃。扩增条件如下:预变性95 ℃、3 min;95 ℃、15 s,58 ℃、30 s(收集荧光信号),40 个循环。熔解曲线分析:温度65~95 ℃,每30 s读1 次。以β-actin为内参基因,mRNA相对表达量用2-ΔΔCt法计算。
1.4 数据统计分析
所有实验数据均用SPSS 21.0软件进行统计分析。多组间差异性比较采用单因素方差分析,结果以平均值±标准差表示,P<0.05有显著性意义。
2 结果与分析
2.1 猕猴桃皮多酚对大鼠生长指标的影响
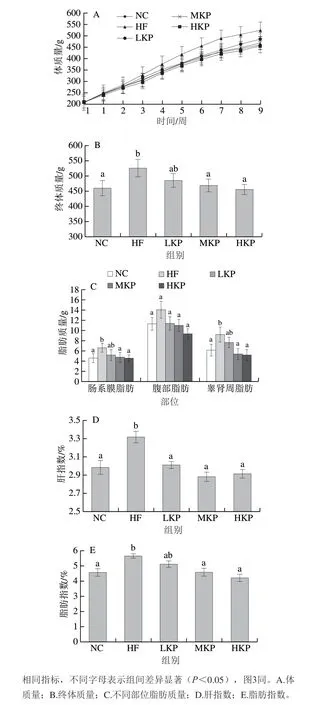
图 1 猕猴桃皮多酚对大鼠生长指标的影响Fig. 1 Effect of kiwifruit peel polyphenols on growth indexes in rats
由图1A可知,适应性喂养1 周后,各组大鼠的初始体质量均为(207±12)g,组间无显著性差异(P>0.05);随着实验时间的延长,大鼠体质量逐渐增加。第9周时,HF组大鼠的体质量为(524.50±28.70)g,与NC组相比具有显著差异性(P<0.05);猕猴桃皮多酚干预后,MKP和HKP大鼠的体质量与HF组相比显著下降(P<0.05),与NC组无显著差异性(P>0.05),说明猕猴桃皮多酚的干预可以缓解高脂膳食引起的体质量增加(图1B)。如图1C所示,对各组大鼠肠系膜脂肪、腹部脂肪、睾肾周脂肪质量进行分析,结果发现,各组腹部脂肪质量之间无显著性差异(P>0.05);HF组肠系膜脂肪、睾肾周脂肪质量显著高于NC、MKP、HKP组(P<0.05)。如图1D、E所示,对不同组间脂肪指数、肝指数进行分析,发现HF组脂肪指数、肝指数显著高于NC组(P<0.05);与HF组相比,干预组的肝指数以及MKP、HKP组脂肪指数显著下降(P<0.05),并且存在剂量效应关系。说明猕猴桃皮多酚能有效缓解高脂膳食引起的大鼠体质量、肝质量、脂肪质量增加。
2.2 猕猴桃皮多酚对大鼠血生化水平的影响
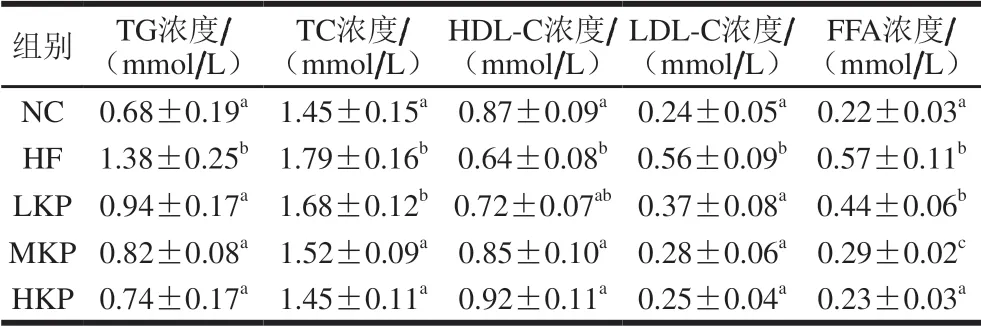
表 2 猕猴桃皮多酚对大鼠血生化指标的影响Table 2 Effect of kiwifruit peel polyphenols on blood biochemical parameters in rats
由表2可知,与NC组相比,HF组大鼠血清TG、TC、LDL-C、FFA水平显著升高(P<0.05),HDL-C水平显著下降(P<0.05),说明高脂膳食会导致大鼠血脂异常。与HF组相比,3 个干预组的TG、LDL-C水平显著降低(P<0.05);MKP、HKP组的TC、FFA水平显著降低(P<0.05),HDL-C水平显著升高(P<0.05)。结果表明,猕猴桃皮多酚可正向调节高脂喂养导致的脂代谢异常,其中HKP组的调节效果最好。
2.3 猕猴桃皮多酚对大鼠肝组织形态以及脂代谢相关基因mRNA表达水平的影响
2.3.1 猕猴桃皮多酚对大鼠肝组织形态的影响
由图2可见,与NC组相比,HF组大鼠肝脏出现严重的脂质蓄积现象,呈现弥漫性脂肪变性,肝索紊乱,肝细胞肿胀,内含数量、大小不一的脂肪空泡;经过猕猴桃皮多酚的干预,LKP、MKP组肝脂质蓄积现象、细胞肿胀的程度、脂肪空泡的数量较HF组得到明显的改善;NC组、HKP组大鼠肝细胞形态趋于一致,结构清晰完整、排列紧密,细胞内偶见少量脂肪空泡。
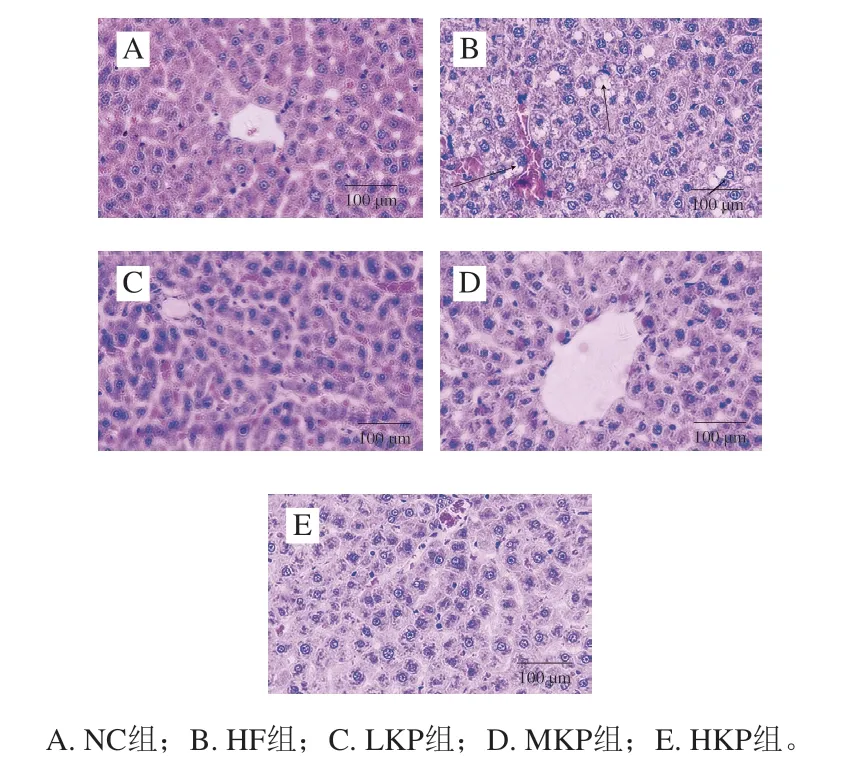
图 2 肝脏组织形态学观察、HE染色结果(400×)Fig. 2 Hepatic histomorpholgical observation (400 ×)
2.3.2 猕猴桃皮多酚对大鼠脂代谢相关基因mRNA表达水平的影响
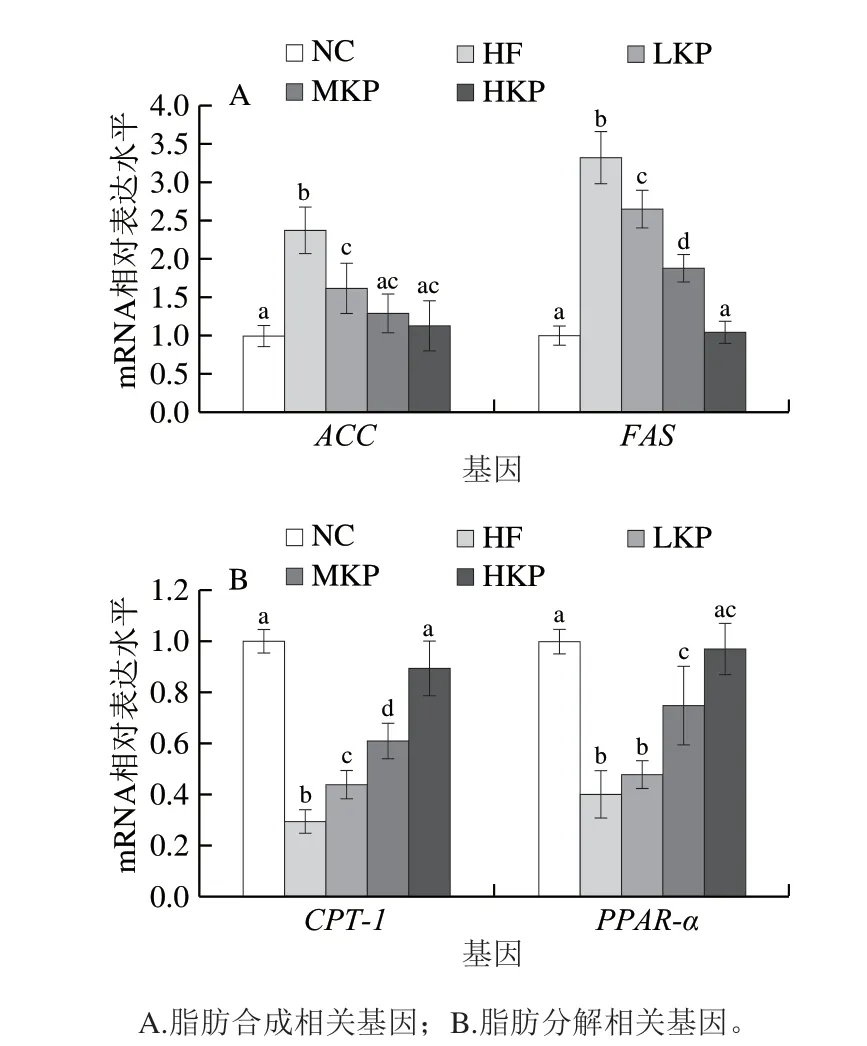
图 3 猕猴桃皮多酚对大鼠肝脏脂代谢相关基因mRNA表达水平的影响Fig. 3 Effect of kiwifruit peel polyphenols on the mRNA expression of lipid metabolism related gene in liver of rats
如图3所示,与NC组相比,HF组大鼠肝脏脂肪合成相关基因ACC、FASmRNA表达显著上调(P<0.05),脂肪氧化分解相关的基因CPT-1、PPAR-αmRNA表达显著下调(P<0.05)。经过猕猴桃皮多酚干预后,与HF组相比,LKP、MKP、HKP组大鼠肝脏脂肪合成基因ACC、FASmRNA表达显著下调(P<0.05);而与脂肪分解相关的CPT-1mRNA的表达显著上调(P<0.05),M K P、H K P 组的P PA R-αm R NA 的表达显著上调(P<0.05);结果表明猕猴桃皮多酚能够通过调控与脂肪合成和脂肪氧化分解相关的基因来改善高脂膳食导致的脂代谢紊乱,且在一定剂量范围内,与猕猴桃皮多酚的摄入量呈正相关。
3 讨 论
猕猴桃是一种营养价值丰富、具有独特风味的水果,深受世界人民喜爱。近年来,我国猕猴桃产业发展迅速,种植面积和年产量均居世界第一[21]。但在猕猴桃产业飞速发展的同时也存在原料浪费严重现象,如猕猴桃皮这一主要加工副产物约占猕猴桃原料质量的30%,富含多种营养成分,具有很大的开发价值;但目前未得到充分利用,主要作为废渣处理,这不仅浪费资源,还给环境增加负荷[22]。因此,开发相关的高附加值产品是一个急需解决的问题。
本研究显示,猕猴桃皮多酚的干预能够抑制高脂膳食大鼠体质量、肝质量、肠系膜脂肪、睾肾周脂肪质量的增加,且存在剂量反应关系,HKP组高脂膳食大鼠体质量、肠系膜脂肪、睾肾周脂肪质量的降低效果最显著。而刘清清[23]利用与猕猴桃皮同源的猕猴桃籽多酚提取物对高脂大鼠进行干预,结果也显示,猕猴桃籽多酚提取物可显著降低大鼠体质量,且存在剂量反应关系。长期的高脂膳食是脂质代谢紊乱最主要的原因,最直观的表现就是血脂异常,肝脏作为脂质代谢的主要场所,在脂质的吸收、合成、分解和转运过程中发挥十分重要的作用[24]。一般来说,血脂的变化常常预示着肝脏脂肪合成和分解的变化。已有研究表明植物多酚可显著改善机体的血脂水平,抑制肝脏脂肪的积累[25]。本实验结果发现通过猕猴桃皮多酚的干预可显著改善因HFD造成的肝脏脂肪空泡增多,肝脂过度蓄积的现象;同时显著降低高脂大鼠血清TG、TC、LDL-C、FFA水平,显著提高血清HDL-C水平;且随着猕猴桃皮多酚灌胃剂量的增加,其改善肝脂蓄积的效果越明显,调节脂质代谢的作用越强。
植物多酚可通过调控脂代谢合成和分解相关基因,改善肝脂代谢紊乱[26]。Huang Kang等[27]用高脂饲料喂养雄性SD大鼠,并用高、低两种剂量的绿原酸对其进行灌胃,实验结果表明绿原酸能有效降低FAS、ACC表达,抑制肝脏脂肪的合成;同时还可上调CPT-1的表达,促进脂肪酸氧化。本实验结果发现通过猕猴桃皮多酚的干预,同样可显著下调高脂大鼠肝脏脂肪合成相关基(ACC、FAS)的表达;显著上调脂肪分解相关基因(PPAR-α、CPT-1)的表达,进而实现对脂代谢紊乱的正向调控。ACC是脂肪酸合成限速酶,在调节能量代谢和控制肥胖发展方面起着重要的作用,其催化脂肪酸合成的第一步反应,即乙酰辅酶A羧合成丙二酰辅酶A[28];FAS是ACC下游的另一个脂肪酸合成限速酶,在脂肪酸合成中起到关键的作用,机体脂肪沉积所需的脂肪酸大多是由FAS催化乙酰辅酶A和丙二酸单酰辅酶A转变而成,其在肝脏组织中的表达较高[29]。本研究中ACC和FAS的mRNA表达显著下调,说明猕猴桃皮多酚可以下调脂肪合成相关基因,在转录水平上抑制肝脏脂肪的合成,进而抑制血脂的升高。PPAR-α是过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)中的一个亚型,在肝脏的脂质代谢过程中发挥重要作用,它能够调控许多线粒体脂肪酸氧化相关酶的表达,刺激脂肪酸β氧化,从而改善脂代谢紊乱状况,维持脂质代谢平衡[30]。CPT-1是脂肪酸氧化的限速酶,其表达直接受到PPAR-α的调控;它可使长链的乙酰辅酶A进入线粒体基质内,参与三羧酸循环,促进脂肪酸β氧化[31]。猕猴桃皮多酚通过上调PPAR-α和CPT-1的表达,在转录水平刺激β氧化,降低脂肪酸的水平,抑制TG合成;同时PPAR-α还可催化TG水解为游离脂肪酸FFA和单酰甘油,提高血清中HDL-C的浓度[32]。
综上所述,本研究从动物水平证明了猕猴桃皮多酚具有预防肥胖、改善脂代谢紊乱的作用,其作用机制与抑制生脂基因的表达,促进脂质分解基因的表达有关。提示猕猴桃皮多酚可作为预防肥胖、调节脂代谢紊乱的功能因子,为指导猕猴桃皮的精深加工利用提供了新的思路。结果对于脂代谢紊乱的预防和控制具有非常重要的研究价值和广阔的应用前景。

