体外模拟胃肠道对鲫鱼卵唾液酸糖蛋白的降解作用
王 婷,田迎樱,李雪静,王 菲,王静凤,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.青岛海洋生物医药研究院,山东 青岛 266003)
我国是世界第一水产大国,据2017年中国渔业年鉴统计,我国养殖和捕捞鱼类总产量达6 446万 t[1]。鱼类在加工过程中大约会产生30%~50%包括鱼卵在内的加工的重要副产物,鱼卵中富含多不饱和脂肪酸二十碳五烯酸/二十二碳六烯酸、糖蛋白、卵磷脂等多种功效成分[2-3]。然而目前除少量优质鱼卵被用来加工为腌渍鱼卵、鱼子酱等初级形式食品外,大部分未被高值化利用。造成了资源的严重浪费[4-5]。本课题组前期通过追踪前成骨细胞MC3T3-E1的增殖活性,从14 种水产鱼卵中筛选出了一种新型的鲫鱼卵唾液酸糖蛋白(sialoglycoproteins ofCarassiusauratuseggs,Ca-SGP)[6],并阐明了其结构轮廓和生物活性。
Ca-SGP是由分子质量为10.87 kDa的唾液酸糖肽(Ca-SGPP)重复连接而成的,N-糖链通过β-N-乙酰氨基葡萄糖连接在肽链N端4位的天冬酰胺上,由4 条支链构成,各支链存在分支链结构,其糖链末端的唾液酸为Neu5Ac,Neu5Ac通过α(2→3)糖苷键连接在糖链末端半乳糖上[7];Xia Guanghua等[8-9]对其活性研究发现Ca-SGP在细胞水平上可以促进前成骨细胞MC3T3-E1增殖、分化和矿化,同时可以抑制破骨细胞的成熟和分化;通过动物实验发现Ca-SGP可以抑制去卵巢骨质疏松大鼠的骨吸收,减少骨丢失;Mao Lei等[10]发现Ca-SGP可以促进间充质干细胞向成骨细胞转化;周晓春等[11]发现Ca-SGP对免疫力低下的小鼠具有调节作用;Wang Fei等[12]发现Ca-SGP能够促进骨质疏松症型骨折小鼠早期软骨骨痂的形成、中期软骨骨痂向骨性骨痂的转化以及后期骨性骨痂的重建,从而加速骨折愈合。然而,Ca-SGP属于大分子物质,其如何通过胃肠道被降解并利用仍不清楚。
近年来,体外消化模型因其简单、廉价、可重复性高、可实现多样本同时检测等优点被广泛应用于药物剂型分解、营养成分生物利用度、物质消化等研究中[13]。体外胃肠模拟系统能够有效解决胃肠道消化研究常存在的伦理问题,且广泛应用于研究机体胃肠道对食物或药物的消化行为[14-15]。该系统通过调节合适的消化酶浓度、pH值、消化时间、盐浓度及其他因子,最大程度地模拟体内口腔、胃、小肠及大肠的生理条件。因此,本实验采用静态胃肠模拟模型,在体外体系中对Ca-SGP进行胃肠液消化及肠道菌群厌氧发酵,通过对Ca-SGP降解产物的分析探究其在消化道内的降解情况。
1 材料与方法
1.1 动物、材料与试剂
3月龄SPF 级健康雌性Wistar大鼠,体质量(200.0±2.0)g,生产许可证号:SCXK(京)2016-0001,购自北京维通利华实验动物技术有限公司。
Ca-SGP干粉由中国海洋大学夏光华博士提供。在冰浴条件下迅速取出成熟的雌性鲫鱼(Carassius auratus)鱼卵,剔除鱼卵包膜,然后称取100 g鱼卵用均质机破碎,加入3.8 倍体积的NaCl(0.38 mol/L)溶液,搅拌4.2 h。提取液5 000 r/min离心10 min除杂后,加入等体积的90%苯酚溶液,搅拌2 h。离心得到的上清液用截留分子质量10 kDa的透析袋流水透析3 d,蒸馏水透析1 d。将离心后所得的上清液冻干即制得Ca-SGP粗品。本实验采用阴离子交换树脂单步纯化Ca-SGP粗品所得,纯度为84.6%,含质量分数16.55%的Neu5Ac,分子质量为195.35 kDa,不含磷。Ca-SGP的结构轮廓如图1所示。

图 1 Ca-SGP结构轮廓Fig. 1 Structure of Ca-SGP
胃蛋白酶、胰酶、唾液酸标准品(Neu5AC)、葡聚糖标准品 美国Sigma公司;猪胆盐 上海源叶生物科技有限公司;邻苯二胺盐酸盐 美国BBI公司;乙腈(色谱纯)、甲醇(色谱纯) 德国Merck公司;牛血清白蛋白、Folin-酚试剂、L-抗坏血酸 上海索莱宝生物科技有限公司;牛肉粉 北京奥博星生物科技有限责任公司;胰蛋白胨 北京双旋微生物培养基制品厂;其他试剂均为国产分析纯。
1.2 仪器与设备
Milli-QSynthesis超纯水系统 美国Millipore公司;SHZ-82A数显气浴恒温振荡器 上海双捷实验设备有限公司;1200高效液相色谱仪、ZORBAX SB-C18色谱柱美国Aglient公司;TSK-GELG4000PWxl色谱柱 日本TOSOH公司;BS224S型精密电子天平 北京赛多利斯仪器系统有限公司;UV-2450分光光度计 日本岛津公司。
1.3 方法
1.3.1 胃肠液配制
人工胃肠消化液储备液配制参照Minekus等[16]的方法,具体配方见表1。

表 1 人工胃肠液储备液配制Table 1 Preparation of simulated gastrointestinal fluids
1.3.2 胃肠消化条件
准确称取60 mg的Ca-SGP样品溶于20 mL超纯水中。取10 mL样品水溶液,加入8 mL人工胃液(simulated gastric fluid,SGF)储备液,用1 mol/L HCl溶液调pH值至2.0。然后加入100 mg胃蛋白酶、5 µL 0.3 mol/L的CaCl2,最后加超纯水补至20 mL,作为胃消化组;取10 mL样品,加入10 mL超纯水,作为胃消化对照组;取10 mL超纯水,加入8 mL SGF储备液,调pH值至2.0,加入与胃消化组等量的酶和CaCl2,作为胃消化基质对照组。在37 ℃恒温振荡箱内进行消化,消化结束后调pH值至中性灭酶。取胃消化后产物10 mL,加入8 mL人工肠液(simulated intestinal fluid,SIF)储备液,调pH值至7.0,加入60 mg胰酶、136 mg猪胆盐、20 µL CaCl2,用超纯水补至20 mL,作为肠消化组;取胃消化实验中的对照组10 mL,加入等体积的水作为小肠消化实验中的对照组;取胃消化实验中的基质对照组10 mL,加入与肠消化组等量的SIF储备液、胰酶、猪胆盐和CaCl2,作为小肠消化实验的基质对照组。置于37 ℃恒温振荡箱内进行消化,消化结束后煮沸灭酶。
1.3.3 厌氧培养基配制及菌悬浮液制备
厌氧培养基参照Zhou Jing等[17]的方法进行配制。取37.5 mL A溶液(含1.18%(质量分数,下同)NaCl、0.47% KH2PO4、0.12% CaCl2、1.2% (NH4)SO4、0.25% MgSO4· H2O)、37.5mL溶 液B(0.78% K2HPO4)、2 mLL-抗坏血酸(25%)、0.5gL-半胱氨酸、2 mL Na2CO3(8%)、1 g牛肉粉、1 g胰蛋白胨,加超纯水补至1 L。用1 mol/L NaOH溶液调pH值至7.5~8.0,随后加入0.05gL-半胱氨酸盐酸盐。无菌条件下取出健康大鼠的结肠内容物,称取1.0 g内容物于离心管中,加入10 mL无菌0.1 mol/L磷酸盐缓冲液,静置片刻,用无菌枪头捣碎,充分漩涡振荡。悬浊液在1 500 r/min条件下离心5 min,取上清液置于新管中再次离心,重复2 次,得肠道菌悬液(现用现配)。
1.3.4 肠道菌群发酵条件
在厌氧管中充入高纯N2,加入5 mL培养基,加塞密封,121 ℃条件下高压灭菌。用无菌的磷酸盐缓冲液配制质量浓度为15 mg/mL的Ca-SGP溶液,过0.45 μm无菌水系滤膜。在无菌操作台上用1 mL的注射器在装有培养基的各厌氧管管内分别注入0.5 mL样品和0.5 mL菌悬液。将各厌氧管置于37 ℃恒温振荡箱分别发酵0、6、12、24 h和48 h。发酵结束后,立即放在-80 ℃冰箱内终止反应。
1.3.5 消化样品分子质量测定
取适量消化后的样品,过0.45µm 水系滤膜,采用高效空间排阻色谱法(high-performance sizeexclusion chromatography,HPSEC)测定样品的分子质量。采用分子质量为5、12、50、270 kDa的葡聚糖作为标准品,以保留时间为横坐标,以分子质量的对数值为纵坐标,绘制标准曲线。HPSEC条件为:色谱柱:TSK-GELG4000PWxl(30 cm×7.8 mm,10 μm);流动相:0.2 mol/L NaCl溶液;流速:0.5 mL/min;进样量:20 µL;柱温:25 ℃;检测器:示差检测器和紫外检测器(230 nm)。
为排除酸性条件(pH 2)电解质对Ca-SGP分子质量的影响,将Ca-SGP分别于pH 2.0的样品水溶液、储备液(加入0.3 mol/L CaCl2)中消化6 h,检测消化后产物的分子质量。
1.3.6 消化样品还原糖质量浓度测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicyclic acid,DNS)法测定消化后样品的还原糖质量浓度。分别取0、0.2、0.4、0.6、0.8、1.0、1.2 mL葡萄糖标准液(1 mg/mL)于试管中,用蒸馏水补齐至2 mL;消化后样品用蒸馏水5 倍体积稀释。各管加入1.4 mL的DNS试剂,摇匀,沸水浴中准确加热5 min,取出,冰浴冷却至室温,用蒸馏水定容至25 mL,加塞混匀,于540 nm波长处测定吸光度。
1.3.7 消化样品唾液酸质量分数测定
将消化后的样品用8 kDa的透析袋透析3 d,每6 h换一次水。取1 mL透析后的样品,加入1 mL 0.5 mol/L的NaHSO4,在80 ℃水浴锅中水解30 min,冷却。将Neu5Ac标准品用超纯水配成500 µg/mL的储备液,然后梯度稀释成500、200、100、10、1 µg/mL的标准体系。然后取1 mL标准溶液和酸解后的样品溶液,加入1 mL的20 mg/mL邻苯二胺盐酸盐0.25 mol/L的NaSO4溶液配制),在80 ℃水浴锅中衍生40 min,冷却后过无菌0.22 µm的滤膜,置于4 ℃冰箱中保存。然后采用高效液相色谱(high performance liquid chromatography,HPLC)法测定样品消化后剩余唾液酸的含量。HPLC色谱条件:色谱柱:ZORBAX SB-C18柱(150 mm×4.6 mm,5 µm);流动相:1.0%四氢呋喃溶液(含0.2%磷酸)-乙腈(98∶2,V/V);流速:1 mL/min;进样量:20 µL;柱温:35 ℃;检测器:二极管阵列检测器(227 nm)。
1.3.8 消化样品蛋白质量浓度测定
采用Folin-酚法测定胃肠消化后的蛋白质量浓度。称取10 g Na2CO3、2 g NaOH、0.25 g酒石酸钾钠,用蒸馏水定容至500 mL,作为A液;称取0.5 g CuSO4·5H2O,用蒸馏水定容至100 mL,作为B液。试剂A和B以50∶1(V/V)混匀,得到试剂甲。试剂乙为Folin-酚试剂。配制250 µg/mL的牛血清白蛋白作为标准物质,分别取0.2、0.4、0.6、0.8、1.0 mL,加水补足至1 mL;消化后的样品经8 kDa透析袋透析后,取1 mL。各浓度的标准物质和样品分别加入5 mL试剂甲,混匀,室温静置10 min。再加入0.5 mL试剂乙,迅速漩涡混匀,室温静置30 min,于650 nm波长处测定吸光度。
1.4 数据统计分析
2 结果与分析
2.1 Ca-SGP最适胃肠消化时间的确定
为了确定胃消化的最适时间,首先将胃消化时间设置为2、4、6 h,采用HPSEC法检测胃消化不同时间后分子质量的变化。如图2A所示,胃消化基质液的出峰时间与样品水溶液的出峰时间不一致,表明胃消化基质液对样品分子质量变化无干扰。如图2B所示,与对照组相比,胃消化后样品峰右移,说明样品的分子质量减小,且在6 h偏移最大。
取胃消化6 h后的样品进行下一步的小肠消化,同时设置小肠消化时间为2、4、6 h,采用HPSEC法检测小肠不同消化时间后分子质量的变化。如图3A所示,小肠消化基质液的出峰时间与样品水溶液的出峰时间不一致,可排除胃消化基质液对样品分子质量变化的干扰。如图3B所示,与对照组相比,小肠消化后样品峰右移,说明样品的分子质量减小,在2 h偏移最大且再延长小肠消化时间分子质量基本不变。综上所述,胃消化最适时间为6 h,小肠消化最适时间为2 h。
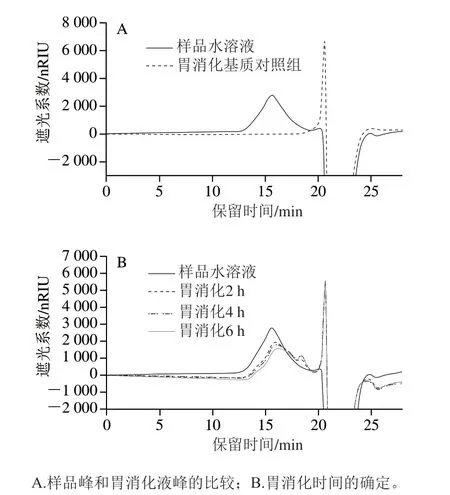
图 2 Ca-SGP在胃消化2、4、6 h后分子质量的变化Fig. 2 Change in olecular mass of Ca-SGP after gastric digestion for 2, 4 and 6 h

图 3 Ca-SGP在小肠消化2、4、6 h后分子质量的变化Fig. 3 Change in molecular mass of Ca-SGP after intestinal digestion for 2, 4 and 6 h
2.2 胃肠消化对Ca-SGP分子质量的影响
采用HPSEC法测定胃消化后产物的分子质量。如图4A所示,经胃消化6 h后,样品峰右移,Ca-SGP分子质量由(194.78±10.31)kDa减小到(155.00±13.59)kDa,说明胃对Ca-SGP有一定的消化作用。将Ca-SGP的胃消化产物进行小肠消化2 h,如图4B所示,Ca-SGP的胃消化产物经小肠消化后,分子质量进一步减小,平均减小到(38.94±2.26)kDa,说明小肠对Ca-SGP有较明显的消化作用。

图 4 胃肠消化对Ca-SGP分子质量的影响Fig. 4 Effect of gastric and intestinal digestion on molecularmass of Ca-SGP

图 5 pH值和电解质对Ca-SGP消化的影响Fig. 5 Effect of pH and electrolytes on the digestion of Ca-SGP
有研究表明,pH值和盐类会造成大分子的解聚和断裂[18]。为了研究pH值对Ca-SGP分子质量的影响,在不加入消化酶的情况下,将Ca-SGP置于pH 2.0的样品水溶液中消化6 h,采用HPSEC法测定消化后产物的分子质量。如图5所示,与样品水溶液相比,Ca-SGP在pH 2.0的条件下消化后的分子质量并没有发生改变。为了研究盐类对Ca-SGP分子质量的影响,将Ca-SGP于盐溶液中消化6 h,检测消化后产物的分子质量,如图5所示,与样品水溶液相比,Ca-SGP在盐溶液中消化6 h后产物分子质量并没有发生变化。因此,pH值和电解质对Ca-SGP在胃肠消化无影响,说明Ca-SGP分子质量的减小是因为消化酶的作用。
2.3 胃肠消化对Ca-SGP蛋白质量浓度的影响
Ca-SGP中含有14.33%的蛋白,采用Folin-酚法检测了胃和小肠消化后样品中蛋白质量浓度的变化。如图6所示,与对照组相比,消化后样品的蛋白质量浓度无显著降低,推测胃和小肠对Ca-SGP的蛋白部分无消化作用。但不排除是因为消化液中大量蛋白酶的存在使消化前后样品的蛋白质量浓度变化被掩盖。

图 6 胃肠消化对Ca-SGP蛋白质量浓度的影响Fig. 6 Effect of gastric and intestinal digestion on protein content of Ca-SGP
2.4 胃肠消化对Ca-SGP还原糖质量浓度的影响

图 7 胃肠消化对Ca-SGP还原糖质量浓度的影响Fig. 7 Effect of gastric and intestinal digestion on reducing sugar content of Ca-SGP
多糖易在水相体系中形成聚合物,有时很难区分聚合物分子质量的改变是由于聚合物的解聚还是由于分子链共价键的断裂[19]。若分子质量的降低是由于糖苷键断裂引起,则还原末端的量将增加[20],因此采用DNS法测定了Ca-SGP经胃肠消化后还原糖的变化。如图7所示,胃消化6 h后,还原糖质量浓度极显著增加,小肠继续消化2 h后,还原糖质量浓度进一步增加,因此,推测Ca-SGP经胃肠消化后分子质量的减小是糖苷键的断裂所致。
2.5 胃肠消化对Ca-SGP唾液酸质量分数的影响
胃肠消化酶理论上可以消化α-糖苷键,Ca-SGP糖链末端的Neu5Ac以α(2→3)糖苷键连接在半乳糖上。为了研究胃肠消化对唾液酸的影响,采用HPLC-UV法检测Ca-SGP经胃肠消化后唾液酸质量分数的变化。如图8所示,与对照组相比,Ca-SGP经胃消化后,唾液酸有部分丢失且质量分数降低17.53%(P<0.05),小肠消化后唾液酸大量丢失,质量分数降低71.94%(P<0.01)。因此,胃肠消化能够使Ca-SGP上的唾液酸脱落。由Ca-SGP的N-糖链的结构轮廓(图9)可知,糖链的支链与主链之间以α(1→3)糖苷键连接,也容易受到胃肠酶的作用,因此,被消化下来的Neu5Ac是游离的、带支链的,还是两者均有仍需进一步探讨。
潮州麦秆画作品中所蕴含的历史文化内涵,是潮州麦秆画区别于其它地区麦秆画作品的重要因素,潮州麦秆画精良的制作技艺与深刻的文化内涵,使潮州麦秆画有别具一格的艺术表现力与艺术感染力。在体现历史文化内涵方面,风景题材的麦秆画作品是其中的翘楚,与传统的花鸟麦秆画作品不同,风景题材的作品更具地域特色,通过对潮州特定景观进行取景创作而成的潮州麦秆画作品,具有独特的潮州历史文化内涵。
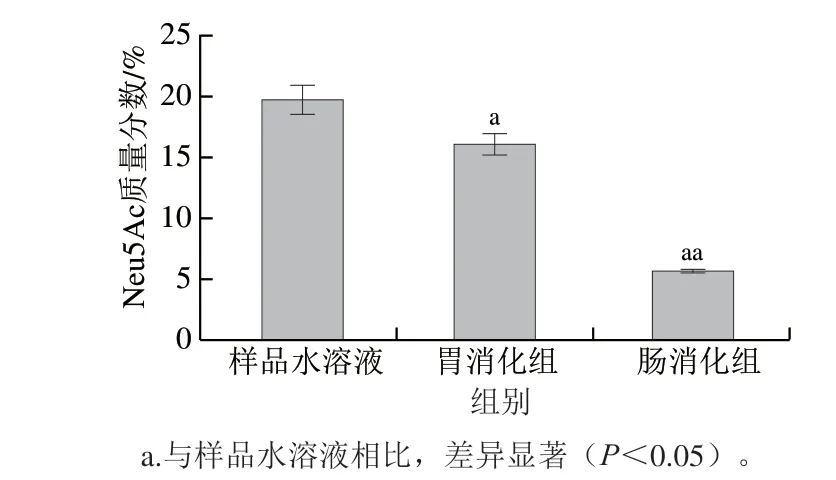
图 8 胃肠消化对Ca-SGP唾液酸质量分数的影响Fig. 8 Effect of gastric and intestinal digestion on Neu5Ac content of Ca-SGP

图 9 Ca-SGP的N-糖链结构轮廓Fig. 9 Structure of N-glycan chain of Ca-SGP
2.6 发酵过程中Ca-SGP分子质量的变化
上述结果发现,Ca-SGP经胃和小肠消化后分子质量减小,其Ca-SGP糖链末端的Neu5Ac可以被脱除。然而Ca-SGP的糖链大多以β-糖苷键连接,胃肠消化酶只能作用于α-糖苷键,因此Ca-SGP会进入大肠进行下一步的降解。使用健康小鼠的肠道菌悬液对Ca-SGP进行厌氧发酵,采用HPSEC法分别检测了发酵0、6、12、24、48 h后Ca-SGP的分子质量,如图10所示,随着发酵时间的延长,样品峰不断右移且峰值下降,说明Ca-SGP的分子质量减小且含量降低。提示肠道菌群可以降解Ca-SGP,并同时利用其降解产物。如图11定量结果显示,经过48 h发酵后,Ca-SGP分子质量由195.69 kDa降到34.77 kDa。

图 10 发酵不同时间后Ca-SGP的分子质量变化Fig. 10 Change in molecular mass of Ca-SGP after fermentation for different periods
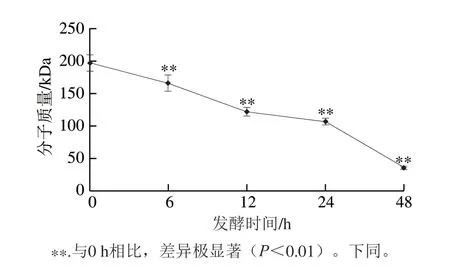
图 11 发酵不同时间后Ca-SGP的分子质量Fig. 11 Change in molecular mass of Ca-SGP after fermentation for different durations
2.7 发酵过程中Ca-SGP还原糖质量浓度和pH值的变化
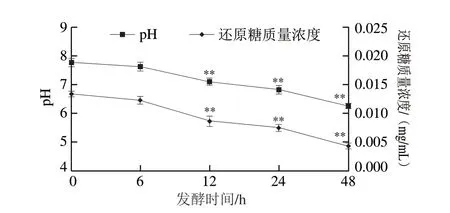
图 12 发酵不同时间后Ca-SGP的还原糖质量浓度和pH值变化Fig. 12 Change in reducing sugar content of Ca-SGP and change in pH after fermentation for different durations
采用DNS法测定了Ca-SGP经发酵后还原糖的变化,如图12所示,Ca-SGP经肠道菌群发酵后,还原糖质量浓度随发酵时间的延长而不断降低。还原糖质量浓度没有因糖链的裂解而升高,说明Ca-SGP能够不断被微生物发酵并且利用。
pH值的变化可作为发酵过程中的指示剂,用pH计检测了发酵0、6、12、24、48 h后溶液的pH值。如图12所示,溶液最初的pH值为7.77,呈弱碱性,随着发酵时间的延长,pH值不断降低,48 h后降到6.26,呈现弱酸性。有研究表明pH值的降低是由多糖发酵引起的,与短链脂肪酸的产生有关[21-22]。因此,推测本研究中pH值的降低是由肠道菌群发酵利用Ca-SGP,产生短链脂肪酸等酸性物质引起的。
3 讨 论
本实验在体外水平对鲫鱼卵唾液酸糖蛋白的胃肠和菌群发酵的降解产物进行了研究。结果表明,胃肠液对Ca-SGP有一定的降解作用,Ca-SGP糖链末端的活性因子唾液酸能够在胃肠消化酶的作用下发生脱落;大肠肠道菌群能够进一步降解Ca-SGP并利用其降解产物。
本研究中,Ca-SGP经历胃和小肠消化后分子质量减小,推测胃和小肠消化后Ca-SGP的蛋白链和糖链发生变化。由2.3节可知,Ca-SGP经胃和小肠消化后蛋白质量浓度无显著降低,推测胃和小肠对Ca-SGP的蛋白部分无消化作用。静态胃肠模拟模型中参与消化蛋白质的是胃蛋白酶和胰蛋白酶,胃蛋白酶优先作用于酪氨酸、苯丙氨酸、色氨酸、亮氨酸残基所组成的肽键[23],胰蛋白酶专一作用于精氨酸及赖氨酸残基所组成的肽键[24]。Ca-SGP含有天冬氨酸/天冬酰胺、苏氨酸、丝氨酸、谷氨酸、丙氨酸、甘氨酸、脯氨酸8 种氨基酸,氨基酸残基数目之比约为2∶2∶1∶2∶1∶1∶1[25]。Ca-SGP经过胃消化后蛋白质含量变化不大,推测是因为Ca-SGP的蛋白链上连接了大量的糖链,阻碍了胃蛋白酶的作用位点,且Ca-SGP不含胃蛋白酶优先作用的氨基酸残基形成的肽键。将胃消化产物进行下一步的小肠消化后蛋白质的变化不大,说明胰蛋白酶对Ca-SGP中的蛋白质无消化作用,推测是因为Ca-SGP不含胰蛋白酶作用的氨基酸残基形成的肽键。此外Ca-SGP的蛋白质量分数为14.33%,因体外胃肠模拟模型中存在大量的胃蛋白酶和胰蛋白酶,故并不能排除实验模型本身对样品蛋白质变化的干扰。
Ca-SGP经历胃和小肠消化后分子质量减小,推测是因为糖苷键的断裂。胃和小肠消化后还原糖质量浓度的增加进一步证明了上述推测。在Ca-SGP的糖链中,末端的Neu5Ac以α(2→3)糖苷键连接在半乳糖上,支链与主链之间以α(1→3)糖苷键连接,这两处连接位点可能受到消化酶的作用。胃和小肠消化后Neu5Ac的含量减少约71%,说明末端Neu5Ac可以被脱除。前期研究结果显示,小鼠单次灌胃Ca-SGP后0.5 h内,Neu5Ac可快速进入小肠肠壁,质量分数达到峰值,血清中Neu5Ac的质量分数自灌胃后持续增加,并在5 h时达到峰值。提示Ca-SGP的活性因子Neu5Ac可以被小肠吸收,进入血液循环[26]。小肠消化后,Ca-SGP的分子质量大幅度减小,推测主链与支链之间的糖苷键也会发生断裂,因此Ca-SGP的糖链在经历胃和小肠消化后产生的碎片可能包括主链、支链、Neu5Ac、支链+Neu5Ac。Wang Cong等[27]发现体内内源性蛋白酶(唾液酸酶、胰蛋白酶)只能消化壳聚糖中的α-糖苷键,对β-糖苷键几乎不能分解或者少量分解。因Ca-SGP的糖链大多以β-糖苷键连接,受限于胃肠道的消化,因此会进入大肠受到肠道菌群的降解和发酵。在体外模拟肠道菌群发酵时,由于培养基的消耗及代谢产物的积累,细菌不能长期生长,因此通常不宜超过48 h[28]。本研究将发酵时间设置为0、6、12、24 h和48 h,发现随着发酵的不断进行,Ca-SGP的分子质量和水平均不断减小,且还原糖质量浓度及pH值呈现不断降低的趋势,说明肠道菌群在裂解Ca-SGP的同时利用了其降解产物。这一研究结果与秦清娟等[29]发现肠道菌群能够降解并利用魔芋葡甘低聚糖相似。
综上所述,胃肠液对Ca-SGP有一定的消化作用,胃肠消化酶能够使Ca-SGP糖链上的唾液酸脱落。大肠肠道菌群能够裂解Ca-SGP并利用其降解产物。本实验在体外水平上研究了Ca-SGP在胃肠和肠道菌群的降解作用,为深入探索Ca-SGP作用机理提供了理论支撑。

