特殊环境巨大芽孢杆菌LB01抗菌活性成分的分离鉴定及抗病机理
丁从文,冯 群,李春焕
(1.桂西区域生态环境分析和污染控制重点实验室,广西 百色 533000;2.百色学院化学与环境工程学院,广西 百色 533000)
从巨大芽孢杆菌(Bacillus megaterium)发酵液中提取分离的化学成分及其抗病效果的研究已广为报道:曹燕鲁等[1]报道B. megateriumB1301菌株可以发酵产生一类广谱抗菌蛋白类化学成分;秦健[2]报道B. megateriumB-196菌株可发酵产生对水稻纹枯病菌具有抑制活性的脂肽类化合物(IturinA2);王一然等[3]报道B. megateriumCICC 10055菌株发酵液中的谷氨酸脱羧酶能加快谷氨酸迅速转化为有降压利尿功能的4-氨基丁酸;赵妗颐等[4]研究表明B. megateriumL2菌株发酵液中的2-苯基醋酸甲酯等21 种单体化合物对魔芋软腐病菌(Erwinia carotovora)具有高效的抗菌能力,也有研究表明B. megateriumL2所产的亚油酸等27 种化合物的复配物对青枯雷尔氏菌(Ralstonia solanacearum)具有较强的抑菌活性[5]。由此可见,不同来源B. megaterium所产生的抗菌活性成分有所不同,而B. megaterium对采后芒果炭疽病菌(Colletotrichum gloeosporioides)抗菌活性成分的研究鲜见报道。广西岩溶地区土壤缺少营养,并且石漠化异常严重[6],被称作特殊环境[7]。特殊环境中分离纯化获得的微生物菌株不仅适应能力很强,而且其菌株的代谢方式也不同于普通环境,可以产生一些结构特殊、活性很强的次生代谢产物[8]。
本实验以广西独特的岩溶地区特殊环境中分离鉴定的B. megateriumLB01菌株发酵液为研究对象,并对此菌株发酵液中的化学成分进行了提取及抗菌活性成分的追踪分离,获得了一个结构特殊的对采后芒果C. gloeosporioides具有高效抗菌活性的化合物001,并进一步对此化合物进行了结构鉴定及抗病作用机理的深入研究。此研究结果将为研发防治芒果采后炭疽病的新型微生物药物先导化合物提供依据,同时也为降低芒果贮藏、运输和销售过程中因炭疽病造成的经济损失[9-10]提供方法参考。
1 材料与方法
1.1 材料、菌株与试剂
芒果自广西岩溶区百色市凌云县的实验果园采收后,立即运送至实验室,根据芒果的体积大小进行分类,选择未受到任何损害或感染的芒果,采用体积分数1%的NaClO溶液表面消毒2 min,利用无菌蒸馏水洗涤并风干。
将实验室中已保存的采后芒果炭疽病菌(C. gloeosporioides)在PDA培养基上于25 ℃下培养1~2 周,采用含体积分数0.05%吐温-80的无菌蒸馏水冲洗培养物收集孢子,借助血细胞计数器调节至1.0×104个/mL。
B. Megaterium分离自广西独特的特殊岩溶环境并鉴定保存于桂西区域生态环境分析和污染控制重点实验室中,编号为LB01。
乙酸乙酯、乙醇、石油醚、氯仿、四氢呋喃等济南恒化科技有限公司。
1.2 仪器与设备
NMReady 60e型核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)仪 加拿大Nanalysis公司;Q Exactive型电喷雾电离质谱(electrospray ionization-mass spectrometry,ESI-MS)仪 美国Thermo Fisher公司;RE-2000A旋转蒸发仪 上海汗诺仪器有限公司;OLS4000型激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM) 东莞市昱和仪器设备有限公司。
1.3 方法
1.3.1B. megateriumLB01发酵液中抗菌活性成分的追踪分离及纯化
发酵液的制备[11]:菌株LB01经扩大培养后,将获得的活化菌株倒入LB液体培养基(m(胰蛋白胨)∶m(酵母提取物)∶m(氯化钠)∶m(琼胶)∶m(蒸馏水)=2∶1∶2∶3∶200)中,以180 r/min的转速于摇床上35 ℃恒温振荡培养58 h,得到菌株发酵液。
B. megateriumLB01发酵液(48 L)通过小孔滤膜进行减压过滤,收集发酵滤液,参考文献[12]的方法,采用大孔树脂吸附柱富集发酵液中化学成分,首先用2 倍柱体积的去离子水洗脱树脂,除去NaCl、KCl等盐类以及大极性糖类和杂蛋白,再用洗脱剂乙醇-水、氯仿-甲醇、氯仿-石油醚、乙酸乙酯-石油醚均分别依次采用体积比1∶4、1∶1、4∶1进行梯度洗脱,获得不同体积的洗脱液,对这些洗脱液分别进行减压浓缩,将浓缩物溶于无菌蒸馏水中配成质量浓度分别为0(对照)、0.1、0.3、0.5、1.0、3.0、5.0、7.0 mg/L的溶液,同时采用纸片扩散(K-B)法[13-14]进行活性追踪与评价,1 d后根据抑菌圈直径判断各组分的抗菌活性。有活性的组分1和2经过薄层色谱、硅胶色谱柱、制备液相色谱及葡聚糖凝胶色谱技术[15]进一步分离及纯化,获得纯品单体001~004。对这4 种单体再次进行活性追踪检查,最终筛选到对采后芒果C. gloeosporioides具有显著抑制活性的单体001,将5 mg单体001溶于20 mL、体积分数95%乙醇溶液中进行重结晶,得到高纯度的晶体,供抑菌机理研究使用。活性追踪分离及纯化流程如图1所示。
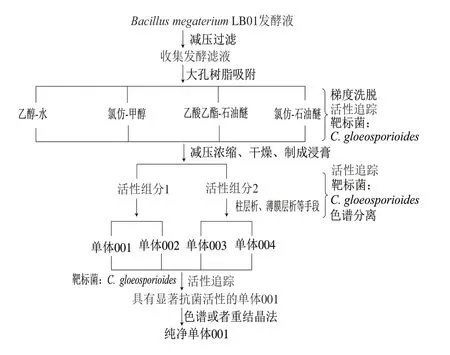
图 1 抗菌活性化合物001的追踪分离及纯化流程Fig. 1 Flow chart for the separation and purification of antifungal bioactive compound 001
1.3.2B. megateriumLB01抗菌活性单体001的结构鉴定
1.3.2.1 抗菌活性单体001的ESI-MS、NMR图谱测定
ESI-MS图谱测定:取5 mg纯净单体001,采用体积分数50%四氢呋喃-水溶液配制成10 μg/mL的单体化合物001的溶液,通过注射泵直接进样,进行正离子检测,使用氦气作为碰撞气,离子源喷射电压为4.62 kV;毛细管电压及温度分别为6.18 V、179 ℃;鞘气和辅助气为氮气,流速分别为0.78、0.16 L/min;待测单体化合物001的溶液流速为12 μL/min。
1H NMR与13C NMR图谱测定:取5 mg纯净单体001溶于装有氘代氯仿(CDCl3)的核磁管中,摇动核磁管直至形成澄清的溶液,进行1H NMR测定,核磁场频率为400 MHz;另取15 mg纯净单体001分批加入到装有氘代氯仿(CDCl3)的核磁管中,用同样的方法形成澄清溶液,进行13C NMR测定,核磁场频率为100 MHz。
ESI-MS、1H NMR及13C NMR分析:根据ESI-MS中的准分子离子峰的质荷比(m/z),判断单体001的相对分子质量(relative molecular mass,Mr),通过1H NMR明确单体001中氢原子的个数,通过13C NMR判断活性单体001中碳原子的类型或者数量,结合13C NMR与1H NMR确定单体001的化学式,计算其不饱和度,手性单体则需通过测定其旋光度判断抗菌活性单体的绝对构型。
1.3.2.2 抗菌活性单体001的结构鉴定
通过ESI-MS数据及1H NMR与13C NMR中碳、氢原子和官能团的信号以及化合物理化性质,兼顾数据库中化合物的检索比对,对抗菌活性单体进行化学结构鉴定。
1.3.3 抗菌活性单体001的抑菌效果分析
1.3.3.1 活体抗菌实验
参考文献[16]的方法,采用一枚无菌钉子于芒果果实腰部打一个直径为4.0 mm、深度为2.5 mm的伤口,然后将其浸在5.0 mg/L的单体001溶液中,以等体积的无菌蒸馏水代替单体溶液作为对照。2 min后取出芒果,于空气中风干2 h后,将C. gloeosporioides孢子悬浮液(1.0×104个/mL)喷雾接种至每个芒果果实的伤口,然后将芒果均贮存在25 ℃环境中14 d,每隔7 d测定芒果果实的发病率和病斑直径,每次处理15 个芒果。
1.3.3.2 离体抗菌实验
参考文献[17],制备0、1、3、5、7 mg/L的单体001溶液,将单体001溶液加到含有熔化的PDA培养基的锥形瓶中,得到终质量浓度为0.0(对照)、0.1、0.3、0.5、0.7 mg/L的单体001溶液,混匀后加到灭菌的培养皿(直径10 cm)中,于培养皿中心接种C. gloeosporioides菌饼,于22~25 ℃温育,采用游标卡尺测定菌落直径,并依据公式(1)计算抑菌率。

参考文献[14]的方法,将100 μLC. gloeosporioides孢子悬浮液(1.0×104个/mL)、1.2 mL PDB培养基和3.0 μL不同质量浓度的单体001溶液加到2.5 mL无菌离心管中,使单体001的终质量浓度分别为0.0、0.1、0.3、0.5、0.7 mg/L。取出150 μL混合液均匀涂在载玻片上,然后将其置于底部铺有圆形湿润滤纸的培养皿中,于25 ℃下培养8 h,测定各组孢子萌发率及芽管长度。每个处理中至少测100 个孢子。孢子萌发率根据公式(2)计算,芽管长度通过显微镜目镜镜筒中测微尺进行测量。

1.3.4 抗菌活性单体001对病原菌的作用机理分析
1.3.4.1 活性氧水平、丙二醛含量的测定
根据Shi Xuequn等[18]的方法,采用氧化剂敏感探针2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydroflf luorescein diacetate,DCHF-DA)测定C. gloeosporioides孢子细胞内活性氧(reactive oxygen species,ROS)的水平。将250 μLC. gloeosporioides孢子悬浮液(1.0×104个/mL)加入到3 mL含有0.0(对照)、5.0 mg/L单体001溶液的PDB培养基中,恒温摇床中25 ℃、200 r/min振荡培养,于6、12、18 h取出15 μL混合液于0~4 ℃ 5 000 r/min离心6 min,采用10 mmol/L磷酸钾缓冲液(pH 7.0)洗涤,并在含有10 μmol/L DCHF-DA(溶于二甲基亚砜)的相同缓冲液中避光孵育5 min,再用磷酸钾缓冲液洗涤2 次后,于荧光显微镜下观察孢子。对氧化剂较为敏感的荧光探针DCHF-DA与孢子内产生的ROS作用后会发生荧光染色;因此,可以通过计算每个处理组中被DCHF-DA染色的孢子细胞比例,判断单体001对孢子内产生ROS水平的影响。
将C.gloeosporioides的孢子悬浮液(1.0×104个/mL)加入到含有0.1 L液体PDB培养基的锥形瓶中,在摇床上25 ℃、200 r/min培养3 d后收集菌丝体。然后将菌丝体(2 g)置于锥形瓶中,加入0.1 L液体PDB培养基和5.0 mg/L单体001溶液,200 r/min、25 ℃摇床培养0、6、12 h和18 h后,收集菌丝体,根据Wang Yousheng等[19]的方法测定丙二醛(malondiadehyde,MDA)含量。以锥形瓶中不添加单体001作为对照。
1.3.4.2 孢子线粒体分布的测定
参考Shi Xuequn等[18]的方法,将200 μ LC. gloeosporioides孢子悬浮液(1.0×104个/mL)加到3 mL含有0.0(对照)、5.0 mg/L单体001溶液的PDB培养基中,恒温摇床中25 ℃、200 r/min培养,2、6、12 h和18 h后取出20 μL孢子液,加入0.1 μL线粒体选择性染色剂(Mito Tracker®Orange CMTMRos),对孢子线粒体染色5 min,采用LSCM检测被线粒体染色剂染色的孢子发出的荧光,每次处理至少测定20 个孢子,重复3 次。
1.3.4.3 孢子膜完整性的测定
对比上述实验结果,对酶标板培养孔孔位为同一颜色采用方案一和方案二进行不同组的实验结果来看,方案二计算酶标板培养孔的颜色的HSV平均值标准误差较方案一出现明显降低,平均值波动更小,有效降低颜色特征提取的误差.
参考文献[20]的方法,将180 μLC. gloeosporioides孢子悬浮液(1.0×104个/mL)分别加到2 mL含有0.0 mg/L(对照)和5 mg/L单体001溶液的PDB培养基中,恒温摇床中27 ℃、190 r/min振荡培养,6、12 h和18 h后取出10 μL孢子液于4 ℃离心(5 000 r/min)15 min,采用10 mmol/L磷酸钾缓冲液(pH 7.0)洗涤2 次,加入10 μmol/L碘化丙啶(propidium iodide,PI)染色剂进行染色,通过配有荧光素罗丹明过滤器的显微镜观察染色孢子,采用数码相机拍摄染色孢子图像。每个样本随机选取3 个视野,并将亮场中的孢子数定义为总数。膜完整性根据公式(3)计算。

1.4 数据处理与分析
使用SPSS 20.0软件进行数据处理与分析,通过单因素方差分析进行Duncan’s显著性检验,P<0.05表示差异显著。采用Excel软件作图。
2 结果与分析
2.1 抗菌活性单体001的追踪分离结果
采用不同比例的洗脱剂进行梯度洗脱,获得不同体积的洗脱液组分,使用纸片扩散法(K-B法)进行抗菌活性追踪检测,对具有活性大小相同或者相似的组分进行合并,分别获得活性组分1与活性组分2,活性组分1和2再次进行柱层析分离,对具有相同比移值的单体化合物进行合并,共获得4 种单体001~004。通过纸片扩散法可以观察到,含有0.5 mg/L单体001~004的纸片对病原菌C. gloeosporioides均不能产生相应的抑菌圈,而含有5.0 mg/L单体001~004的纸片对病原菌都可以产生不同直径的抑菌圈。

表 1 纸片扩散法观察到的质量浓度为5.0 mg/L的单体001~004对炭疽菌产生的抑菌圈直径Table 1 Inhibition zone diameters produced by monomers 001 through 004 against C. gloeosporioides in disk diffusion test
活性追踪结果如表1所示,编号为002、003、004的单体对炭疽菌的抑菌圈直径在10 mm左右,显著低于编号为001的单体抑菌圈直径((21.00±1.64)mm),说明单体001对芒果炭疽病菌具有高效的抑制活性。活性组分1与活性组分2的抑菌圈直径分别为(23.19±0.02)、(19.26±0.08)mm。活性组分1通过色谱分离获得的单体化合物001的抑菌活性小于活性组分1,单体化合物002的抑菌活性十分微弱;活性组分2具有较强的抗菌活性,但经分离获得的单体化合物003与004的抗菌活性却非常弱。由此可以判断单体活性成分在分离之前可能存在协同效应,该部分工作有待进一步系统研究。
2.2 抗菌活性活性成分001的结构鉴定结果
重结晶得到的单体001为白色晶体,[α=-9.50(c 0.68, CHCl3),1H NMR(CDCl3, 400 MHz)δ:5.51(1H, t,J=10.6Hz, H-3)、5.43(1H, t,J=10.6 Hz,H-4)、3.47(2H, t,J=10.9 Hz, H-1)、2.59(2H, d,J=11.4 Hz, H-11)、2.37(2H, m, H-5)、2.36(1H,m, H-6)、2.34(2H, t,J=17.5 Hz, H-8)、2.32(2H,m, H-2)、2.30(1H, m, H-10)、2.27(2H, m, H-9);13C NMR(CDCl3, 100 MHz)δ:221.8(s, C-7)、178.6(s, C-12)、128.4(d, C-4)、128.5(d, C-3)、61.7(t, C-1)、56.2(d, C-6)、41.8(t, C-11)、40.9(d, C-10)、39.7(t, C-8)、32.0(t, C-2)、29.0(t, C-9)、27.5(t, C-5);ESI-MSm/z[Mr+NH4]+(244)、[2Mr+Na]+(475)、[Mr+Na]+(249)。
单体001的1H NMR(CDCl3, 400 MHz)显示了2 个具有Z式结构的双键质子共振峰,其化学位移分别为5.51(1H, t,J=10.6 Hz, H-3)、5.43(1H, t,J=10.6 Hz, H-4);1 个与羟基氧直接连接的—CH2上质子共振峰的化学位移是3.47(2H, t,J=10.9 Hz, H-1),其余5 个—CH2上的质子化学位移分别是2.59(2H, d,J=11.4 Hz, H-11)、2.37(2H, m, H-5)、2.34(2H, t,J=17.5 Hz, H-8)、2.32(2H, m, H-2)、2.27(2H, m, H-9),后面5 个—CH2质子共振峰的化学位移显著低于与羟基氧直接相连—CH2质子峰,原因可能在于氧元素具有较大的电负性,致使与其相连的—CH2质子共振峰朝向低场迁移。包括2 种—CH质子共振峰,从核磁共振氢谱中共收集到16 种氢,还有2 种氢原子(醇羟基氢与羧基氢)尚未发现,可能是这2 种氢原子较为活泼或者是使用的溶剂所致。ESI-MSm/z显示的信号较强且标记的3 个准分子离子峰[Mr+NH4]+、[2Mr+Na]+、[Mr+Na]+的质荷比分别为244、475、249,据此可以计算出化合物001的相对分子质量为226。
13C NMR(CDCl3, 100 MHz)中显示了12 个13C共振信号峰,其中4 个共振信号峰处于低场,它们具有较大的化学位移,其位移、峰形及位置分别是:221.8(s,C-7)、178.6(s, C-12)、128.4(d, C-4)、128.5(d,C-3),从化学环境和峰形可以推断7位碳是环戊酮羰基(C=O)上的碳,12位碳是羧基(COOH)上的碳,4位与3位碳是化合物中的不饱和碳碳双键(C=C)上的碳;包括其余8 个碳的共振信号峰,共有12 个碳原子,与12-羟基茉莉酸(12-hydroxyjasmonic acid,TA)的碳原子数一致。结合单体化合物001的ESI-MS、1H NMR可以推断化合物001的化学式是C12H18O4。将该化合物001的ESI-MS、1H NMR和13C NMR的数据与原始数据库的数据进行比照,检索结果发现化合物001与文献[21]中报道的此化合物高度匹配。根据以上解析可以判断化合物001是TA,其化学结构见图2。
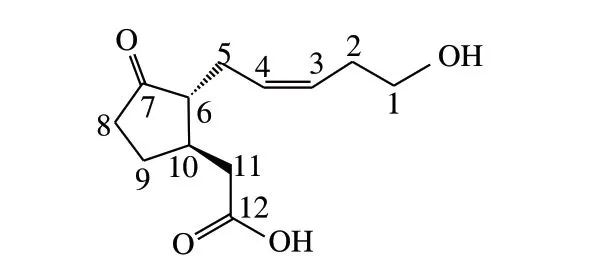
图 2 抗菌活性化合物001的化学结构Fig. 2 Chemical structure of antifungal compound 001
2.3 TA对采后芒果炭疽病发病率及发病程度的影响
与对照组相比较,TA能显著抑制芒果炭疽病的发生(图3A)。接种7 d后,对照组芒果果实已完全腐烂,但经TA处理过的芒果果实的炭疽病发病率仅为46.8%(图3B)。此外,在接种炭疽病菌7、14 d后,TA处理过的芒果果实中的病斑直径分别仅为5.67、15 mm,而对照组芒果果实中的病斑直径分别为28.33、66.00 mm(图3C)。这些结果可以充分表明,TA处理能显著减少芒果果实中炭疽病的发病率,大大降低芒果炭疽病的发病程度。
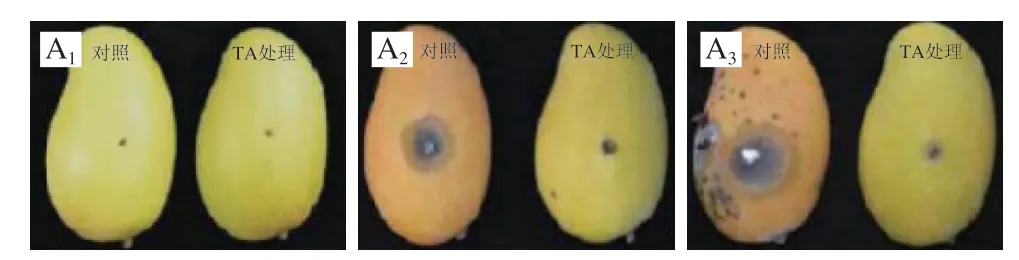
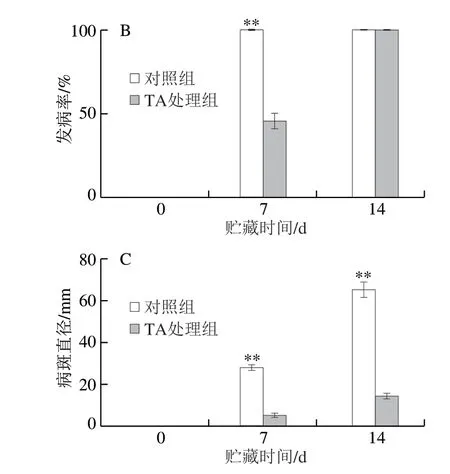
图 3 TA对芒果炭疽病的抗病效果Fig. 3 Anti-anthracnose disease effect of TA in vivo
2.4 TA对炭疽病菌菌丝生长和孢子萌发的影响

表 2 不同质量浓度的TA对芒果炭疽病菌的抑菌率Table 2 Inhibitory rates of TA at different concentrations against C. gloeosporioides
由表2可知,由培养基稀释的4 种不同质量浓度TA均抑制了芒果炭疽病菌的菌丝生长,与对照组相比,0.7 mg/L TA处理组病原菌的生长受到完全抑制,抑菌率高达100%,此时的菌落直径仅0.0 mm;而单体TA质量浓度为0.1、0.3 mg/L时的抑菌效果较差。
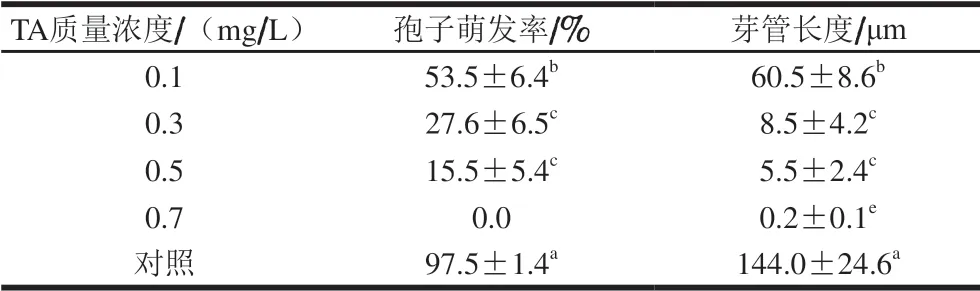
表 3 不同质量浓度的TA对炭疽菌孢子萌发的影响Table 3 Effects of different TA concentrations on the percentage of spore germination of C. gloeosporioides
由表3可知,不同质量浓度的TA可显著抑制炭疽病菌的孢子萌发和芽管伸长(P<0.05),且随TA质量浓度升高,抑制作用增强,当TA质量浓度为0.7 mg/L时,炭疽病菌孢子萌发完全受到抑制,此时芽管长度与C. gloeosporioides孢子直径接近。
2.5 TA对C. gloeosporioides孢子产生ROS的影响
在25 ℃下,采用单体TA处理6、12、18 h后,可检测到C. gloeosporioides孢子中的ROS生成情况(图4)。在培育6、12 h后,对照组中大约有67%、73%的孢子细胞被DCHF-DA染色,而处理组大约有73%、83%的孢子细胞被DCHF-DA染色。这些研究结果表明,单体TA处理能显著诱导C. gloeosporioides孢子中ROS的产生。
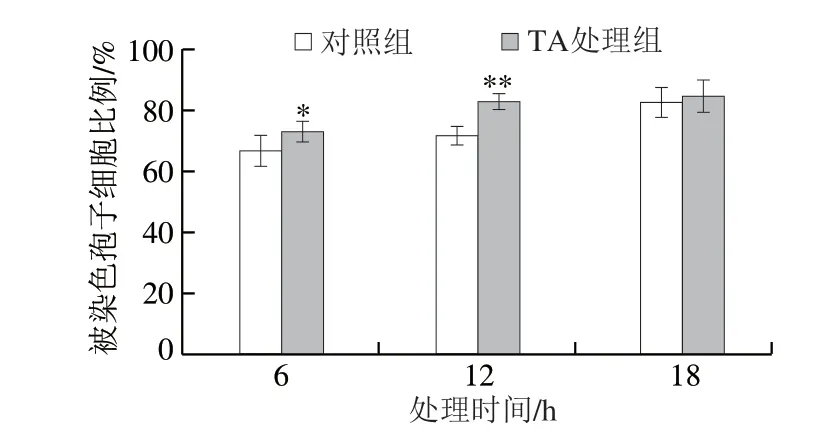
图 4 TA对炭疽病菌孢子中ROS产生的影响Fig. 4 Effect of TA on the generation of reactive oxygen in spores of C. gloeosporioides
2.6 TA对C. gloeosporioides菌丝体中MDA含量的影响
通过测定C. gloeosporioides菌丝体MDA含量,可以分析单体TA对C. gloeosporioides氧化损伤的影响。与对照组相比,单体TA处理6、12、18 h后,可以观察到C. gloeosporioides菌丝体中MDA含量较高(图5)。这说明单体TA加快了C. gloeosporioides的氧化损伤。
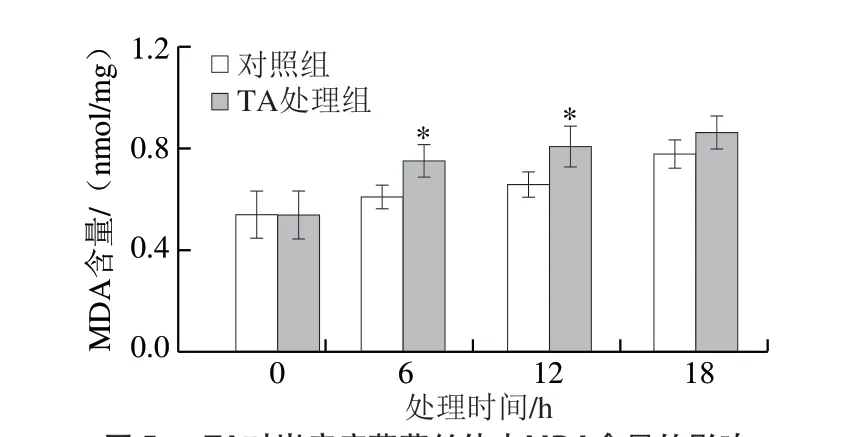
图 5 TA对炭疽病菌菌丝体中MDA含量的影响Fig. 5 Effect of TA on the MDA content of C. gloeosporioides
2.7 TA对C. gloeosporioides孢子中线粒体分布的影响

图 6 TA对炭疽病菌孢子中线粒体分布的影响Fig. 6 Effect of TA on the distribution of mitochondria in spores of C. gloeosporioides
如图6所示,培养2、6、12、18 h后,可以观察到对照组C. gloeosporioides孢子有丰富的线粒体且分布均匀,荧光强度较强;相比之下,线粒体在单体TA处理后的孢子中分布不均且局部聚集化,在用TA处理6、12、18 h后,大多数孢子内荧光十分微弱且线粒体很大程度地变黑,可能是处理组TA直接与孢子线粒体发生了作用,造成线粒体损坏。
2.8 TA对C. gloeosporioides孢子膜完整性的影响
为了测定在TA作用下C. gloeosporioides的生存力,对TA处理的孢子进行PI染色。在培养6、12 h和18 h后,对照组中孢子细胞膜完整性依次为98.5%、83.6%和65.7%,而TA处理组的孢子细胞膜完整性分别为73.4%、68.8%和43.6%(表4)。这些结果分析表明,TA对C. gloeosporioides孢子细胞膜有较大程度的损伤作用。

表 4 TA对炭疽菌孢子细胞膜完整性的影响Table 4 Effect of TA on the cell membrane integrity of C. gloeosporioides spores
3 讨 论
本实验以分离自广西岩溶区特殊环境的巨大芽孢杆菌的发酵液为原料,以采后芒果炭疽菌为靶标菌,采用纸片扩散法进行抗菌活性成分的追踪,采用色谱法分离出4 种单体化合物(001~004),其中的单体001抑菌活性最显著,此化合物001经质谱和核磁鉴定为TA。
近年来,茉莉酸及其衍生物如茉莉酸甲酯、茉莉酸乙酯、茉莉酮、二氢茉莉酸丙酯、TA等在食品工业上的应用备受关注[22]。许多研究者发现茉莉酸衍生物可以有效地减少蓝莓乙烯释放量[23]、降低蓝莓果实腐烂率[23]、增加鲜切菠萝的抗衰老活性[24],并且对葡萄炭疽病菌[25]、猕猴桃软腐病菌[26]和苹果青霉病菌[27]均具有较强的抑制作用。另外文献报道茉莉酸衍生物能与人类癌细胞线粒体作用,致使线粒体发生肿胀[28],其中的茉莉酸类化合物TA对临床上易被肿瘤患者感染的铜绿假单胞菌具有良好的抑制作用[29],同时其在热带地区的风味食品中常被用作调味剂[22]。因此推测具有抗菌效果的茉莉酸及其衍生物可以在食品微生物病害防治上安全使用。
然而截至目前为止,茉莉酸衍生物TA对采后芒果炭疽病菌抑制作用及其作用机理的相关信息有限。本实验发现巨大芽孢杆菌LB01产生的抗菌活性成分TA对采后芒果炭疽病害具有很好的控病效果,并对其抗病机理进行了初步探讨。
与对照组相比,5 mg/L TA对芒果采后炭疽病的发病率和严重程度均有显著影响(图3),表明TA对采后芒果果实炭疽病具有较强的抗病效果。此外,经TA处理后,病原菌菌丝生长和孢子萌发率也显著降低,同时随着TA质量浓度的增加,抑制作用也增强(表2、3)。
ROS可能对细胞中化合物造成氧化损伤,导致细胞功能障碍甚至细胞死亡[30-31]。在所有细胞中,ROS的产生和清除在细胞内保持平衡。氧化还原动态平衡要求不同细胞间的有效协调,并受复杂的信号传导路径控制[32]。细胞内存在一系列抗氧化剂,其可以清除ROS,保护自身免受氧化损伤。本研究结果表明,用5.0 mg/L TA处理的芒果炭疽菌显示出更高的MDA含量(图5)。此外,用一种氧化剂敏感探针DCHF-DA研究了芒果炭疽菌孢子中ROS的积累,发现经5.0 mg/L TA处理的孢子染色细胞比例高于对照组(图4)。这些结果表明,化合物TA能诱导炭疽菌的孢子中ROS的积累及菌丝体内MDA含量的升高,从而抑制孢子萌发和菌丝体生长,这可能是化合物TA防治采后芒果炭疽病、抑制采后芒果炭疽病菌生长的机制之一。
线粒体是细胞ATP的主要产生部位,在多种细胞过程中起着核心作用[33-34],此外,线粒体呼吸活动也是ROS的主要内生源,其积累可导致生物大分子氧化,导致mtDNA突变、衰老和细胞凋亡[35-36]。在本研究中,还发现线粒体在化合物TA处理后的孢子中发生异常分布和较大程度的损坏(图6),表明化合物TA处理可引起C. gloeosporioides孢子线粒体损伤。病原菌孢子的ROS积累和线粒体损坏可能是化合物TA抑制C. gloeosporioides生长的重要方式之一,从而抑制采后芒果果实炭疽病的发生。
5.0 mg/L TA处理接种了C. gloeosporioides孢子悬浮液的芒果7 d和14 d后,芒果果实仍呈黄色,但对照组芒果果实已变为橙色(图3A),表明TA在芒果采后衰老控制中的起重要作用。芒果是一种对乙烯敏感的水果,在衰老过程中呼吸作用与乙烯产生量显著增加[37],乙烯在植物种子萌发、植物生长、果实成熟、器官脱落和衰老以及抗病性等生理过程中起着重要作用[38]。本实验中,经活性筛选到的化合物TA可能抑制了芒果中乙烯的产生或阻止乙烯与炭疽菌受体的结合,减少了芒果腐烂,使芒果果实炭疽病的症状大大降低。而对照组芒果体内乙烯自由释放以致芒果后熟与衰老加快。因此,延缓芒果果实衰老也可能是化合物TA抑制采后芒果炭疽病害的机制之一。
综上,本研究从特殊环境巨大芽孢杆菌发酵液中分离的抗菌活性单体001,经质谱和核磁等波谱解析,鉴定其为TA,并证明其可通过直接抑制芒果炭疽菌孢子萌发和菌丝生长,从而抑制芒果采后炭疽病的发生。本研究结果为TA对炭疽菌的抑制作用机制提供了一个框架,为芒果采后病害防治提供了一种有前景的策略。至于抗菌活性成分TA是通过何种方式作用于病原菌,还有待于进一步深入研究。

