短期高剂量食用油摄入对小鼠脏器系数与胃肠动力的影响
郑 淘 何云山 -
(湖南中医药大学药学院,湖南 长沙 410208)
食用油含有多种脂肪酸,为人体提供能量和必需脂肪酸,是人体重要结构组成的基础原料。脂肪酸可大致分为饱和脂肪酸(SFA)、不饱和脂肪酸(UFA)以及反式脂肪酸(TFA) 3大类,其中不饱和脂肪酸又可分为单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)[1]。生活中常食用的大豆油、花生油等植物油主要是以不饱和脂肪酸为主[2]。研究[3]表明,不同种类的脂肪酸各有优缺点,通过脂肪酸平衡配比能很好地综合各类油脂的优点,同时弥补各自的缺点。试验采用的油脂为人们日常生活中常食用的第二代食用调和油,其SFA∶MUFA∶PUFA=0.27∶1∶1,PUFA(n-6)∶PUFA(n-3)=5∶1。
调查[11-12]显示,中国居民食用油的实际摄入量约为42.1 g,远远超过《中国居民膳食指南(2016)》的推荐用量(25~30 g/d)。食用油摄入过高可能导致机体肥胖,引发腹泻从而影响肠道消化吸收,引起糖脂代谢异常等[13-14]。目前有关食用油脂的研究侧重于油脂的理化性质以及脂代谢方面,忽略了对胃肠动力以及脏器系数这些简单而又基础的研究。试验拟以人们日常生活中最常食用的植物调和油为对象,分析短期大剂量摄入食用油对小鼠脏器系数、肠推进率、胃排空率以及D-木糖吸收的影响,从胃肠功能角度研究食用油摄入对机体脏器及消化吸收的影响,以期为合理膳食提供依据,同时也为后续食积动物模型构建中油脂的选择及用量提供参考。
1 材料与方法
1.1 材料
1.1.1 试验动物及原材料
SPF级昆明小鼠:10只,体质量约为(20±2) g,雄性,动物生产许可证编号SCXK(湘)2016-0002,饲养于湖南中医药大学动物实验中心,设施使用许可证编号为SYXK(湘)2019-0009,湖南斯莱克斯实验有限公司;
食用调和油:市售;
半固体营养糊:5 g羧甲基纤维素钠+12 g奶粉+4 g白砂糖+4 g淀粉,加入蒸馏水定容至150 mL,微加热搅拌至溶,4 ℃冰箱保存备用;
印度墨汁:微蒙生物科技(上海)有限公司;
D-木糖:分析纯,上海悠祥生化试剂有限公司;
式中,表示Sk|k-1的n行前t列元素组成的矩阵。最后,在Xk,Pk输出时,再次反向调整矩阵中元素的顺序。
D-木糖试剂盒:南京建成生物科技有限公司。
1.1.2 仪器与设备
离心机:TDZ5-WS型,长沙湘仪离心机仪器有限公司;
紫外可见光光度计:TU-1900型,北京普析通用仪器有限责任公司;
精密电子天平:JA3003型,上海恒平科学仪器有限公司。
1.2 方法
1.2.1 动物分组 小鼠常规适应性饲养5 d后称重,按随机数字表法进行配对分组,并用苦味酸进行标记:正常组、食用油组各5只。
1.2.2 给药方法及剂量 参照文献[15],《中国居民膳食指南(2016)》中推荐油脂的摄入量为25~30 g/d,换算为小鼠剂量为0.10~0.11 mL/d,在前期研究的基础上,选择对肠道影响较大的高剂量0.6 mL/d作为试验剂量,约为推荐摄入量的6倍[16]。适应性喂养结束后分组,正常组灌胃等量的蒸馏水,食用油组灌胃食用调和油,每天2次,每次0.3 mL,持续13 d。
1.2.3 小鼠胃肠动力的测定 参照文献[17],0.2 mL印度墨汁+0.4 mL半固体营养糊灌胃20 min后处死小鼠,结扎幽门、贲门和回盲部,分离肠系膜,取出整个胃、小肠。
(1) 胃排空:解剖后的胃用生理盐水清洗血渍,滤纸吸干,称重,沿胃大弯剪开,用生理盐水冲洗胃内容物,滤纸吸干,再次称重。按式(1)计算胃排空率。
(1)
式中:
C1——胃排空率,%;
A——胃全重,g;
B——胃净重,g。
(2) 炭末推进率:剖腹取出幽门至回盲部肠管,铺直后用卷尺测量幽门至回盲部全长和幽门—黑色半固体营养糊前端长度,按式(2)计算炭末推进率。
(2)
式中:
C2——炭末推进率,%;
A——墨汁长度,cm;
B——小肠全长,cm。
1.2.4 血清D-木糖测定 禁食不禁水12 h后,各组小鼠随机选取4只按10 mL/(kg·d)灌胃5%D-木糖溶液,60 min后采用抗阻法摘取眼球取血,置于1.5 mL EP管中,静置1 h,3 500 r/min离心15 min,取上清液于4 ℃冰箱保存,按D-木糖试剂盒说明书进行操作,应用UV法分析测定各组小鼠血清D-木糖含量[18]。
1.2.5 脏器系数测定 参照文献[19]。
1.2.6 统计学分析 采用SPSS 21.0统计软件进行数据分析,结果以均数±标准差表示。两组间均数符合正态性、方差齐性用独立样本t检验进行比较,否则运用非参数检验进行比较。P<0.05为显著差异,P<0.01为极显著差异。
2 结果与分析
2.1 对小鼠一般状态的影响
与正常组相比,灌胃食用油组小鼠的毛发、精神状态以及粪便稀湿等方面无显著差异。由图1可知,食用油组小鼠的食量低于正常组,而饮水量高于正常组,与文献[13]的症状相似。体重方面,食用油组小鼠稍高于正常组,但两组间无显著性差异,与文献[15]的结果相反。造成食用油组小鼠饮食量下降、饮水量增高的原因可能与摄入油脂剂量高、容易造成饱腹感有关。而食用油组小鼠体重较正常组稍高,可能是由于摄入高剂量植物油,增加了饮食中的脂肪来源,造成脂肪吸收高于正常组,导致体重增加。综上,短期高剂量的食用油摄入对小鼠饮食、饮水量影响较小,但可能造成机体肥胖。

图1 食用油对小鼠体重、食量与饮水量的影响
2.2 对小鼠脏器系数的影响
由图2可知,食用油能降低小鼠的肝脏系数、脾脏系数和胸腺系数,但与正常组相比二者无统计学意义(P>0.05)。食用油对小鼠的影响可能与血脂代谢异常有关,摄入大量的脂类物质容易造成血液中游离脂肪酸(FFAs)增多,使肝脏合成及释放的极低密度脂蛋白胆固醇(VLDL-c)、甘油三酯(TG)增多,容易损伤肝脏[20]。

图2 食用油对小鼠脏器系数的影响
高珊等[21]研究发现,6种食用油均能使大鼠肝脏质量下降,肝体比、肾体比与脾体比显著降低(P<0.05),且食用油能导致小鼠出现轻微的自发感染病变和肝脏小点状肝细胞坏死,与试验结果存在差异,其原因可能是由于研究时间不同。故短期高剂量摄入油脂对小鼠脏器系数影响较小,但长时间较高剂量摄入油脂会损伤机体脏器。n-6型脂肪酸在体内代谢产生花生四烯酸(AA),AA是合成白三烯(LT)、前列腺素(PG)、血栓烷素(TXA)等炎性物质的前体物质[22]。大剂量的摄入食用油可能导致AA增多,进而导致LT、PG、TXA等炎性物质增加,损伤机体的免疫系统。试验使用的调和油中PUFA(n-6)∶PUFA(n-3)=5∶1,AA含量较高,但其对肝脏、脾脏和胸腺指数影响较小,可能是由于机体的应激反应加速了AA的代谢,且刺激时间短,所以对机体脏器指数影响不显著。
2.3 对小鼠肠推进、胃排空以及血清D-木糖吸收的影响
由表1可知,食用油组的肠推进率高于正常组,胃排空率和血液中的D-木糖含量则低于正常组,但三者无统计学差异(P>0.05)。小鼠血液中D-木糖含量反映机体对碳水化合物的消化吸收情况,小鼠胃肠动力的影响可以从胃肠平滑肌离子通道和肠道菌群加以解释。食用油的主要成分为脂肪酸,在一定程度上能降低肠道中的pH,有益于双歧杆菌等益生菌的生长。研究[23]显示,AA可通过作用于离子通道蛋白,改变通道蛋白构象,抑制瞬间外向K+电流,进而对平滑肌的肌源性收缩与舒张起到调节作用。崔艺峰[24]研究发现,AA等不饱和脂肪酸能抑制毒蕈碱电流,且存在量效关系,并且随着不饱和脂肪酸不饱和程度的增高,其抑制效果增强。肠道菌群参与机体对食物的消化、吸收及代谢等活动,脑—肠—菌轴理论中对胃肠动力的调节主要是通过脑肠肽来完成。动物试验[25-26]表明,双歧杆菌可诱导大鼠神经递质多巴胺、5-HT,血浆浓度升高,促进肠道蠕动。食用油对小鼠肠推进、胃排空和血清D-木糖影响不显著,可能是由于食物的消化吸收依赖于肠道微生物的活动,短时间高剂量的食用油摄入对小鼠肠道菌群结构的改变较小,从而导致小鼠对食用油的代谢与正常组小鼠差别不大。
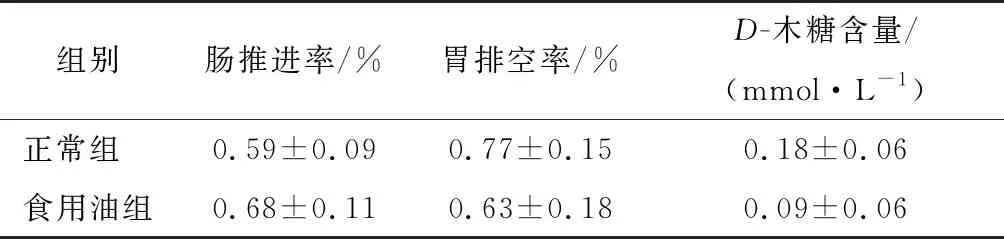
表1 食用油对小鼠肠推进、胃排空以及血清D-木糖吸收的影响
3 结论
试验表明,大量摄入食用油脂会抑制人体的免疫以及营养吸收,且会稍加快小肠推进速率,增加腹泻的风险,但与正常组相比,二者的差异均不显著,表明短期高剂量植物油的摄入对机体的脏器及吸收代谢影响较小。后续拟开展高剂量长时间的油脂摄入对小鼠脏器系数和胃肠动力的影响研究,同时,可借助16S rDNA测序技术与Elisa酶联免疫法,分析高剂量食用油摄入对小鼠肠道菌群多样性的影响,以及胃肠激素水平的改变,以便更全面地评价高剂量食用油摄入对机体脏器及消化吸收的影响。

