青梗菜速俊109杂交种纯度SSR分子标记鉴定
范伟强,王超楠,黄志银,李 梅,张 红,郑思宇,徐营莉,华德平
(1.天津科润蔬菜研究所,蔬菜种质创新国家重点实验室,天津市蔬菜遗传育种企业重点实验室,天津 300381;2.天津师范大学生命科学学院,天津 300387; 3.天津大学生命科学学院, 天津 300072)
青梗菜(BrassicarapaL.SSP. chinensis),是小白菜的一种,原产于中国,因其具有生长期短、商品性好、方便烹饪、味道鲜美等优点,深受人们喜爱,广泛种植于世界各地。
种子纯度是种子质量的重要指标之一,直接影响品种产量及商品性。种子纯度鉴定方法有很多,长期以来,形态学鉴定是重要的鉴定方法之一,此方法简单、直观,但存在周期长、易受环境影响、表型特征判断不易把握等缺点[1]。同时,由于选育品种数目逐年增多及育种材料来源狭窄的影响,不同品种间的差异越来越小,可供品种鉴定用的特征性状越来越少,经常出现形态学鉴定法难以满足实际应用需要的问题[2]。另外,很多品种还存在严重的休眠问题,更延长了纯度鉴定周期,影响种子及时销售。
近年来,分子标记鉴定方法被广泛应用于种子的纯度鉴定工作中,与形态学鉴定法相比,具有稳定、准确、快速等优点[3]。其中,SSR具有多态性丰富、重复性高、结果稳定可信等优势,是被广泛应用的分子标记之一[4]。目前,SSR分子标记已被成功应用于包括甘蓝型油菜、萝卜、棉花、玉米、水稻、大豆等[5-10]多种作物的种子纯度鉴定中。速俊109是一个优质的青梗菜品种,具备株型直立、叶色绿、光泽度好、早熟高抗、适应性广等特点,得到了市场的认可。但速俊109的种子休眠严重,无法通过形态学及时进行纯度鉴定,本研究以SSR分子标记技术为基础,设计筛选合适的引物,以期为速俊109种子纯度鉴定提供快速、高效的解决方法。
1 材料与方法
1.1 试验材料
青梗菜速俊109杂交种及其父本、母本;8份青梗菜速俊109杂交种样品。试验材料均由天津科润蔬菜研究所大白菜研究室提供。
参考白菜基因组序列信息,设计72对SSR引物,使用Primer Premier 5.0软件设计,由华大基因公司合成。
1.2 田间鉴定与DNA提取
供试材料播于试验田,每份约2 000株,常规田间管理。待其长到7~9片真叶时,根据叶形、叶色、株型等形态特征进行纯度调查统计。每份分为2个部分,第1部分为480株,在对应编号畦中顺序调查,不挑选,统计假杂株(父本、母本及其他杂株)数,并取所有材料的心叶于离心管中,用于DNA提取;其余为第2部分,统计假杂株(父本、母本及其他杂株)数与检测总数。
青梗菜速俊109杂交种及其父本、母本采用CTAB法提取DNA;8份青梗菜速俊109杂交种样品采用碱裂解法提取DNA[11]。
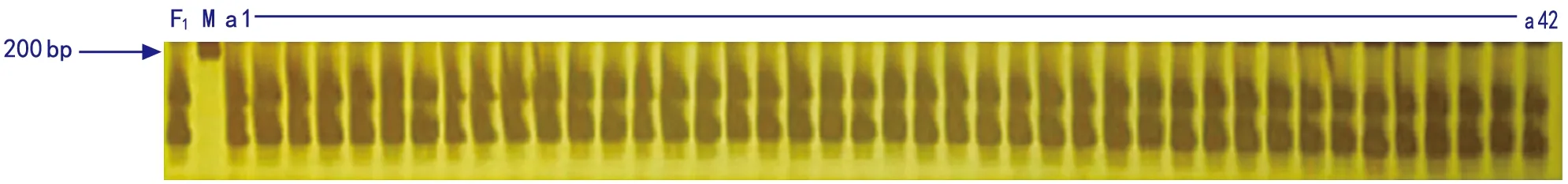
注: F1为杂交种;M为DNA markerⅠ;a 1~a 42为F1代杂交种样品。图2 引物扩增结果
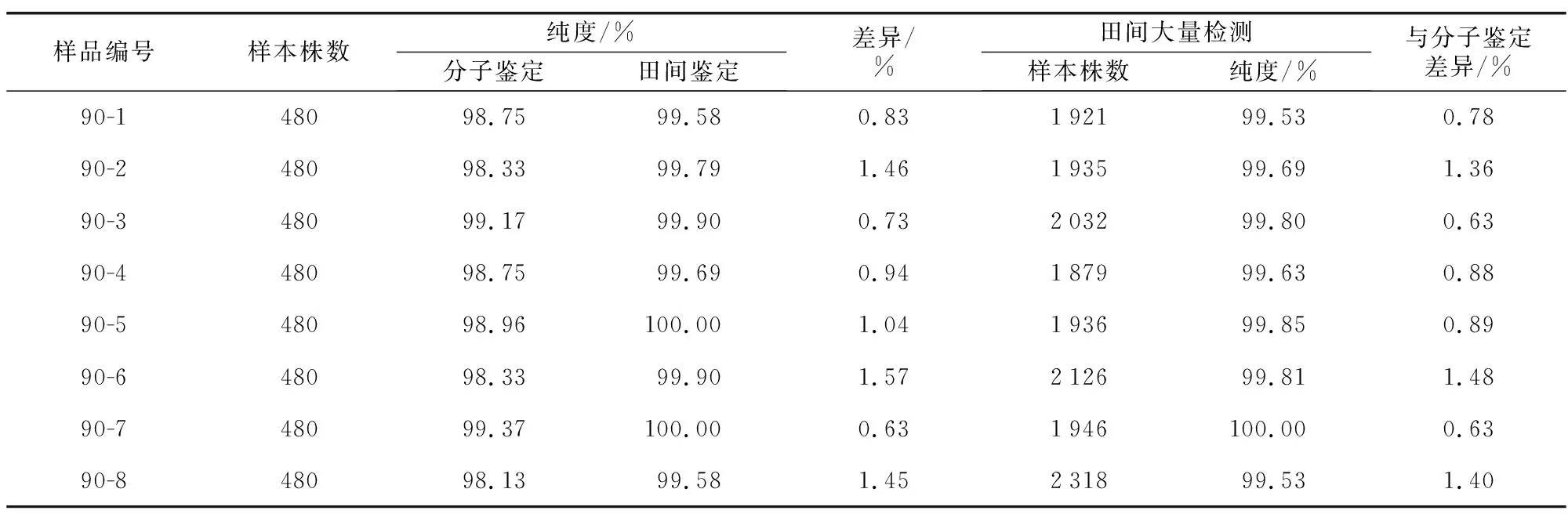
表1 分子标记技术鉴定结果与形态学鉴定结果对比
1.3 引物筛选
设计SSR引物72对,在青梗菜速俊109杂交种及其父本、母本之间筛选,筛选出具有多态性的引物。
PCR扩增反应体系:DNA模板2μL,正、反向引物各0.4μL,2×TaqMaster Mix 5μL,灭菌去离子水2.2μL。
PCR反应程序:94 ℃开始预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。
PCR产物用聚丙烯酰胺凝胶电泳分离,银染,统计结果[12]。
1.4 数据分析
分子鉴定纯度(%)=[(检测株数-母本带型数-父本带型数-其他杂带型)/检测株数]×100%;
田间鉴定纯度(%)=[(检测株数-父本株数-母本株数-其他杂株数)/检测株数]×100%。
2 结果与分析
2.1 引物筛选结果
对72对SSR引物在青梗菜速俊109杂交种及其父本、母本间进行筛选,其中QGC-A 07-44引物对在双亲间及F1杂交种间表现出共显性差异,条带清晰、明显,可用于纯度鉴定。引物筛选结果如图1,引物序列如下:
A 07-44-F:5′- ACT AAT TGG CAA TTA GTG GAT TGA CCC AAG-3′
A 07-44-R:5′- ACA AGA TCC TTG GTC CGA CAG AAA C-3′

注:1为父本;2为母本;F1为杂交一代。图1 特异性引物筛选结果
2.2 杂交种纯度SSR鉴定
利用引物QGC-A 07-44对8份青梗菜速俊109杂交种样品进行纯度鉴定,每份取480个样本,典型条带如图2。其中对应的不符合F1带型的条带(包括父本、母本、其他带型)的数量分别为:6、7、4、6、5、8、3、9,计算出纯度分别为:98.75%、98.33%、99.17%、98.75%、98.96%、98.33%、99.37%、98.13%(表1)。
2.3 分子标记技术鉴定结果与形态学鉴定结果对比
利用形态学鉴定法对8份青梗菜速俊109杂交种样品进行田间鉴定。480株部分的假杂株(父本、母本及其他杂株)数量分别为:4、2、1、3、0、1、0、4,对应的纯度结果与分子标记技术鉴定结果相比较,差异分别为:0.83%、1.46%、0.73%、0.94%、1.04%、1.57%、0.63%、1.45%(表1),偏差≤2%;8份杂交种样品的检测总株数分别为:1 921、1 935、2 032、1 879、1 936、2 126、1 946、2 318,其中假杂株(父本、母本及其他杂株)数总量分别为9、6、4、7、3、4、0、11,对应的纯度结果与分子标记技术鉴定结果相比较,差异分别为:0.78%、1.36%、0.63%、0.88%、0.89%、1.48%、0.63%、1.40%(如表1),偏差≤2%。
3 结论与讨论
在种子生产过程中,品种多种多样、繁种量巨大往往是现代育种工作中商品种种子纯度鉴定工作的背景,采用形态学鉴定法鉴定种子纯度,周期长且繁琐,同时需要大面积土地和大量农资作为物质基础,还易受天气等外界因素的影响,本研究实现了利用分子标记技术鉴定青梗菜速俊109杂交种的纯度,与形态学鉴定法相比,结果偏差≤2%,符合误差允许范围[13],解决了通过传统形态学鉴定法鉴定种子纯度时面临的不足,提高了工作效率,保证了种子质量。
本研究中,选取的单个样本检测数量为480,考虑到检测结果的可靠性,以及时间、耗材的成本,最佳检测样本容量需要进一步试验研究[14]。另外,利用分子标记技术鉴定纯度结果略低于利用形态学鉴定的结果,可能是由于基因水平的差异不一定会导致表型性状的差异,需要进一步探索研究。
长远来看,我国种子经营主体数量众多,尽管相关部门对种业市场严格监管,但销售假冒伪劣种子、非法套牌现象时有发生。所以,保证种子货真价实、保护育种者合法权益至关重要,分子检测技术不仅可以检测杂交种的纯度,也可以实现种子真实性的检测,为解决这些问题提供了有效的途径,成熟分子检测体系的建立将促进我国种业的健康发展。

