土壤氮水交互对马尾松和杉木COS和CO2通量的影响
刘燕飞,张 羽,赖金美,林 威,黄幸然,方 熊,易志刚
福建农林大学资源与环境学院/土壤环境健康与调控福建省重点实验室, 福州 350002
羰基硫(carbonyl sulfide, COS)是对流层中含量最高的含硫气体[1],COS的光解作用和氧化作用会促进平流层硫酸盐气溶胶层的形成,从而影响大气环境。植物吸收是COS最重要的汇,是全球COS循环不可或缺的一环。COS与CO2化学结构式类似,研究表明植物在光合作用期间,叶片中的CO2和COS遵循的路径一致[2],并受到相同的物理扩散影响;同时植物光合作用过程中参与CO2同化过程的酶也会消耗COS,在酶的作用下COS与H2O反应生成CO2和H2S,此过程为不可逆反应[3]。由于植物能同时吸收COS和CO2,且COS和CO2之间存在强相关性,COS成为极具潜力的CO2示踪物质,可用于估算生态系统总初级生产力(GPP)[4-5]。因此,COS在生态系统碳循环中同样扮演重要的角色。若想估算GPP,植物对COS和CO2吸收通量的比值,即FCOS/FCO2至关重要[4],由于该参数受植物种类和环境因子影响[6],使得估算GPP难度加大。不同树种间由于其对氮水环境的适应性、敏感程度与其本身生理指标的差异性,包括酶种类[7]、酶活性和气孔导度[8]等,导致植物气体交换能力存在差异[9],从而使得不同氮水条件下植物对CO2的吸收能力不同,由于植物COS与CO2存在共吸收关系,植物对COS的吸收能力同样有可能改变。有研究表明不同生态系统和不同植物的COS和CO2沉积速率比也有所不同,热带季节性森林、温带落叶林和温带常绿林的分别为1.7—3.6、1.5—2.9和1.7—3.0[10]。因此研究不同植物在不同环境因子下的FCOS/FCO2有重要意义。
影响植物与大气COS交换的环境因素较多,主要包括大气CO2浓度、温度、水分和土壤养分等。由于全球降水格局的改变和氮沉降量的时空分布不均,导致土壤水分和氮素成为影响植物生长发育与植物和大气间COS交换的重要因素。土壤水分的改变会影响植物蒸腾作用(Transpiration,Tr)和蒸汽压亏缺(Vapor pressure deficit, VPD),从而导致气孔形态和气孔导度(Stomatal conductance,Gs)变化[11],进而影响光合作用和CO2的扩散。Cano等[8]研究发现随着干旱程度的增加,低浓度的叶绿体CO2会导致代谢发生变化从而进一步损害光合作用。Osakabe等[12]研究发现气孔活动受环境胁迫的影响,从而影响CO2吸收,进而影响光合作用和植物生长。与CO2类似,植物COS通量也与气孔紧密相关,Seibt等[2]对叶片吸收COS进行动力学分析发现植物吸收COS与气孔导度直接相关;Sun等[13]研究淡水沼泽香蒲(Typha)气孔对COS和CO2通量的控制发现香蒲气孔导度的变化会影响香蒲的COS通量。土壤氮素的增加,可能导致植物氮吸收量增加,从而影响植物生理生化活动,而目前大气氮沉降增加是影响土壤氮含量的一个重要因素。Jing等[14]研究新疆干旱地区棉花田发现施氮能促进棉花COS交换,另有研究表明氮沉降会影响植物的生物量产量和光合速率(Photosynthetic rate,Pn)[15],氮沉降的增加影响植物气孔导度和蒸腾速率[16],而无论是光合速率还是气孔导度都是影响植物CO2和COS通量的重要因素[17]。
虽然现阶段关于植物COS通量的研究较多,但大多集中在大尺度或区域性生态系统尺度上,而关于植物COS通量对水分胁迫和氮添加的响应的研究较缺乏。因此植物COS通量对水分胁迫和氮添加的响应如何,氮水条件变化情况下植物COS通量与CO2通量的比值(FCOS/FCO2)如何变化,变化又是如何产生尚不清楚,这些不确定性可能使得估算区域乃至全球总初级生产力时出现不小的偏差。故本研究以南亚热带先锋树种马尾松(Pinusmassoniana)和南亚热带人工林种植面积最大的杉木(Cunninghamialanceolata)作为研究对象,研究不同水分和是否施氮情况下两种树种的生理指标和COS以及CO2通量的变化情况,分析马尾松和杉木FCOS/FCO2对环境因子变化的响应情况。结果可为南亚热带地区植物COS通量提供数据参考,并可为GPP模型估算的精确化提供数据支撑。
1 材料与方法
1.1 实验材料和设计
于2017年10月在温室建设18个长宽高为1 m×1 m×0.6 m的水泥坑,方形坑四周和基座为砖混结构并贴瓷片。基座底部设置1个直径2 cm 的出水孔并通过PVC导管收集土壤淋滤水。2017年11月将从野外自然林运来的红壤捡出粗根和石块后混匀并填入方形坑,填土深度为0.5 m并静置稳定1个月,于2017年12月将马尾松和杉木1年生幼苗移入方形坑土柱中。缓苗4个月后,于2018年4月进行氮水交互处理,其中氮处理分施氮(AN,80 kg N hm-2a-1)和未施氮(CK,0 kg N hm-2a-1);每个氮处理又设置3个土壤水分梯度处理,分别为低水分(LW,40%最大持水量,Maximum water holding capacity,MWHC)、中等水分(MW,60% MWHC)和高水分(HW,80% MWHC),一共6个处理。各处理设置3个重复并随机分布。氮添加以硝酸铵为氮源,每月定期将1.905 g硝酸铵溶于5 L水中施于施氮处理土柱中,未施氮组则利用自动喷水装置喷水5 L。每周定期测定土壤体积含水量,并根据土壤容重和方形坑体积估算水分损失,然后通过流量控制器调节补充水分损失,使土壤水分含量达到要求。
1.2 样品采集与分析
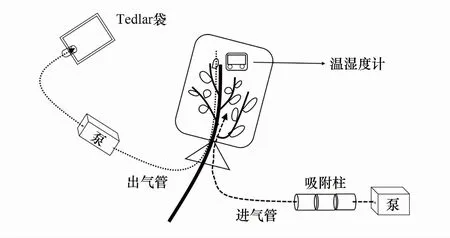
图1 采样装置示意图Fig.1 Schematic diagram of sampling device
于2018年11月30日—12月1日进行样品采集。
气体采集:在晴朗的天气下(9:00—16:00),选择相同处理的2年生无附属物且长势相近的枝条,用Teflon袋将其套住,使用活体植物动态顶空套袋法进行采样(图1)。具体如下:首先,将采样装置平放于待测植株附近并保证管路连接无误,采样开始时打开气泵,使气泵(10L—D,大连德霖气体包装有限公司)将干洁的零空气(依次经过硅胶、碘化钾和活性炭)通入套住枝条的Teflon袋(透光率在95%以上)中,等袋中植物与气体稳定后(30 min),在出气端采集1000 mL气体至Tedlar袋中,并及时上机检测Tedlar袋中的COS和CO2气体浓度。采样前,在距土柱不远处设置一个未放置植物的空袋子,其余采样条件与有植物情况保持一致,以此作为大气空白。采样装置共4套,采样为多人同时采样,通过计时器统一采样时间。采样期间通过悬挂于待测枝条上的温湿度计(RC—4HC,中国精创Elitech)实时记录采样袋内的温湿度情况,采样结束后将数据导出并取植物稳定期间温湿度的平均值,用于计算气体通量。采样期间使用光合有效辐射仪(Model MQ—500,Apogee instruments,The USA)测量Teflon袋四周光照强度。气体采集结束后,使用便携式光合作用测量系统(LiCor—6400,LI—COR Biosciences,The USA)测量马尾松和杉木光合参数,由于马尾松枝干较粗且松针较长,因此采用阔叶叶室测量马尾松光合参数:先将马尾松枝条上的松针梳理好,然后将大约20根长短大小相近的马尾松松针并排平铺于阔叶叶室上,使叶室测量面保持铺满状态,再按下叶室把手将松针夹紧并开始测量;杉木光合参数采用簇状叶室测量:选取杉木枝条主干处叶片长势均匀的部分,保持杉木叶片基本铺满叶室测量面,再关紧叶室开始测量。每株植物均选取3—5处进行光合参数测量。详细操作步骤:将光强设置为1000 μmol m-2s-1,流速设置为500 μmol/s。等待仪器达到稳定状态:光强、流速、样品室和参比室的二氧化碳浓度等参数稳定;单位时间里CO2值波动小于0.2 μmol/mol;光合速率参数稳定在小数点之后一位;气孔导度、胞间二氧化碳浓度(Intercellular carbon dioxide concentration, Ci)和蒸腾速率参数均大于0。然后记录稳定状态下的植物叶片光合参数(包括净光合速率、气孔导度、胞间二氧化碳、蒸腾速率和蒸汽压亏缺)。马尾松叶面积测量方法:按顺序将松针梳理好,选取20根以上松针排列整齐(不摘下松针),用手持式叶面积仪(CI-203,CID Bio-Science,The USA)夹住排列好的松针,从松针末端开始向松针顶端移动直至仪器扫描完成,重复3次,以此方法依次测量枝条剩余松针面积,导出数据并计算目标枝条总叶面积;杉木叶面积测量方法:由于杉木枝条叶片排列整齐且质地较硬,可直接用叶面积仪从枝干尾端向前端移动,直接测量整个枝条叶面积,每个枝条测量重复3次,减少操作带来的误差。
样品分析:本研究采用预浓缩-气质联用法(Entech 7200-7890B-5977A)分析COS样品,CO2样品采用CA-6气体样品进样仪(Agilent 7890B)分析,具体方法及参数设置参照林威等[18]。
1.3 数据分析及处理
通量计算:
式中,F为植物COS或CO2通量,单位分别为pmol m-2s-1和μmol m-2s-1;C0和C1分别为空白袋和样品袋中COS体积分数(10-12)或CO2体积分数(10-6);f为进气流量,单位为L/s;A为植物叶面积,单位为m2;Vm为标准状况下的气体摩尔体积,为22.4 L/mol;T为大气温度,单位为℃。
数据处理:采用SPSS 19单因素方差分析对光合参数和COS通量差异进行显著性分析(Duncan法),土壤施氮和土壤水分及其交互作用对马尾松和杉木的气体通量和光合参数的影响则采用双因素方差分析。采用双变量相关性分析对COS与CO2通量相关性进行显著性分析。使用Sigmaplot 12.5作图。
2 结果
2.1 植物光合速率及相关参数
由表1知,马尾松未施氮组与施氮组不同土壤水分处理下的光合速率均表现为:中等水分处理>高水分处理>低水分处理。杉木在未施氮组中等水分处理的光合速率高于低水分和高水分处理,而施氮组中等水分处理光合速率则小于低水分和高水分处理,但均无显著性差异。对于不同处理下的气孔导度,杉木和马尾松在未施氮组和施氮组的气孔导度均表现为中等水分处理>高水分处理>低水分处理,且马尾松未施氮组和施氮组低水分处理气孔导度显著低于中等水分和高水分处理气孔导度(P<0.05)。此外,杉木和马尾松在相同水分处理下的气孔导度均表现为施氮组高于未施氮组。
通过表2可以看出,土壤氮水平对马尾松COS通量和杉木蒸腾速率有显著性影响(P<0.05),土壤水分对马尾松气孔导度、胞间二氧化碳浓度、蒸腾速率和杉木胞间二氧化碳浓度有显著性影响(P<0.05),但土壤氮水交互作用对马尾松和杉木各参数无显著性影响。

表1 土壤氮处理和水分梯度对马尾松和杉木光合参数的影响(平均值±标准偏差,n=3)

表2 马尾松和杉木气体通量以及光合参数的双因素方差分析结果(n=3)
2.2 马尾松和杉木COS通量
马尾松施氮组高水分处理COS通量((-127.27±6.85) pmol m-2s-1)和未施氮组高水分处理COS通量((-95.41±25.38) pmol m-2s-1)均高于其余水分处理。杉木未施氮组中等水分处理下COS通量低于高水分和低水分处理,施氮组同样有此规律(图2)。马尾松和杉木施氮组不同土壤水分处理COS通量均高于未施氮组相应土壤水分处理。
马尾松施氮组中等水分和高水分处理的COS通量显著高于未施氮组中等水分处理(P<0.05)。而杉木施氮组低土壤水分处理COS通量((-66.92±19.81) pmol m-2s-1)和高水分处理COS通量((-59.41±39.48) pmol m-2s-1)均显著高于未施氮组中等水分处理(P<0.05),说明土壤氮水交互作用下杉木COS通量增加。

图2 不同氮水处理下马尾松和杉木COS通量Fig.2 Flux of carbonyl sulfide in P. massoniana and C. lanceolata in different nitrogen treatmentsCOS:羰基硫,Carbonyl sulfide;不同大写字母表示不同处理间显著性差异(P<0.05)
2.3 植物COS与CO2通量及其与植物光合参数相关关系
马尾松施氮组与未施氮组中等水分处理FCOS/FCO2(分别为3.42×10-6和5.87×10-6)比其余水分处理高。杉木未施氮组低水分处理的FCOS/FCO2均值(6.15×10-6)比其余水分处理高,施氮组则表现为高水分处理FCOS/FCO2均值(2.36×10-6)较高。此外,马尾松施氮组中等土壤水分处理FCOS/FCO2均值低于未施氮组,而杉木施氮组中等土壤水分处理下杉木FCOS/FCO2均值高于未施氮组(图3)。
由图3知,马尾松和杉木COS通量与CO2通量呈极显著正相关(P<0.01)。线性拟合结果表明,马尾松FCOS/FCO2值汇聚于1.48×10-6,而杉木FCOS/FCO2值则汇聚于1.01×10-6。
通过表3可以看出,除低土壤水分条件下马尾松CO2通量和杉木COS通量与气孔导度呈负相关外,马尾松和杉木的CO2通量和COS通量均与气孔导度呈正相关关系。但总体上马尾松和杉木COS通量和CO2通量及其比值与植物净光合速率和气孔导度间均无显著相关性。

图3 马尾松和杉木COS与CO2通量比值以及相关性Fig.3 The ratios and correlation between COS and CO2 flux in P. massoniana and C. lanceolata
3 讨论3.1 氮水耦合对马尾松和杉木光合的影响
土壤水分是影响植物生理生态的重要环境因子,而植物的气孔调节功能是植物适应土壤水分环境变化的重要手段,通过控制和优化植物叶片与大气之间的CO2、水汽等气体交换来调节植物体内的碳水平衡。而植物气孔导度与VPD存在紧密联系,通常气孔导度随着VPD的增大而降低,反之升高[19]。本研究结果显示相对于中等土壤水分处理,在未施氮条件下低土壤水分和高土壤水分将导致马尾松与杉木光合速率降低;在施氮条件下低土壤水分和高土壤水分依然抑制马尾松光合速率;但不同处理下马尾松和杉木净光合速率无显著性差异(表1)。王海珍等[20]研究灰胡杨(PopuluspruinosaSchrenk)幼苗对土壤水分梯度的响应结果表明干旱抑制光合速率,而邓秀秀等[21]研究也发现干旱抑制马尾松净光合速率,这与本研究中马尾松的光合响应一致,这可能是由于马尾松在低土壤水分条件下的高VPD使气孔导度降低导致(表1)。有研究表明植物在涝渍情况下的生理变化与植物通气组织和可溶性糖的形成有关[22],Addingtong等[23]研究发现相较于在干旱环境下生长的长叶松(PinuspalustrisMill.),湿润环境下生长的长叶松气孔关闭对水汽压亏缺增加的反应更敏感。而表2效应分析结果表明土壤水分对马尾松气孔导度有极显著影响(P<0.01),因此高水分处理下马尾松气孔导度均低于中等水分处理,且光合速率与气孔导度响应趋势一致,可能是由于高土壤水分下马尾松叶片VPD增大导致气孔导度降低(表1)。Mo等[15]研究中国南方的两种热带树种木荷(Schimasuperba)与黄果厚壳桂(Cryptocaryaconcinna)对模拟氮沉降的响应的结果表明施氮促进植物光合速率,这与本研究结果中低土壤水分和高土壤水分处理下的杉木光合速率结果一致,可能是由于施氮补充杉木体内氮营养元素,导致杉木气孔导度增大从而促进光合速率。相较于未施氮情况,在施氮情况下的杉木气孔导度与VPD的规律更明显,这可能是施氮促进杉木气孔导度对VPD的敏感性,马尾松则相反。有研究表明氮添加将降低植物的氮再吸收效率[24],并影响光合速率,尤其是在高氮条件下[25]。而在本研究中,相对于未施氮中等土壤水分条件,低土壤水分和高土壤水分与氮的互作对马尾松光合速率具有不利影响,这可能是马尾松在氮水互作条件下的氮再吸收效率存在差异,进而导致气孔导度降低,但总体上土壤氮水交互作用对马尾松和杉木光合参数无显著性影响(表2)。

表3 不同土壤水分条件下马尾松和杉木COS通量和CO2通量及其比值与光合参数相关性(n=6)
3.2 氮水耦合对马尾松和杉木COS通量的影响
植物COS通量的影响因素较多,其中植物自身因素影响最甚,其中植物内部阻力(气孔导度、叶肉导度等)对植物COS通量起重要作用。本实验中,未施氮组的中等水分处理马尾松光合速率和气孔导度均大于低水分处理,但其COS通量却低于低水分处理,此外杉木在施氮和未施氮条件下的中等水分处理气孔导度均较高,但其COS通量同样小于低水分处理,且马尾松CO2通量和杉木COS通量均在低土壤水分条件下与气孔导度呈负相关(表3),因此可能还存在其他影响低土壤水分条件下杉木和马尾松COS通量的因素。施氮组与未施氮组高水分处理下的马尾松COS通量均高于低水分处理,说明高水分环境相比于低水分环境更有利于马尾松吸收COS。有研究表明干旱将降低植物光合作用和气孔导度[26],结合表1可知,高水分处理下马尾松气孔导度显著高于低水分处理(P<0.05),导致高水分处理下的马尾松吸收COS能力增强。此外,施氮处理不同土壤水分条件的马尾松与杉木COS通量均大于未施氮处理相应土壤水分条件下的COS通量(图2),这可能是因为施氮使得马尾松和杉木气孔导度增强,进而导致植物COS通量增加。有研究表明植物COS通量与植物气孔导度密切相关[10],Kooijmans等[27]研究光和湿度对欧洲赤松树枝COS通量影响时发现,欧洲赤松的COS通量随植物气孔导度的增加而增加,这与本研究中等土壤水分和高土壤水分条件下的植物COS通量和气孔导度相关关系类似。与气孔导度不同的是,马尾松和杉木光合速率与不同土壤水分条件下的CO2和COS通量无明显相关规律,这可能是施氮处理对杉木和马尾松光合速率的影响有差异(表1)。而在低水分和高水分与施氮互作下的杉木COS通量显著高于未施氮条件中等水分处理(P<0.05),说明氮水互作促进杉木COS通量。这可能是由于氮水互作增加杉木气孔导度或光合速率(表1),使得杉木吸收COS能力增强,但是氮水互作对植物COS通量的影响不显著(表2)。
3.3 马尾松和杉木COS和CO2共吸收及其对氮水变化的响应
不同植物在不同环境下的FCOS/FCO2比值是不确定的[10]。COS通量和CO2通量比值可以用气孔导度及其对COS和CO2的影响来解释,有研究认为气孔导度对植物吸收COS的影响大于CO2,由于植物吸收COS是非光依赖过程,因此植物CO2通量额外受光照影响[13]。本研究结果中,中等土壤水分提高马尾松FCOS/FCO2。中等土壤水分条件下施氮导致马尾松FCOS/FCO2降低,而施氮同样会降低杉木在低土壤水分条件下的FCOS/FCO2。结合图3可知马尾松和杉木的CO2通量与光合速率和气孔导度变化不完全一致。因此除光合速率和气孔导度外可能有其他影响马尾松和杉木CO2通量的因素存在,具体影响因素有待进一步探究。研究结果表明马尾松和杉木COS和CO2通量相关性显著(P<0.05),说明杉木和马尾松在吸收CO2的同时也吸收COS,且随着CO2吸收量的增加,COS吸收量也呈比例增加。这进一步验证了植物CO2和COS通量间的关系密切。Asaf等[4]研究以色列三种针叶林COS通量时也发现大气中COS浓度的变化与区域、地区和叶尺度上的CO2密切相关。效应分析表明施氮和土壤水分及其交互作用对马尾松和杉木FCOS/FCO2均无显著性影响(表2),这可能是由于植物COS与CO2通量存在正相关关系,使得植物CO2吸收通量增强的情况下COS通量也增加,导致植物FCOS/FCO2整体趋于稳定。由于COS与CO2之间具有较强的相关性,通过COS可以估算全球总初级生产力。不少研究提出叶相对吸收(LRU)的概念,即通过大气COS和CO2的混合比及植物COS和CO2通量计算而来。有研究表明白天综合的叶相对吸收范围在1.0—1.5[9],类似的,本实验的杉木FCOS/FCO2介于此范围。而马尾松FCOS/FCO2则与早期研究报告和使用的值1.68相接近[4, 28]。Stimler等[29]研究鼠尾草(Salvialongispicata
Martius Galeotti×SalviafarinaceaBenth)、和朱槿(RosasinensisLinn)等植物COS和CO2关系的结果表明叶相对吸收介于1.6—1.7,与马尾松接近但区别于杉木,这可能是由于树种间差异造成。
4 结论
(1)氮水交互改变马尾松和杉木光合速率:氮增加抑制马尾松光合速率,中等土壤水分促进马尾松光合速率;氮水交互促进杉木光合速率,而土壤水分和施氮及两者交互作用对杉木气孔导度均无显著性影响。
(2)氮水交互作用对植物COS和CO2通量影响不完全一致:施氮能促进植物COS的吸收。高土壤水分与低土壤水分分别有利于马尾松和杉木吸收COS,这与水分对植物CO2吸收的影响不一致,说明植物吸收COS受到除气孔外的因素影响。
(3)氮水交互作用对不同植物FCOS/FCO2影响不一致:马尾松和杉木COS通量与CO2通量成正比,马尾松FCOS/FCO2比值高于杉木。马尾松和杉木FCOS/FCO2比值分别在未施氮中等土壤水分和未施氮低土壤水分条件下达到最大。低土壤水分条件下,施氮抑制杉木FCOS/FCO2比值,主要是由于施氮促进杉木净光合速率和气孔导度进而促进植物吸收CO2。
(4)马尾松和杉木能共吸收COS与CO2,但两者共吸收对施氮和土壤水分等环境条件改变的响应不一致,因此可用FCOS/FCO2比值估算GPP,但在以全球变化为研究条件时将COS作为指示物估算GPP需要谨慎对待。

