北京棒杆菌新型天冬氨酸激酶双突变株Y198N/D201M的构建及酶学性质表征
魏 贞,韩彩静,高云娜,樊占青,王亚南,王哲人,闵伟红
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
北京棒杆菌天冬氨酸激酶(Corynebacterium pekinenseaspartate kinase,CpAK)是一种新型的单体别构酶[1],受苏氨酸(Thr)和赖氨酸(Lys)的协同反馈抑制[2],致使天冬氨酸族氨基酸难以大量积累。与北京棒杆菌不同的是,AK在其他生物体内有不同的存在形式和抑制机制,拟南芥(Arabidopsis thaliana)含有3 种单功能AK(AKI、AKII和AKIII)和2 种双功能AKHSDH(I和II)[3-4],其中AKI受Lys和甲硫氨酸(Met)的抑制[5-7];大肠杆菌中含有1 种单功能AKIII和2 种双功能AK-HSDHI、AK-HSDHII[8-9],AK-HSDHI受Thr抑制[10],AK-HSDHII受L型Met阻遏,而AKIII受Lys抑制[11]。谷氨酸棒杆菌AKII以协同方式被Lys和Thr抑制[12]。
由于AK在代谢途径中受协同反馈调节,因此通过解除反馈抑制提高下游代谢产物产量成为研究热点。目前对AK的改造主要通过质粒重组[13-14]、基因敲除[15]、定点突变[16-19]等方式进行,其中定点突变技术应用较普遍。Chen Zhen等[16]分析了谷氨酸棒杆菌AK调节域中的关键性残基位点,利用定点突变技术对酶定向改造,从而削弱了Thr和Lys的协同反馈抑制作用。也有研究筛选出谷氨酸棒杆菌AK中抑制剂结合位点和底物结合位点周围的关键残基,获得了解除Lys和Thr反馈抑制且酶活力提高的突变株R169Y、R169P、T379L和A380I,为优化AK代谢途径和构建多突变体优良菌株提供参考和依据[1,17-18]。
目前对CpAK的改造主要集中在抑制剂位点[18-23],对其底物结合位点和ATP结合位点的改造鲜有文献报道。AK催化反应机理是将ATP的磷酸基团转移到底物使底物磷酸化,因此ATP对酶活性具有重要作用[24]。Li Changcheng等[25]报道在铜绿假单胞菌AK中对ATP结合位点进行双突变,D182/R184A酶活力降低到60%,证明ATP结合口袋对酶活力有重要影响。本研究选取ATP周围的关键位点Tyr198和Asp201,对其进行定点饱和突变,采用高通量筛选获得酶活力提高并解除反馈抑制的突变株,以期为解除AK反馈抑制提供可参考的理论依据。
1 材料与方法
1.1 材料与试剂
重组大肠杆菌(pET-28a-AK/BL21)由吉林农业大学发酵工程实验室提供;大肠杆菌BL21(DE3) 北京鼎国昌盛生物技术有限责任公司。
质粒抽提试剂盒、Taq酶、核酸电泳Marker、DpnI酶大连TaKaRa公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒 北京鼎国昌盛生物技术有限公司;非变性镍柱及柱料 美国GE公司;引物合成和测序由生工生物工程(上海)股份有限公司完成。
LB液体培养基:1%蛋白胨,1%氯化钠,0.5%酵母浸粉,溶解于去离子水后,用2 mol/L NaOH溶液调pH值至中性,121 ℃灭菌20 min;LB固体培养基在此基础加1.8%琼脂粉。
1.2 仪器与设备
梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Eppendorf公司; Spectra Max 190酶标仪美国Molecular Devices公司;超声破碎仪 宁波新芝生物科技有限公司;Z36HK低温高速离心机 德国Hermle公司;蛋白印记转膜仪 美国Bio-Rad公司;SE260蛋白电泳仪、琼脂糖凝胶成像仪 美国GE公司。
1.3 方法
1.3.1 引物设计及定点饱和突变
利用Primer 5.0软件对位点进行设计,由生工生物工程(上海)股份有限公司合成,双突变体上游引物F-y198n/d201m:5’-CGGCATAGCGGTATTCACACCGT CAACG-3’;下游引物R-y198n/d201m:5’-CGTTGACG GTGTGAATACCGCTATGCCGC-3’。按照说明书提取质粒pET-28a-AK,以pET-28a-AK为模板对其进行全质粒扩增,反应条件:94 ℃预变性1 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸10 min,18 个循环,72 ℃延伸10 min;4 ℃保存。
1.3.2 扩增产物消化及转化
1.3.1 节中PCR产物经1%琼脂糖核酸电泳验证成功后用DpnI酶消化,反应体系为PCR产物2 μL、10×T Buffer 2 μL、DpnI酶0.3 μL、ddH2O 15.7 μL,37 ℃水浴2 h。
取1~2 μL消化产物加入BL21感受态细胞,冰浴30 min,42 ℃热激42 s,再冰浴5 min后加入800 μL LB液体培养基,37 ℃、180 r/min振荡培养2 h,6 000 r/min离心5 min,弃700 μL上清液,将剩余上清液与菌体吹打混匀后涂布LB固体培养基,37 ℃过夜培养。
1.3.3 突变株高通量筛选及AK基因验证
挑取单菌落于LB液体培养基(含50 μg/mL卡那霉素)中扩大培养,加入终浓度为1 mmol/L异丙基硫代-β-D-半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)诱导表达后进行高通量筛选,方法见文献[20],选取酶活力提高较高的突变株于5 mL LB液体培养基扩大培养,37 ℃、180 r/min培养12 h。以菌液为模板,用克隆引物进行PCR扩增,反应体系及条件见文献[26],PCR产物经1%琼脂糖核酸电泳验证,验证成功的菌株送至生工生物工程(上海)股份有限公司测序。
1.3.4 AK诱导表达及蛋白纯化
菌株活化后以2%接种量转入100 mL LB液体培养基扩大培养,加入诱导剂IPTG(终浓度1 mmol/L)诱导8 h,4 ℃、8 000 r/min离心10 min,弃去上清液收集菌体。粗酶液制备方法及纯化方法参照文献[23],粗酶液和纯化液经SDS-PAGE和Western blot进行验证,实验步骤参考文献[1]。
1.3.5 AK活力测定及动力学分析
反应速率V定义为1 min内1 mg酶的催化能力,单位为U/(mg·min),其中1 mL酶活力测定反应体系参考文献[18],在反应体系其他条件不变的情况下,改变底物浓度(分别为0.5、1、3、5、7、9、10、12、14、16 mmol/L)于540 nm波长处测其吸光度,并计算AK比活力,通过Origin 8.5软件中的Hill方程V=VmaxSn/(Kn+Sn)进行非线性拟合。
1.3.6 AK酶学性质分析
1.3.6.1 最适温度
反应体系不变的情况下,在不同温度(15、20、25、26、28、30、35、40、45、50 ℃)反应30 min,每组样品3 次平行,最高酶活力定义为100%。
1.3.6.2 最适pH值
反应体系不变的情况下,调节反应体系中Tris-HCl缓冲液pH值(6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0),每组样品3 次平行,最高酶活力定义为100%。
1.3.6.3 稳定性
在最适温度和最适pH值下,将AK纯化酶液加入反应体系中反应30 min后测定酶活力,此时酶活力定义为100%,以后每隔1 h检测酶活力,每组样品3 次平行。
1.3.6.4 底物抑制剂对AK活力的影响
在反应体系中加入不同底物抑制剂Lys、Thr、Met、Lys+Thr、Lys+Met、Thr+Met、Lys+Thr+Met(终浓度分别为0.2、1.0、5.0、10.0 mmol/L),以检测抑制剂对AK活力的影响,每组样品3 次平行,不添加底物抑制剂的对照组相对酶活力定义为100%。
1.4 数据分析
2 结果与分析
2.1 ATP结合位点的筛选
采用Clustal X 1.81进行同源序列比对,比对结果用软件ESPript 3.0进行修饰,并利用PyMOL软件对AK模型进行分析,Tyr198位点和Asp201位点均为保守位点且位于ATP周围,如图1A、B所示。在前期研究基础中,对CpAK突变体A380I利用Gromacs软件进行动力学模拟(53A6力场描述蛋白质和配体,配体参数由PRODRG2.5服务器提供),通过分子动力学模拟,发现残基Tyr198与ATP之间的氢键占有率增加,其中ATP∶N5与Tyr198∶O之间氢键占有率由42.48%增加到54.35%,Tyr198∶CD1与ATP∶C10之间氢键占有率由0%增加到31.97%,从而与ATP交互作用增强,因此推测Tyr198位点是ATP周围的关键位点[1]。通过模型空间结构比对(图1C),CpAK Asp201位点对应于甲烷球菌AK(Methanococcus jannaschiiAK,MjAK)(PDB:2hmf)Asp239位点,而MjAK Asp239位点参与催化反应。设想Asp201位点对于酶活力提高有重要作用[27]。因此在本研究中选取Tyr198和Asp201位点作为定点饱和突变位点。
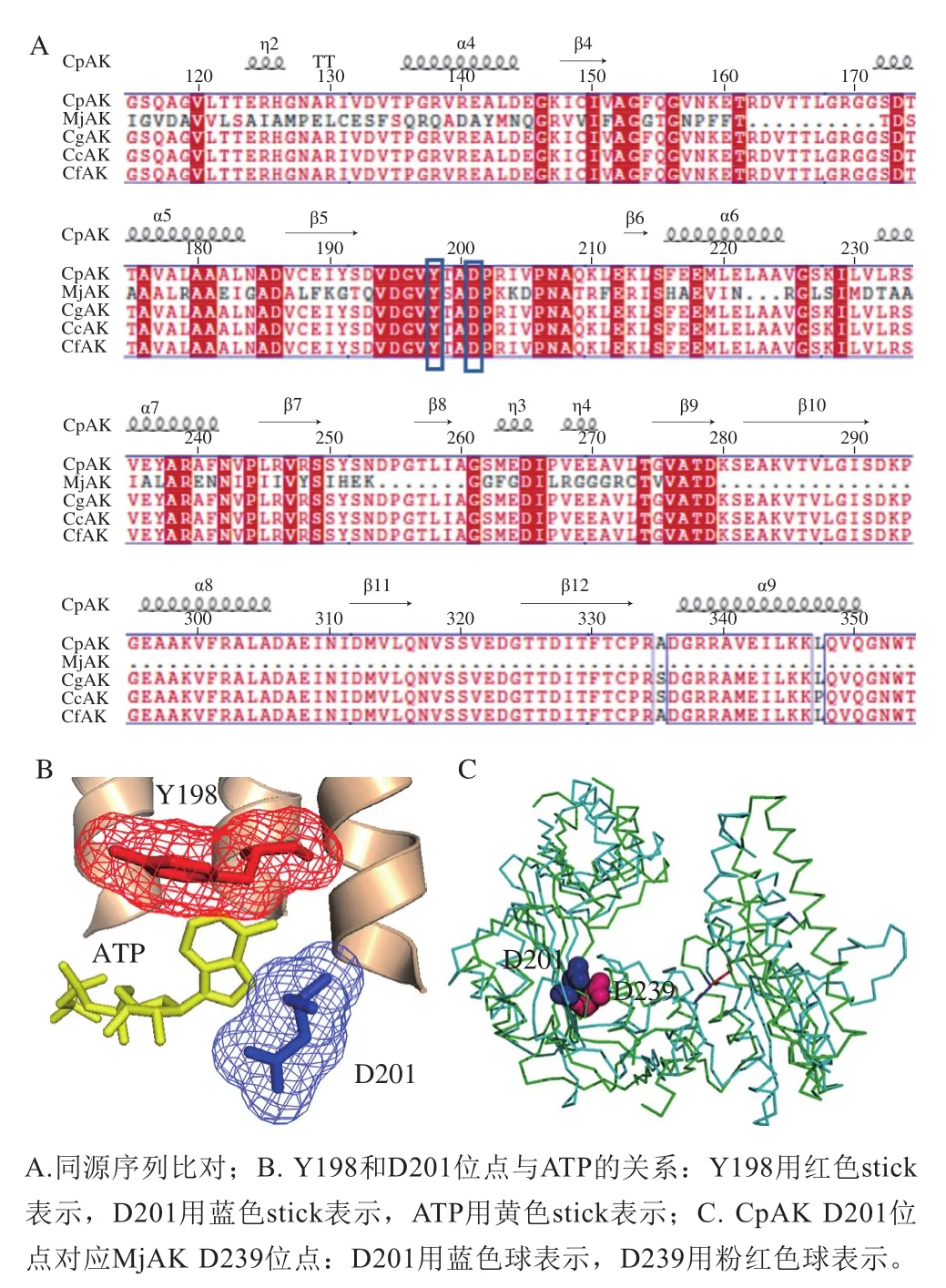
图1 ATP结合位点的筛选Fig.1 Selection of ATP binding sites
2.2 突变体构建
以质粒pET-28a-AK为模板,在Y198N/D201M的引物作用下进行定点饱和突变PCR扩增,如图2A所示,在7 000 bp附近有条带,初步证明突变成功。PCR产物经消化酶DpnI处理后导入到大肠杆菌感受态细胞中,通过高通量筛选获得高AK活力菌株,对菌液进行PCR验证,在1 000~2 000 bp之间有单一明显条带,其与目的基因CpAK长度1 266 bp相符,表明目的基因AK实现了大量复制(图2B)。测序结果如图2C所示,AK氨基酸序列中198位点由Tyr突变成Asn,201位点由Asp突变成Met,即表明双突变体Y198N/D201M构建成功。
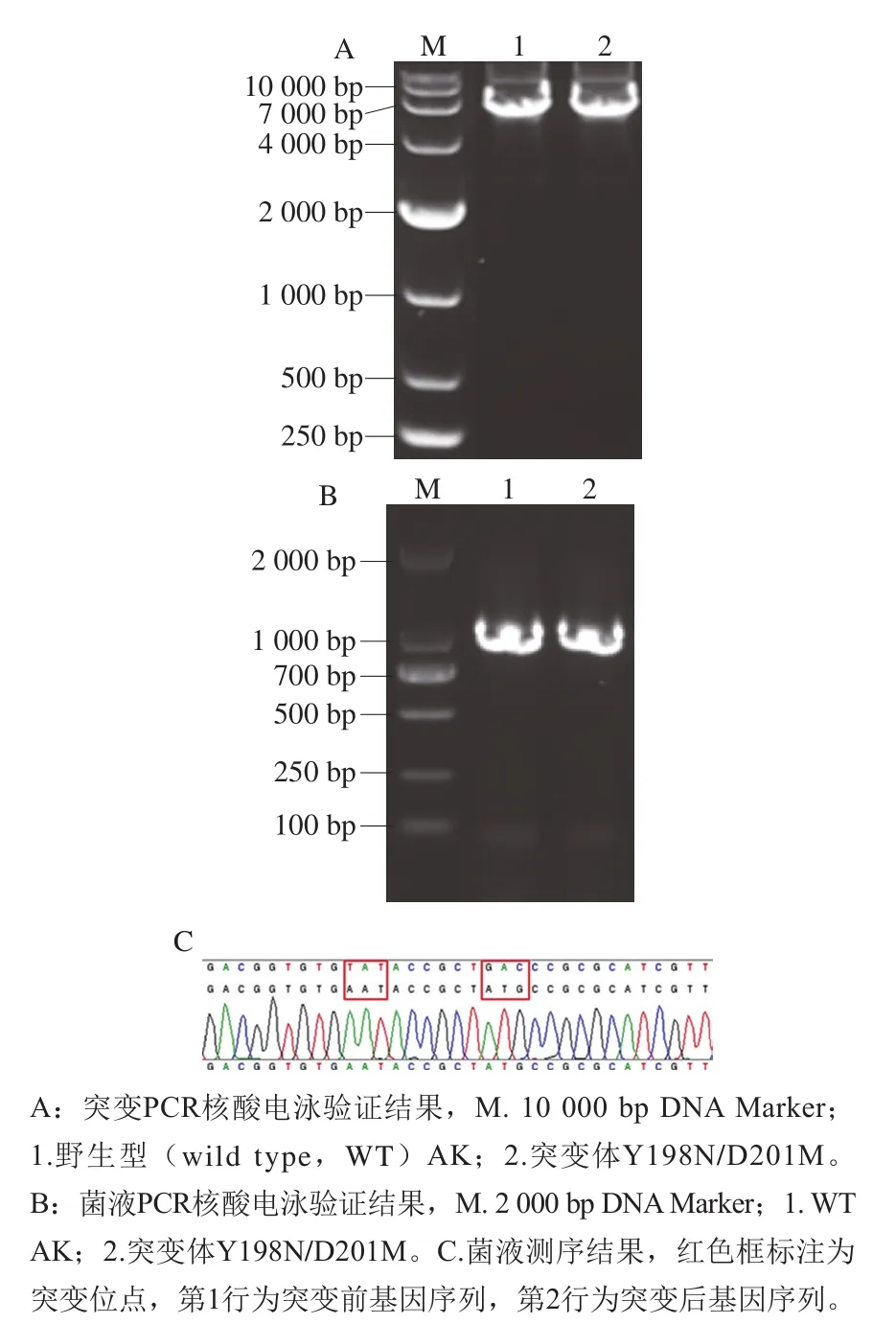
图2 突变体Y198N/D201M的构建Fig.2 Construction of mutant Y198N/D201M
2.3 SDS-PAGE和Western blot验证
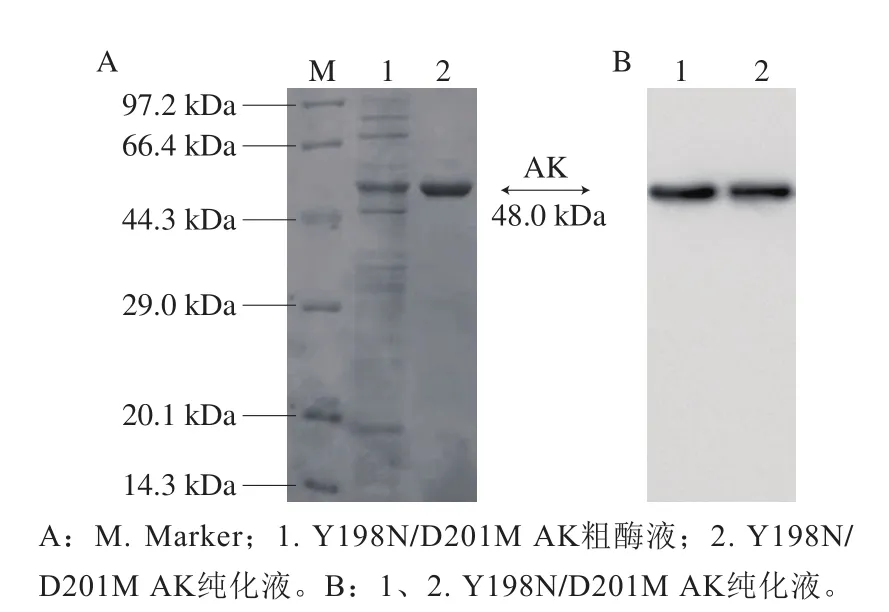
图3 SDS-PAGE(A)及Western blot(B)结果Fig.3 Results of SDS-PAGE (A) and Western blot (B)
对WT和突变体菌株分别进行诱导表达及非变性镍柱纯化,将获得的AK粗酶液和AK纯化液进行SDS-PAGE及Western blot电泳验证,结果如图3所示。在48 kDa左右处均有明亮单一条带,表明AK蛋白在诱导剂IPTG的作用下成功表达。
2.4 反应动力学分析
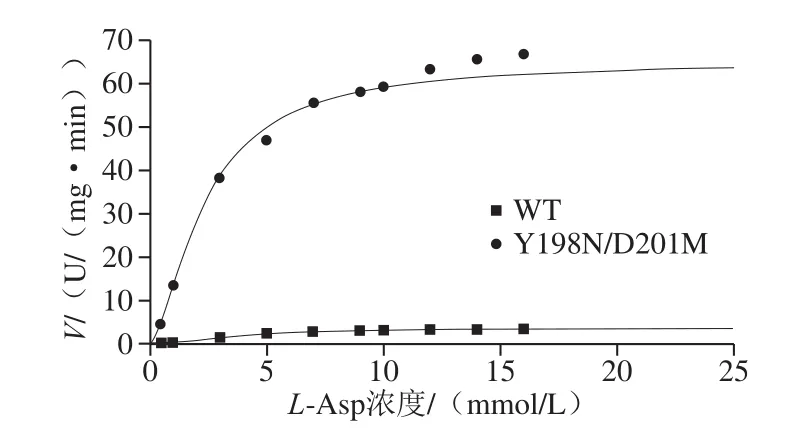
图4 WT和Y198N/D201M的动力学分析Fig.4 Kinetic analysis of WT and mutant Y198N/D201M
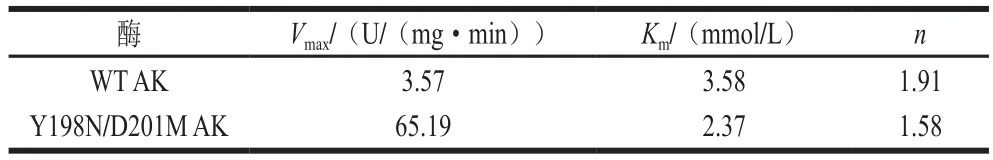
表1 WT AK及Y198N/D201M动力学参数Table 1 Kinetic parameters of WT AK and mutant Y198N/D201M
单体AK的反应动力学符合Hill方程V=VmaxSn/(Kn+Sn),是典型的别构酶。Km值表示酶促反应的初速率为最大速率Vmax一半时的底物浓度,单位一般为mmol/L或者μmol/L,Km只与酶的性质有关,而与酶浓度无关。Vmax表示在一定酶量下的最大反应速率,即酶完全被底物饱和时的反应速度,与酶浓度呈正比[28]。n值表示希尔系数,代表协同性,其中n<1表示负协同反应:一旦一个配体分子结合到酶上,酶对其他配体的亲和力就会减小;n=1表示非协同反应:酶对于一个配体分子的亲和力并不取决于是否有配体分子已结合到其上;n>1表示正协同反应:一旦一个配体分子结合到酶上,酶对其他配体的亲和力就会增大[29]。
对WT和突变体AK纯化液分别进行酶促反应动力学分析,结果如图4和表1所示。WT AKn值为1.91,表明AK呈正协同性,突变体Y198N/D201M AK的n值为1.58,n值降低,表明突变后AK的正协同性降低;突变后AK的Km值由3.58 mmol/L降至2.37 mmol/L,表明突变使得AK与底物亲和力增强;Y198N/D201M AK的Vmax为65.19 U/(mg·min),较WT AKVmax(3.57 U/(mg·min))提高到18.26 倍。
2.5 酶学性质表征
2.5.1 温度对AK活力的影响
由图5A可知,WT AK最适温度为25 ℃,突变体Y198N/D201M AK最适温度为28 ℃,突变后最适温度提高3 ℃,说明突变有效改善了AK的最适温度。WT AK温度敏感性高,可适温度区间较小,当温度高于35 ℃时,AK活力急剧下降,而突变体Y198N/D201M AK在15~45 ℃温度范围内,相对酶活力仍保持在55%以上,说明突变后酶耐高温性能增强。
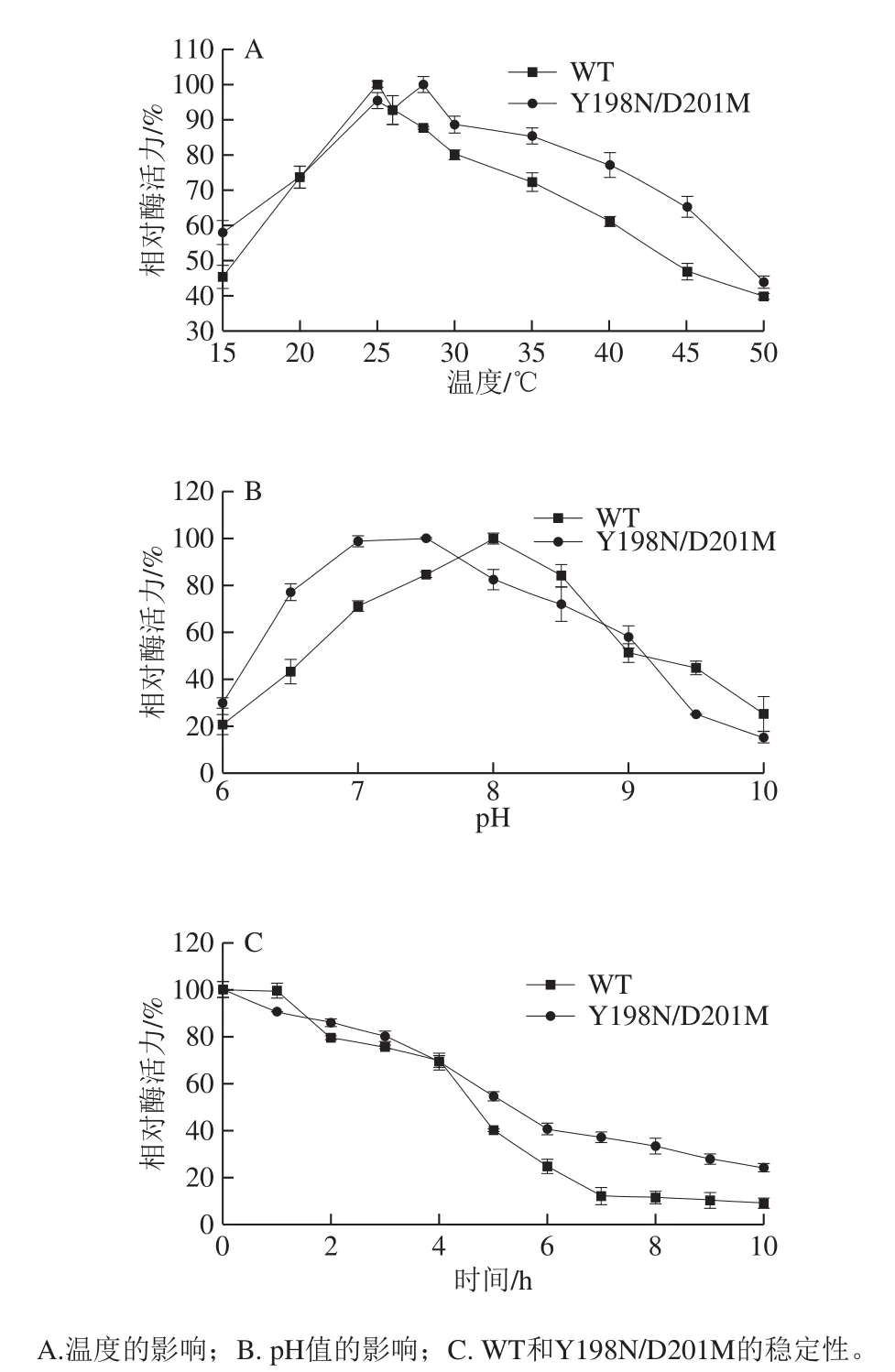
图5 WT和Y198N/D201M的酶学性质表征Fig.5 Enzymatic properties of WT and mutant Y198N/D201M
2.5.2 pH值对AK活力的影响
由图5B可知,WT AK最适pH值为8.0,突变后AK最适pH值由8.0降低至7.5,同时,耐受pH值区间也变广,在pH 6.5~8.5范围内相对酶活力保持在70%以上,这将有利于菌株氨基酸发酵生产。
2.5.3 AK稳定性
在最适温度和最适pH值的基础上,测定酶的稳定性,如图5C所示。WT AK的半衰期为4.66 h,而Y198N/D201M AK的半衰期为5.32 h,较WT AK延长了0.66 h。在6 h时,突变体保持40%酶活力,直到10 h酶活力仍保持在20%以上,显著高于WT AK(6 h时约保持20%酶活力,10 h时酶活力不到10%),表明突变体AK稳定性更好。
2.5.4 底物抑制剂对AK活力的影响
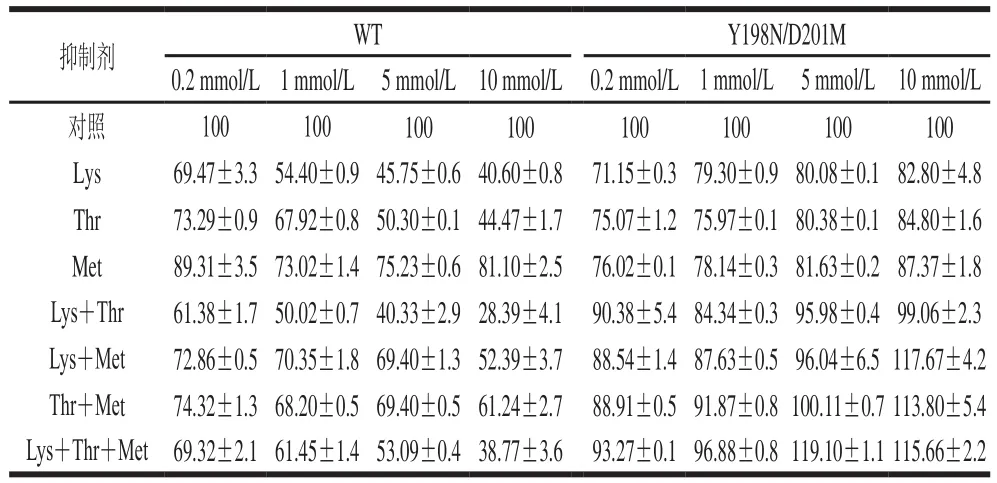
表2 不同底物抑制剂条件下WT和Y198N/D201M的相对酶活力Table 2 Relative activity of WT and mutant Y198N/D201M in the presence of different substrate inhibitors%
从表2可知,WT AK受Lys和Thr反馈抑制,随抑制剂Lys或Thr浓度的增加抑制作用逐渐增强,当抑制剂Lys或Thr浓度为10 mmol/L时,WT AK的相对酶活力分别为40.60%和44.47%,抑制率分别约为60%和55%。当Met单独存在时,对酶的抑制作用较弱,抑制率为20%~30%。当2 种抑制剂同时存在时,Lys+Thr抑制率最强达到约72%,Lys+Met或Thr+Met最大抑制率约为48%和40%,说明AK主要受Lys和Thr的抑制,这与文献报道一致[30]。当3 种抑制剂同时存在时,最大抑制率约为62%。突变后,在不同浓度抑制剂存在下,突变体Y198N/D201M AK均被明显激活,特别是在10 mmol/L的Lys+Met、Thr+Met、Lys+Thr+Met存在时,Y198N/D201M AK相对酶活力分别为117.67%、113.80%和115.66%,除5 mmol/L的底物抑制剂Lys+Thr+Met外,AK激活作用随着抑制剂浓度增大而增强,呈现明显的剂量依赖关系。这与动力学数据结果(Km和n值减小,Vmax增大)一致,亦说明本研究选取的Tyr198和Asp201为影响酶活力的关键位点。
3 讨 论
张芷睿等[22]对CpAK抑制剂结合位点Gln316位点进行突变,突变体Q316P较WT提高8.53 倍,并通过软件分析发现突变后抑制剂对AK抑制作用减弱,但未对突变株酶活力提高机制进行探讨。Min Weihong等[17]对CpAK通过虚拟筛选得出R169是一个抑制剂结合、底物结合和催化反应的重要位点,因此通过定点饱和突变对其进行改造,其中R169Y酶活力提高4.71 倍,亦未对突变株酶活力提高机制进行探讨。Han Caijing等[1]对抑制剂结合位点A380进行突变,获得了酶活力提高11.32 倍的突变株A380I,用分子动力学模拟探讨突变株酶活力提高机制:对抑制剂结合位点突变后能通过别构调控调节酶与ATP亲和力,其中Tyr198与ATP之间的氢键占有率增加,亲和力增强。本实验在Han Caijing等[1]研究基础上,对ATP结合关键残基位点Tyr198及催化位点Asp201进行定点饱和突变成功筛选获得酶活力提高到18.26 倍的双突变株,较对抑制剂结合位点的突变,酶活力显著提高。对抑制剂结合位点突变后,AK通过别构调控影响酶与ATP亲和力,从而调节酶活力,说明ATP结合位点对酶活力提高具有重要作用,因此本研究对ATP结合位点进行突变,通过实验验证其酶活力提高较大,进一步说明ATP结合位点的重要性,与Han Caijing[1]和Li Changcheng[25]等报道一致。
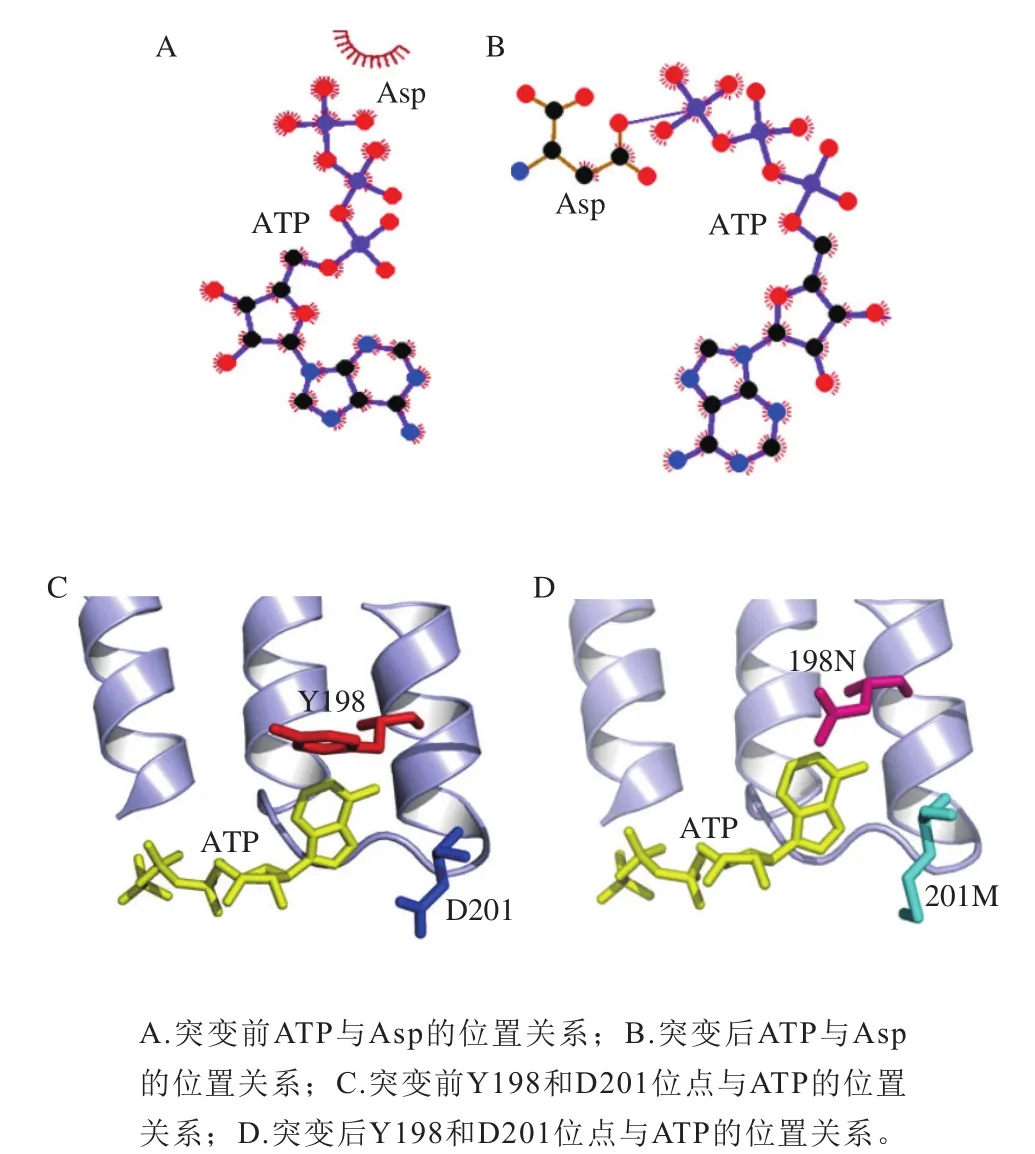
图6 突变前后ATP与Asp之间的变化Fig.6 The change between ATP and Asp before and after the mutation
文献报道对抑制剂结合位点进行突变,能有效减弱抑制剂的抑制[17-23],而在本研究中对ATP结合位点突变后对抑制剂有不同程度减弱甚至在高浓度下有激活作用。这可能是由于对ATP结合位点突变后引起了ATP结合口袋重排,致使底物Asp与ATP连接更紧密,由弱的范德华力转变成更强的作用力(图6A、B),稳定了底物Asp的结合,从而与AK相互作用增强,动力学结果表明Km由WT的3.58 mmol/L减少到2.37 mmol/L,与上述结论相符。抑制剂Lys是底物Asp的竞争性抑制剂[19],当底物Asp与AK相互作用增强时,抑制剂Lys不足以与底物Asp竞争,从而减弱了抑制剂的抑制,所以由Lys参与的抑制剂组合下激活作用较明显,这与表1数据相符。AK作为一个别构酶,对ATP结合位点的突变如何调控抑制剂Lys的结合,从而减弱反馈抑制,仍需要进一步研究。
推测突变体Y198N/D201M酶活力提高的原因可能是:1)Y198位点由环状氨基酸突变后不含环,可能消除了Tyr与ATP之间杂环的排斥作用,突变后两者之间的作用力变强(图6C、D);2)D201位点由酸性氨基酸(D)突变成非极性氨基酸(M),侧链残基变长,与ATP接触面积增大能更好地催化ATP(图6C、D);3)突变后致使底物Asp与ATP的连接更紧密,易于催化反应的进行。
4 结 论
本研究对北京棒杆菌中AK基因Tyr198和Asp201位点进行定点饱和突变,并通过高通量筛选成功获得酶活力显著提高的AK双突变体Y198N/D201M。酶动力学结果显示:突变体Y198N/D201M AK的Vmax较WT AK提高到18.26 倍,且增强了其与底物Asp的亲和力。酶学性质研究表明:Y198N和D201M突变使得AK最适反应温度由25 ℃增至28 ℃,最适pH值由8.0降至7.5,半衰期由4.66 h延长至5.32 h,表现出较好的稳定性;同时,解除底物抑制剂Lys+Met、Thr+Met、Lys+Thr+Met对AK活力的反馈抑制作用,为优化AK在棒杆菌代谢途径中的作用提供参考和依据。

