经肛门内镜微创手术治疗直肠肿物75例临床效果分析
任春成,陈希琳,张玉茹,刘连成,赵团结,齐顺利,李非
1北京市肛肠医院结直肠外科(二)病区 北京100016
2北京市肛肠医院病理科 北京100016
3首都医科大学宣武医院普外科 北京100053
经肛门内镜微创手术(transanal endoscopic microsurgery,TEM)经过30余年的临床应用和发展[1],已被越来越多的外科医师所掌握,使得经肛门外科手术得到了进一步的改进和提高[2]。TEM是集内镜、腹腔镜和微创手术于一身,经单孔内镜利用人体的自然腔道进行的手术操作。TEM具有创伤小、视野清晰、花费低、疗效确切的多种优势[3],同时能有效切除位置较高的直肠肿瘤,获得高质量的肿瘤标本和准确的病理分期。本研究回顾性分析2013年1月至2018年1月在北京市肛肠医院接受TEM治疗的75例直肠肿物患者的临床资料,旨在探讨TEM在治疗直肠肿物中的临床应用价值,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析北京市肛肠医院2013年1月至2018年1月共收治的75例直肠肿物患者的临床资料,其中男性48例,女性27例;年龄24~83岁,平均(54.4±13.2)岁;肿物直径0.6~4.0 cm,平均(1.6±0.7)cm;病灶距肛缘距离4.0~15.0 cm,平均(7.7±2.5)cm;肿物所在部位:直肠前壁11例,直肠后壁18例,直肠侧壁46例。一部分患者因便血、腹胀及排便习惯改变等就诊时发现,另一部分患者因常规体检或其他原因就诊时偶然发现。所有患者术前均行电子结肠镜检查取标本经病理诊断为直肠肿物,均无手术禁忌证,术前均签署治疗知情同意书。
1.2 TEM的纳入与排除标准
TEM的纳入标准:符合中国抗癌协会大肠癌专业委员会TEM学组专家共识[4]推荐的TEM手术适应证:(1)直肠腺瘤,尤其适用于广基或无蒂直肠腺瘤;(2)良好组织病理学特征的早期直肠癌(病变占肠周<30%、直径<3 cm、肿瘤活动、高~中分化、cT1N0、无脉管或神经浸润、无淋巴结转移证据);(3)经结肠镜切除局部恶变息肉(底部及周边切缘阳性,或无法评估)的扩大切除;(4)适合局部切除的其他直肠肿物(G1和G2级神经内分泌肿瘤、直肠间质瘤、脂肪瘤、平滑肌瘤等)或直肠周围的其他良性肿瘤。
TEM的排除标准:(1)患有严重的基础疾病,不能耐受TEM治疗;(2)肛门括约肌功能不良的患者;(3)肛门或直肠狭窄,无法置入TEM直肠镜者;(4)TEM直肠镜无法触及的结直肠肿物等。
1.3 治疗方法
1.3.1 术前检查 (1)常规直肠指诊检查:初步判定病灶距肛缘的距离、大小。(2)电子结肠镜检查:明确病灶距肛缘的距离、大小以及病灶占据肠腔周径的比例,直肠病灶取检明确病变的性质,排除同时性多原发病灶。(3)直肠腔内超声检查:以12小时钟点形式记录病灶的位置,并确定病灶浸润肠壁的深度。(4)其他检查:直肠测压以了解排便能力,了解肛门括约肌功能[1,5]。结直肠结构CT重建、盆腔MRI等检查进行术前分期,排除区域淋巴结转移。
1.3.2 肠道准备 口服复方聚乙二醇电解质散(每袋含聚乙二醇4000 64 g,无水硫酸钠5.7 g,氯化钠1.46 g,氯化钾0.75 g,碳酸氢钠1.68 g)进行2 d的肠道准备;术前4 h禁食水,予以肥皂水1 000 mL清洁灌肠。
1.3.3 手术体位 病灶的位置不同,手术体位亦有不同。病灶位于直肠后壁采用膀胱截石位,位于前壁采用俯卧位,位于侧壁则采用侧卧位。
1.3.4 TEM的手术操作要点 骶管阻滞麻醉+全身麻醉成功后选择合适体位,常规消毒、铺巾。用两手的示指及中指轻柔持续扩肛,插入直肠镜调至适当的位置后将其固定。保持肠腔CO2处于持续低压充气状态(气压控制在8~10 mmHg)。(1)切除范围的选择:病灶定位后,先用针形电刀点灼出拟切除的界线。如为良性病变其切缘可距病灶外5 mm,如为恶性病变则应在10 mm以外。如病变的性质不明确则按恶性病变处理。(2)切口深度的选择及判断:对于良性病变一般采用黏膜下切除即可。如为恶性或存在恶性可能则须行肠壁的全层切除。判断标准:切除层面见到横向的内环肌则表明是正确的黏膜下层面,见到黄色的直肠外脂肪则表明是正确的全层切除层面。(3)切除及缝合:切除病灶时一般遵循从浅入深、从右到左、从远到近的步骤,用超声刀进行病灶的完整切除。切除创面经冲洗止血后用倒刺线做连续缝合。线的两端再用银夹固定。遵循“纵切横缝”的原则避免肠腔狭窄。(4)切除标本的处理:将切除标本用多枚大头针固定在聚乙烯泡沫上,经甲醛处理后送病理学检查。图1、图2分别为肿物切除术中所见和缝合直肠创面。
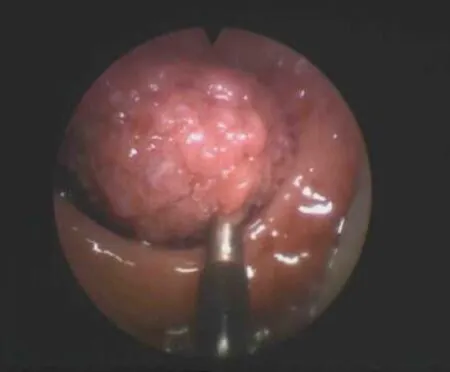
图1 肿物切除术中所见
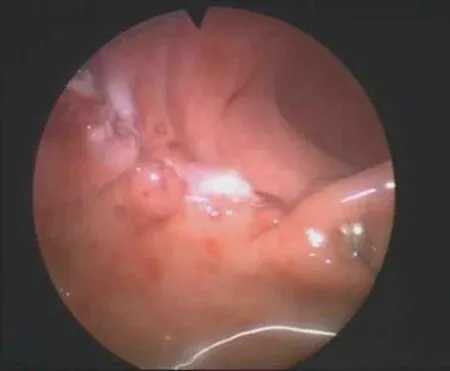
图2 缝合直肠创面
1.3.5 TEM的术后处理 术后患者常规预防性使用抗生素、无须特殊镇痛。麻醉恢复后即鼓励患者早期下床活动,尽早拔除导尿管。术后1 d开始少量流质饮食,逐渐过渡到正常饮食,术后3~5 d出院,定期门诊复查。
1.4 观察指标
分析患者手术相关指标(手术时间、术中出血量及住院时间)、术后并发症、直肠肿物特征(肿物直径、病灶距肛缘距离)、术后病理学检查及术后随访结果等。
1.5 统计学方法
选用SPSS 18.0统计学软件对数据进行处理。计量资料以(±s)表示,计数资料以[n(%)]或(n)表示。
2 结果
2.1 手术相关指标及术后并发症
75例直肠肿物患者均行TEM治疗并获得成功。手术时间20~125 min,平均(55.1±26.7)min;术中出血量1~5 mL,平均(1.8±1.0)mL;住院时间3~12 d,平均(6.7±1.9)d。术后多为一些轻微的并发症,包括尿潴留、肛门渗血及低热等,一般只需对症治疗,无须外科手段干预。未出现较为严重并发症,比如:直肠穿孔、直肠大出血、盆腔脓肿、直肠阴道瘘等。
2.2 肿物特征、病理学检查及术后随访
所有直肠肿物患者病灶均完整切除送病理学检查,环周切缘均为阴性。肿物直径为0.6~4.0 cm,平均为(1.6±0.7)cm;病灶距肛缘距离为4.0~15.0 cm,平均为(7.7±2.5)cm。术后病理学诊断:直肠腺瘤31例(41.3%)、直肠神经内分泌肿瘤19例(25.3%)、直肠间质瘤1例(1.3%)、非肿瘤性息肉8例(10.7%)、早期直肠癌(pT1期)4例(5.3%)、直肠腺瘤局灶癌变(pTis期)12例(16.0%)。术后随访时间7~24个月,平均(14.3±4.4)个月,复查电子结肠镜及直肠腔内超声等检查,均无复发及肛门括约肌功能障碍。75例直肠肿物患者的术后病理类型及所占比例如图3所示。
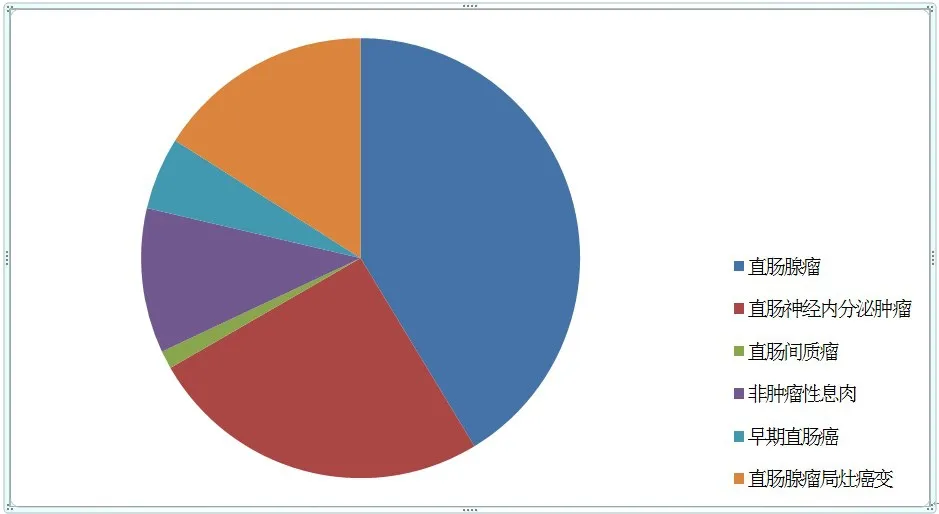
图3 75例直肠肿物患者的术后病理类型及所占比例
3 讨论
直肠肿物包括了不同类型的恶性肿瘤、良性肿瘤和非肿瘤性息肉。它们的临床特点、治疗方式、预后等有很大差异。手术是其主要的治疗手段。一些诊断明确的直肠恶性肿瘤需要行根治性切除,而一些其他类型的肿物仅需要局部切除,如直肠腺瘤、神经内分泌肿瘤、脂肪瘤等。
传统的经肛直肠肿物的局部切除术存在着术野暴露差、手术创伤较大、一次性完整切除率低、局部复发率较高、术后并发症多等不足[6-7],限制了其在临床的进一步应用。而TEM是直肠肿物局部切除的可选替代方法,比传统经肛门局部切除术具有更低的并发症发生率和复发率[8-9],患者术后排便功能及生活质量无明显变化[10]。TEM的优势在于微创、疗效确切且花费低[3],同时又能获得准确的病理分期,不仅可以作为治疗手段还可以作为诊断方法。
TEM经过30余年的临床应用和发展[1],已被越来越多的外科医师所掌握,适应证也不断在扩大。但对于直肠肿物来说,充分的术前评估及准确的临床分期是TEM治疗成功的关键。本组研究的75例患者术前均详细记录了肿物的大小、病灶距肛缘距离、具体位置等相关信息,并评估肛门括约肌功能,同时常规行结肠镜检查,明确术前病理诊断,行直肠腔内超声检查更准确地评估肿物浸润深度(T分期)及区域淋巴结情况。进行全面的术前评估,严格筛选符合手术适应证的病例,是TEM获得良好疗效的关键[11]。
对于直肠肿物的治疗,TEM可根据肿物的性质及侵犯深度来确定肠壁的切除层次,确保环周切缘的可靠性。因此与传统局部切除术相比,切缘阴性率更高,标本损坏率更低,局部复发率更低[12]。直肠的良性病变以直肠腺瘤最常见,本次研究中占比为41.3%,直肠腺瘤包括管状腺瘤和绒毛状腺瘤等,是TEM的最佳适应证,尤其是位于直肠中上段,直径大于1.5 cm的绒毛状腺瘤[13]。它们行传统经肛门手术无法切除,经腹部手术创伤太大,TEM能充分显示其特有的优势[14]。而近年来对直肠巨大环形腺瘤的TEM治疗也有报道。Levic等[15]的研究认为TEM治疗巨大环形腺瘤是安全有效的治疗方法。随着电子结肠镜的广泛应用,直肠神经内分泌肿瘤的检出率增加[16],对于直径2 cm以内的、病理分期为G1~G2级的直肠神经内分泌肿瘤,TEM可以完整切除病灶,疗效确切,可以作为治疗首选[17]。而对于早期直肠癌,病例选择是TEM手术成功的关键。尤其是高手术风险的患者,TEM相比传统的根治性手术,优势显著[18]。已有数据显示TEM可用于T1期以内无高复发危险因素的直肠癌患者[19]。同时有研究表明TEM术后肿瘤局部复发并非源于淋巴结转移,而是手术操作中肿瘤残留所致[20]。而对于直肠原位癌(pTis期),TEM是一种根治性的治疗手段[21]。本组75例直肠肿物患者,涵盖多种病理类型,术后病理均提示切缘阴性,定期随访均无局部复发及肛门括约肌功能障碍。但对于T2期及以上的直肠癌是否适合行TEM目前还存在一些争议,故本次研究未纳入T2期及以上的直肠癌,但对于保肛意愿强烈的患者可考虑新辅助放化疗后行TEM,或者先行TEM肿瘤全层切除根据术后病理诊断追加手术或放化疗[22]。近期的一项大样本单中心回顾性研究也表明TEM可作为治疗早期直肠癌的有效方法,5年总生存率(OS)和无复发生存率(RFS)分别为86.8%和70.9%[23],但仍需要进一步的研究以明确更具体的适应证。
由此可见,TEM是一种有效和安全的治疗直肠肿物的术式。在专科医院进行的TEM手术可观察到较低的复发率和并发症发生率[9]。本组研究在围手术期均未出现直肠穿孔、直肠大出血、盆腔脓肿、直肠阴道瘘等较严重并发症。但对于腹膜折返以上的直肠前壁肿物,术中容易切穿肠壁而进入腹腔,但容易发现并可及时修补,所以风险是相对可控的[24-25]。本研究发现TEM在治疗直肠占位性病变患者当中,手术时间、术中出血量、术后住院时间总体上比较理想,75例直肠肿物患者预后良好,无复发及严重并发症,肛门控便能力可,进一步证实了TEM的安全性、有效性。
综上所述,对于符合TEM手术适应证、进行充分的术前评估并接受规范化治疗的直肠肿物患者而言,TEM是一种安全、有效且微创的手术方式,可作为经肛局部切除的首选治疗。

