低位直肠癌新辅助治疗后淋巴结检出数目与预后的关系研究*
陈成辉,程少文,王石坚
1海南医学院第二附属医院外科 海南海口570228
2海南医学院第一附属医院外科 海南海口570102
结直肠癌是一种常见的恶性肿瘤,在我国发病率和病死率均呈上升趋势[1]。我国以直肠癌更多见,尤其是中低位直肠癌[2],严重威胁患者生命健康。新辅助放化疗 (neoadjuvant chemoradiotherapy,nCRT)因其具有降低肿瘤分期、提高局部缓解率、缩小原发肿瘤、提高根治性切除率和保肛率等优势而被作为中低位直肠癌的标准治疗方式广泛应用于临床[3]。淋巴结转移情况被认为是直肠癌预后的重要指标[4]。目前美国癌症分期联合委员会(American Joint Committee on Cancer Staging,AJCC) 认为,对于接受单纯手术治疗的结直肠癌患者需至少送检12枚淋巴结才可以准确评估淋巴结受累情况[5]。研究表明,经nCRT联合手术治疗的患者与单纯手术治疗患者相比,淋巴结清扫数目明显减少[6-8]。因此,关于直肠癌nCRT后淋巴结检出数目(the number of lymph nodes retrieved,LNs)减少是否会对预后评估产生影响仍存在争议。本研究回顾性分析影响接受nCRT联合手术治疗的低位直肠癌患者预后的临床病理特征,并探讨nCRT后最佳淋巴结检出数目对患者预后的影响,以期为nCRT后低位直肠癌患者的预后判断提供参考,现报告如下。
1 资料和方法
1.1 一般资料
海南医学院第二附属医院2014年1月至2016年12月共收治462例低位直肠癌患者。其中,接受新辅助放化疗联合手术治疗且随访资料完整的有350例,包括男性213例、女性137例,年龄25~83岁,平均(58.2±6.5)岁。本研究经海南医学院第二附属医院伦理委员会批准,患者及家属对治疗相关事宜明确知晓。
1.2 纳入与排除标准
纳入标准:(1)术后病理证实为直肠腺癌;(2)新辅助放化疗前诊断为Ⅱ~Ⅲ期;(3)肿瘤下缘距肛缘距离≤5.0 cm;(4)术前并非多原发癌;(5)术前相关检查未提示远处转移。排除标准:(1)在本次治疗前接受过直肠手术或盆腔放、化疗;(2)合并肠梗阻、肠出血,经急诊手术切除病灶;(3)同时或既往存在其他恶性肿瘤;(4)家族性息肉病癌变或林奇综合征;(5)失访病例、临床资料不完整者。
1.3 方法
1.3.1 新辅助放疗方案 主要受照部位包括原发肿瘤高危复发区(肿瘤/瘤床、直肠系膜区、骶前区和坐骨直肠窝)及区域淋巴引流区(真骨盆内髂总血管淋巴引流区、髂内血管淋巴引流区和闭孔淋巴结区)。照射剂量为45 Gy/25次,局部病灶追加至50.4 Gy/28次。
1.3.2 新辅助化疗方案 化疗方案以5氟尿嘧啶为主。包括3种方案:(1)CapeOX方案:第1天静脉滴注奥沙利铂130 mg/m2,第1~14天口服卡培他滨850~1 000 mg/m2,每天2次,每3周重复,共5个周期;(2)FOLFOX4方案:第1天静脉滴注奥沙利铂85 mg/m2、亚叶酸钙200 mg/m2,静脉推注氟尿嘧啶400 mg/m2,氟尿嘧啶600 mg/m2持续静脉输注;第2天静脉滴注亚叶酸钙200 mg/m2,静脉推注氟尿嘧啶400 mg/m2,氟尿嘧啶600 mg/m2持续静脉输注,每2周重复,共6个周期;(3)mFOLFOX6方案:第1天静脉滴注奥沙利铂85mg/m2、亚叶酸钙400mg/m2,静脉推注氟尿嘧啶400mg/m2,氟尿嘧啶1200mg/(m2·d)×2d持续静脉输注,每2周重复,共6个周期。
1.3.3 手术方案 手术切除于新辅助放化疗结束后6~8周实施。术前常规准备,所有手术均依据全直肠系膜切除(total mesorectal excision,TME)操作规范进行,采取开放或腹腔镜辅助直肠癌根治术。手术方式包括经腹直肠癌根治术、经腹会阴直肠癌根治术及肠造口术。
1.3.4 病理学评估 手术取得的标本均固定于10%甲醛溶液,经石蜡包埋后切片,切片厚度4 μm,并由经验丰富的病理科医师根据Wheeler等[9]提出的直肠癌 消 退 分 级(Rectal Cancer Regression Grade,RCRG)标准评价标本病理组织情况:Ⅰ级,指肿瘤反应好,癌细胞完全消退或仅存少量癌灶;Ⅱ级,指纤维化明显,仍有可见癌细胞存在;Ⅲ级,指肿瘤对放疗反应差,可见大量癌细胞,并伴有极少或无纤维化。术后T、N分期依据AJCC 2010年第7版TNM分期标准。
1.4 随访方法
采用门诊和电话进行随访,详细询问患者的一般情况、肿瘤是否复发、死亡患者的死亡原因及时间等,随访截至2019年12月31日。中位随访时间42.6个月。门诊复查进行核磁共振或CT等影像学检查,复发或病灶转移以影像学检查结果为准。
1.5 统计学分析
数据统计采用SPSS 19.0软件,作图采用Graph-Pad Prism 5软件。采用Kaplan-Meier法描绘生存曲线,Log-rank检验进行单因素生存分析,Cox比例风险回归模型进行多因素回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 影响患者 3年生存率的单因素分析
350例患者共检出淋巴结数目3 987枚,平均每例检出(11.4±4.7)枚。淋巴结检出数目、肿瘤大小、肿瘤分化程度、TNM分期、术后T分期、术后N分期及RCRG与患者3年生存率有关(均P<0.05),年龄及性别与患者3年生存率无关(均P>0.05)。见表1。
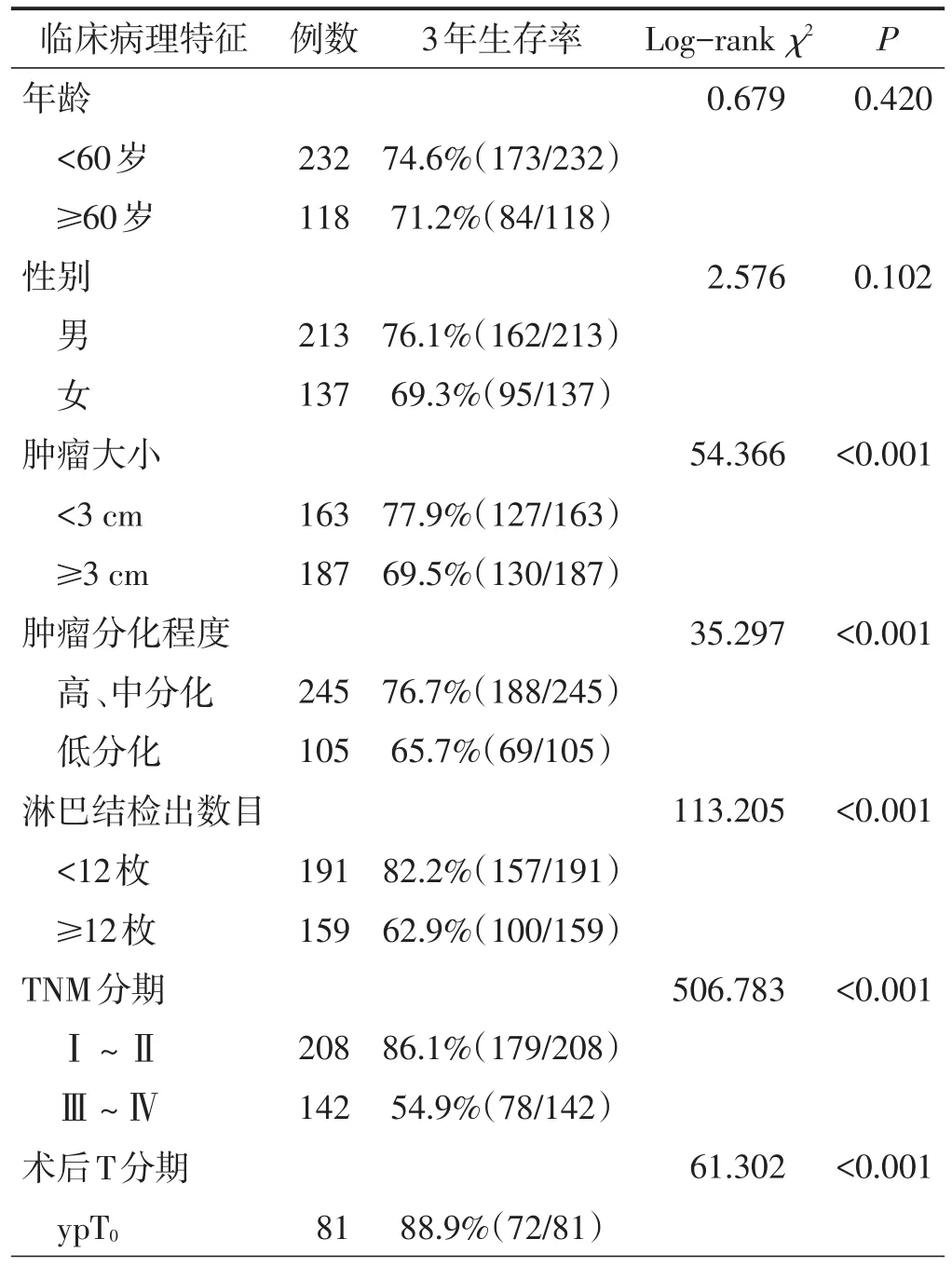
表1 影响患者 3年生存率的单因素分析
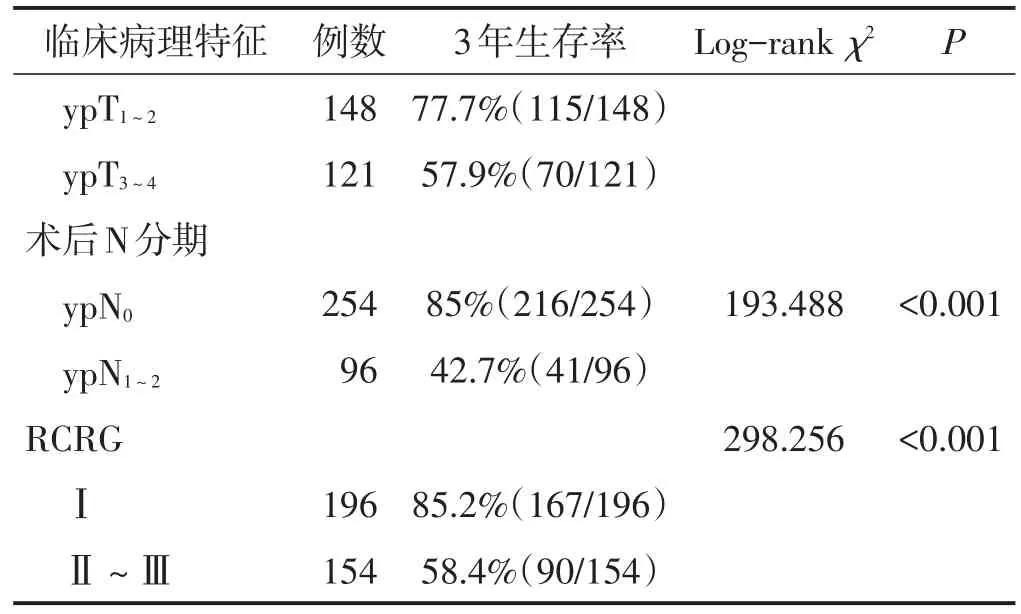
表1 (续)
2.2 影响患者 3年生存率的多因素分析
将淋巴结检出数目及其它单因素分析有意义的临床病理因素纳入Cox比例风险回归模型进行多因素回归分析,采取Backward方式计算,逐步剔除无统计学意义的自变量,发现TNMⅢ~Ⅳ期、淋巴结检出数目≥12枚、术后ypN1~2期及肿瘤消退Ⅱ~Ⅲ级是3年生存率的独立影响因素(均P<0.05),肿瘤大小、肿瘤分化程度及术后T分期并非3年生存率的独立影响因素(均P>0.05)。见表2。
2.3 淋巴结检出数目对患者 3年生存率的预测价值
通过上述单因素和多因素分析结果提示淋巴结数目是患者预后的独立影响因素,因此,根据淋巴结检出数目与患者3年生存情况建立ROC曲线以寻找预测患者预后的最佳淋巴结数目。ROC曲线下面积(AUC)为 0.856, 95%CI: 0.761~0.882,P<0.05,依据约登指数,与患者3年生存时间相关的淋巴结检出数目的最佳临界值为10枚,敏感度为84.3%,特异度为81.7%。见图1。
2.4 以最佳淋巴结检出数目为界值分析患者 3年生存情况
根据淋巴结检出数目最佳临界值分析结果,将患者分为LNs≤10枚组和LNs>10枚组,两组患者分别为181例和169例,至3年随访结束分别存活147例和110例。采用Kaplan-Meier法绘制生存曲线,结果如图2所示,LNs≤10枚组和LNs>10枚组3年累积生存率分别为81.2%和65.1%,差异有统计学意义(Log-rankχ2=152.342,P<0.001)。
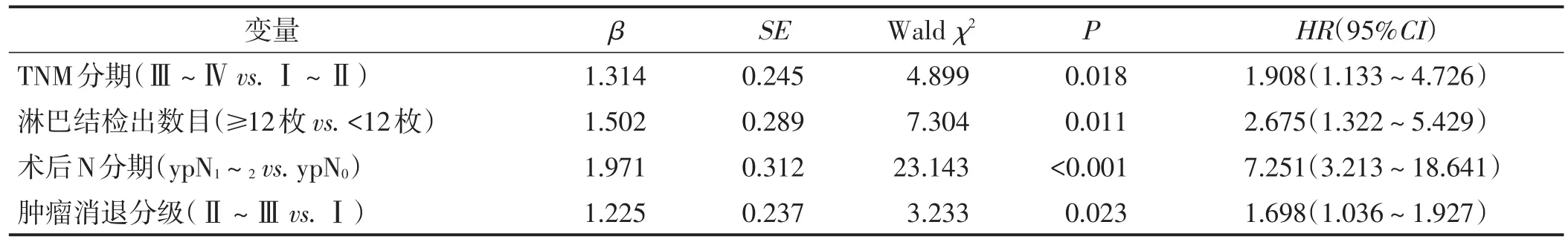
表2 影响患者 3年生存率的多因素分析
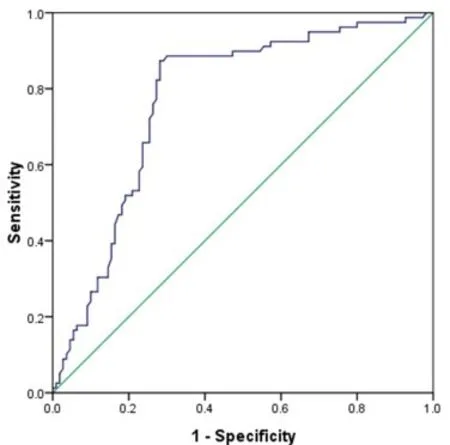
图1 淋巴结检出数目对患者 3年生存率的预测价值
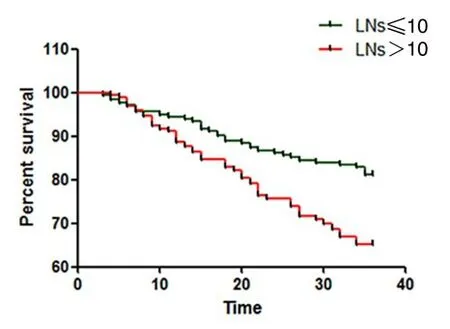
图2 淋巴结检出数目以10枚为临界值时患者 3年生存情况
2.5 淋巴结检出数目与nCRT后不同RCRG级别的低位直肠癌患者预后的关系
进一步通过Kaplan-Meier法和Log-rank检验探讨淋巴结检出数目对不同RCRG级别的患者预后的影响,将临界值分别代入各RCRG级别亚组进行分层分析。结果显示,RCRG Ⅰ级患者3年累积生存率为85.2%(167/196),其中LNs≤10枚组和LNs>10枚组3年累积生存率分别为89.4%(110/123)和78.1%(57/73),差异有统计学意义(Log-rankχ2=184.637,P<0.001);RCRG Ⅱ~Ⅲ级患者3年累积生存率为58.4%(90/154),LNs≤10枚组和LNs>10枚组3年累积生存率分别为63.8%(37/58)和55.2%(53/96),差异无统计学意义(Log-rankχ2=1.249,P=0.217),但淋巴结检出数目大于10枚患者预后呈现较差的趋势。见图3。
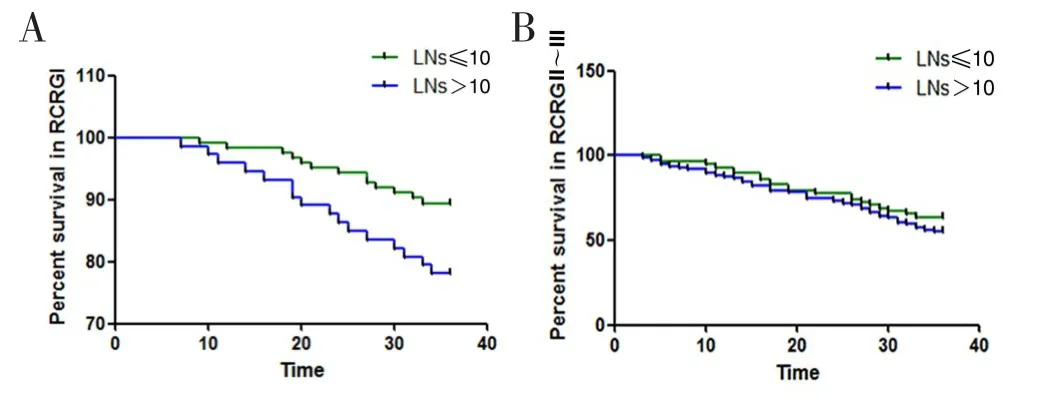
图3 淋巴结检出数目以10枚为临界值时不同RCRG级别患者 3年生存情况
3 讨论
结直肠癌是我国常见的消化道恶性肿瘤之一,其发病率和死亡率在近20年仍表现为升高趋势[10]。新辅助放化疗是治疗直肠癌的主要方法之一,因其能够缩小原发灶、降低复发率,甚至延长患者的生存时间而在直肠癌患者的初始治疗中广泛应用[11]。
目前,评价肿瘤预后的有效工具是AJCC TNM分期系统,其建议至少送检12枚淋巴结以获得能够充分、准确地判断直肠癌患者的淋巴结分期和预后的信息。但有研究提出仅20%接受新辅助放化疗的直肠癌患者能够检出12枚以上的淋巴结[12]。本研究对纳入的350例接受新辅助治疗后的患者手术标本淋巴结进行清扫,也发现仅45.4%的患者淋巴结检出数在12枚以上,淋巴结平均检出数小于12枚。对此,有研究通过比较接受新辅助治疗后不同淋巴结检出数目患者的5年生存率(≤12枚vs.>12枚:62.3%vs.78.9%)认为,新辅助治疗后淋巴结检出数目减少可能会对直肠癌患者的预后产生不良影响[13]。本研究亦针对该问题进行了探讨。通过单因素和多因素分析,发现淋巴结检出数目是患者3年生存率的独立影响因素。
由于新辅助放化疗使淋巴结检出数目减少,因此,是否仍以至少送检12枚淋巴结为标准进行淋巴结分期及预后判断需要进一步研究。本研究通过ROC曲线预测出患者3年生存时间相关的最佳淋巴结数目为10枚。而且我们分析发现,以10枚淋巴结检出数为截断点将患者分为LNs≤10枚和LNs>10枚两组,各组的3年累积生存率分别为81.2%和65.1%,差异有统计学意义,表明送检10枚淋巴结能够有效地对患者预后的指标进行评估。Luna-Pérez等[14]在对210例Dukes B期和Dukes C期直肠癌病例研究中也表明淋巴结送检数目为10枚时对患者的预后具有良好的预测效果,但与本研究不同的是,Luna-Pérez等认为淋巴结检出个数≥10枚的Dukes B期病例局部复发率(≥10枚vs.<10枚:7.4%vs.15%)更低且5年生存率(≥10枚vs.<10枚:69%vs.48%)更高,而在Dukes C期病例中无差异。对于这种差异,我们认为可能与新辅助放化疗后患者的肿瘤反应有关,淋巴结检出数目减少可能是肿瘤对放化疗更敏感引起的。
直肠癌消退分级[9](RCRG)是评价新辅助放化疗后肿瘤反应的指标,主要以残余肿瘤比例及纤维化成分进行划分。研究显示RCRG与直肠癌新辅助放化疗患者预后相关,如Huang等[15]研究了RCRG与直肠癌患者预后的关系,结果显示RCRG与局部复发率相关(RCRG Ⅰ级vs.RCRG Ⅱ~Ⅲ级:3%vs.24%,P<0.05)。此外,直肠癌新辅助放化疗后的淋巴结获取数目与肿瘤反应密切相关。如Yamamoto等[16]研究显示直肠癌新辅助放化疗后淋巴结计数低并不意味着切除不充分或分期不足,而表示对治疗的敏感性增加。Abe等[17]研究发现新辅助放化疗后,淋巴结摘除数量与肿瘤消退呈负相关。为了验证淋巴结检出数目减少可能与肿瘤敏感性有关,我们根据RCRG将患者分为RCRG Ⅰ级和RCRG Ⅱ~Ⅲ级两组,分别探讨LNs≤10枚和LNs>10枚的两组患者生存率情况。通过分组分析,我们发现RCRG Ⅰ级中LNs≤10枚的患者3年累积生存率高于LNs>10枚组,而在RCRG Ⅱ~Ⅲ级组中,淋巴结数目对患者3年生存率的影响差异不显著,表明淋巴结检出数目确实与肿瘤反应有关,且在肿瘤反应更敏感的RCRG Ⅰ级中对患者的预后影响更显著。Gurawalia等[18]也发现对接受新辅助治疗后肿瘤反应为Ⅱ~Ⅲ级直肠癌患者淋巴结检出数目小于12枚时有着更好的预后。
综上所述,淋巴结检出数目是新辅助放化疗联合手术治疗后患者预后的独立影响因素,且淋巴结检出数目小于10枚的患者3年累积生存率更高,而肿瘤反应越好,淋巴结检出数目对新辅助放化疗患者3年累积生存率影响越大。由于对于最佳临界值的获取目前并没有得到一致的认识,本研究通过ROC曲线确定的临界值可能需要进一步地探讨和研究。总之,本研究发现新辅助放化疗后淋巴结检出数目与低位直肠癌患者的预后有关,并初步发现以送检10枚淋巴结为截断点能有效判断新辅助放化疗后患者的预后,为临床诊疗提供了参考依据。

