亲水作用色谱串联质谱结合反相色谱串联质谱的油料磷脂轮廓分析
赵品贞,陶冠军,刘睿杰,常 明,金青哲,王兴国
(江南大学 食品学院,食品科学与技术国家重点实验室,食品安全与质量控制协同创新中心,江苏 无锡 214122)
磷脂是一类带有磷酸基团的甘油酯,广泛存在于植物油料中。植物油料中的磷脂以磷脂酰胆碱 (PC)、磷脂酰乙醇胺 (PE)、磷脂酰肌醇(PI)等甘油磷脂为主,同时还含有少量的溶血磷脂,即溶血磷脂酰胆碱 (LPC) 和溶血磷脂酰乙醇胺(LPE),不同来源的油料中磷脂组成各不相同[1]。近年来,油料中PC和PE被广泛地研究和应用,但其中的PI和溶血磷脂却鲜有报道。有研究表明,PI可以直接参与许多细胞活动,对神经突触的延伸效果极佳,且具有良好的乳化性能[2-3]。溶血磷脂较甘油磷脂乳化性和抗氧化性更强,在食品、医药和畜牧业等领域得到广泛的应用,市场需求量逐渐增加[4-5]。此外,同类磷脂的不同分子种的功能也存在显著差异,如二亚油酰磷脂酰胆碱(DLPC)在预防脂肪肝病变和心血管疾病方面的效果更为显著[6]。因此,系统研究不同油料中的磷脂结构对开发不同需求的多样化的磷脂高端产品具有非常重要的价值。
目前,常用的磷脂检测技术有薄层色谱(TLC)[7]、核磁共振(31P-NMR)[8-9]、气相色谱(GC)[10]、液相色谱(LC)[11]和质谱(MS)[12-14]等,现有文献中关于油料磷脂分析方法及结果见表1。前4种分析方法虽然操作相对简单,但是分离效果不好,鉴定磷脂分子种的脂肪酸通常需要甲酯化或分离制备等预处理过程,且一般仅能分析样品中磷脂的总脂肪酸组成,不能鉴定每种磷脂分子连接的脂肪酸种类,因而无法实现对磷脂结构的精确分析。MS通常与LC(HPLC或UPLC)串联可得到磷脂更为广泛的分子结构信息。MS离子源大多数采用基质辅助激光解吸(Matrix-assisted laser desorption Ionization,MALDI)和电喷雾(Electrospray ionization,ESI),前者分析磷脂需要烦琐的样品预处理和严苛的实验条件,成本较高,因而 ESI较之使用更为广泛。LC分为正相液相色谱(NPLC)和反相液相色谱(RPLC)两种模式。近年来,一种非常适合于分离极性和亲水性化合物的亲水作用色谱(Hydrophilic interaction chromatography, HILIC)受到各个领域的关注[15]。HILIC具有与NPLC相似的保留性能,常使用水/水溶性有机相洗脱体系,克服了NPLC常采用非极性溶剂而与质谱检测器兼容性较差的缺陷[16],且具有色谱柱渗透性好、反压较低等优势,能基于磷脂亲水头极性的差异将不同类别的磷脂分开。此外,HILIC与RPLC有较好的选择正交性,可进一步根据磷脂非极性尾与固定相之间的疏水相互作用力的差异来分离磷脂分子[17]。因此,结合这两种分离模式,将能极大地提高磷脂的分离效果。同时,以串联质谱作为检测器,不需标准品即可实现磷脂分子种更准确的定性定量分析,可直接得到磷脂分子侧链结构及其脂肪酸组成。

表1 油料磷脂的分析方法及结果
本文采用HILIC模式和RPLC模式相结合的串联四极杆-飞行时间质谱(Q-TOF-MS)技术,对8种植物油料大豆、葵花籽、棉籽、油菜籽、亚麻籽、水飞蓟籽、长柄扁桃仁、美藤果仁的磷脂轮廓进行了全面分析。
1 材料与方法
1.1 实验材料
大豆、葵花籽、棉籽、油菜籽、亚麻籽、长柄扁桃仁、美藤果仁、水飞蓟籽均为市售。
甲醇、氯仿、正己烷、乙醚、异丙醇和乙腈均为色谱纯,美国TEDIA高纯溶剂有限公司;氯化钾和乙酸铵,国药有限公司;氮气和氩气(纯度均≥99.999%),太湖气体有限公司。
ACQUITY UPLC、Q-TOF-MS,美国Waters公司;AB304-S型电子天平、SE812型氮吹仪、固相萃取柱(CNWBOND Si SPE Cartridge,1 g,6 mL),上海安谱实验科技股份有限公司。
1.2 实验方法
1.2.1 总脂提取
参考Bligh[18]的方法进行总脂的提取。油料经粉碎机粉碎后,于4℃保存。将10 g样品与60 mL氯仿-甲醇溶液(体积比2∶1)混合,超声20 min后,过滤得到澄清溶液,向溶液中加入13.5 mL 氯化钾溶液(质量浓度为0.88 g/100 mL),将混合物于4 000 r/min 离心5 min。取下层有机相在氮气流下吹干,得到油料的总脂。
1.2.2 固相萃取(Solid phase extraction,SPE)纯化磷脂
参照Avalli等[19]的方法,利用SPE小柱纯化磷脂。将约500 mg提取的总脂溶于1 mL氯仿-甲醇溶液(体积比2∶1)中。首先用3 mL正己烷活化小柱,然后上样,依次用3 mL正己烷-乙醚(体积比8∶2)和3 mL正己烷-乙醚(体积比1∶1)洗脱弱极性脂和中性脂,最后用4 mL甲醇和2 mL氯仿-甲醇-水(体积比3∶5∶2)洗脱极性脂。将极性脂溶液在氮气流下吹干,用甲醇溶解至溶液质量浓度为1 mg/mL,待进样分析。
1.2.3 磷脂分析鉴定
1.2.3.1 HILIC条件
采用Xbridge-HILIC 色谱柱(100 mm×2.1 mm,1.7 μm,Waters,USA);柱温45℃;进样器温度20℃;洗脱液A为乙腈,洗脱液B为10 mmol/L 乙酸铵溶液;梯度洗脱程序为0~2 min 90% A,2~18 min 90%~60% A,18~20 min 60%~90% A;流动相流速0.3 mL/min;进样体积1 μL。
1.2.3.2 RPLC条件
采用BEH-C18 色谱柱(50 mm×2.1 mm,1.7 μm,Waters,USA);柱温45℃;进样器温度20℃;洗脱液A为异丙醇-乙腈(体积比90∶10),洗脱液B为乙腈-水(体积比50∶50);梯度洗脱程序为0~1 min 40% A,1~20 min 40%~100% A,20~25 min 100%~40% A;流动相流速0.3 mL/min;进样体积1 μL。
1.2.3.3 MS条件
毛细管电压和锥孔电压分别为3.5 kV和30 eV;离子源温度和脱溶剂气温度分别保持在100℃和400℃;脱溶剂气流速为700 L/h。分别采用电喷雾电离源正离子(ESI+)和负离子(ESI-)扫描;采用全信息串联质谱(MSE)模式扫描,扫描时间和间隔扫描时间分别为0.2 s和0.02 s;低碰撞能量设置为6 eV,高碰撞能量范围为20~30 eV;质量扫描范围为m/z50~1 500。在分析过程中,使用亮氨酸脑啡肽(0.3 ng/μL)进行精确质量校正(每30 s),在正离子模式下亮氨酸脑啡肽m/z为556.277 1,在负离子模式下亮氨酸脑啡肽m/z为554.266 0。
1.2.4 数据处理
采用MassLynx V4.1(Waters,USA)对原始数据进行分析。使用Origin 9.1和Microsoft Excel 2019进行数据处理和图表绘制,数据以“平均值±标准偏差”表示。
2 结果与讨论
2.1 不同类型磷脂的分离
根据磷脂极性头的差异,通过HILIC对不同类型的磷脂分子进行分离。以亚麻籽为例,其磷脂的总离子流图见图1。由图1可知,磷脂在20 min之内被洗脱,分离时间短,色谱峰分离度良好,结合质谱信息即可确认磷脂种类并得到同一类型磷脂中的不同分子的准分子离子的m/z。在洗脱过程中,磷脂的洗脱时间在2.0~14.0 min之间,洗脱顺序为PI、PE、LPE、PC和LPC,其保留时间分别为:PI 3.30~4.20 min,PE 8.80~9.20 min,LPE 10.00~10.75 min,PC 10.75~12.00 min,LPC 12.50~13.50 min。
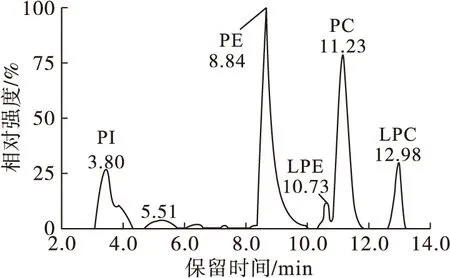
图1 亚麻籽中磷脂的总离子流图
2.2 不同磷脂分子种的分离鉴定
通过HILIC-Q-TOF-MS得到PC、PE、PI、LPC和LPE准分子离子的m/z,再结合C18色谱、MSE扫描模式得到的碎片信息,准确鉴定不同磷脂分子的结构。图2列出了亚麻籽(图2A)、葵花籽(图2B)、油菜籽(图2C)和水飞蓟籽(图2D)PC的提取离子色谱图。由图2可知,8.0~16.0 min为不同种类的PC。C18色谱柱的优势在于可使同一类型磷脂分离出3个以上的峰谱,随后根据其质谱图分析磷脂分子脂肪酸结构。磷脂分子洗脱的顺序与脂肪酸当量碳数(ECN)(ECN=总碳数-总双键数×2)有关,保留时间随着ECN的增加而延长,如亚麻籽PC分子的洗脱顺序从前到后依次为ECN24、26、28、30、32、34。值得注意的是磷脂同分异构体也被分开,例如亚麻籽PC 36∶3的18∶1-18∶2和18∶0-18∶3两种磷脂分子(图2A)以及葵花籽PC 36∶2的两种结构18∶1-18∶1和18∶0-18∶2均可分开(图2B)。此方法分离效果好、灵敏度高,一些含量较低的磷脂分子也得到了鉴定,如油菜籽PC 18∶2-22∶0 分子。
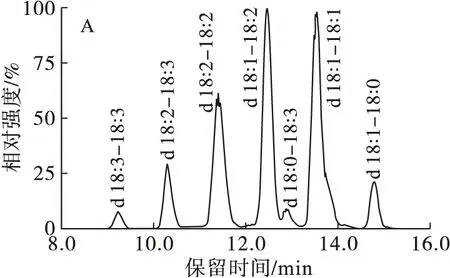
图2 亚麻籽(A)、葵花籽(B)、油菜籽(C)、水飞蓟籽(D)PC的提取离子色谱图
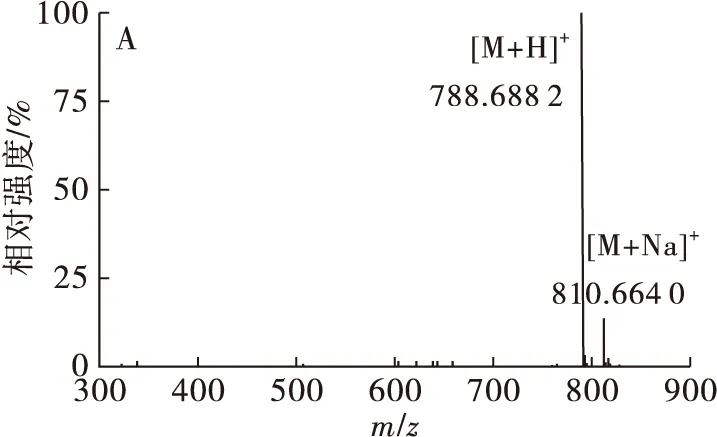
图3 亚麻籽PC 18∶1-18∶0的低能量(A)和高能量(B)ESI+质谱图
PI在ESI+和ESI-模式下均有响应,在ESI+条件下,PI形成[M+H]+的准分子离子峰;在ESI-条件下,PI形成[M-H]-离子,在高能量下产生m/z约241的特征碎片离子 [C6H10O8P]-,同时磷脂酰基端断裂产生[RCOO]-的碎片离子以及[M-H-RCOOH]-。以棉籽PI中1个色谱峰为例:低能量状态下(图4A)的准分子离子峰[M-H]-为m/z833.559 9,确定其相对分子质量为834;高能量状态下(图4 B)的4个碎片离子峰[C3H5O5P]-、[C6H10O8P]-、[M-H-C16H32O2]-、[M-H-C18H32O2]-分别为m/z152.993 7、241.005 8、553.267 7、577.288 9,确定其为一种PI分子,侧链结构为34∶2,计算得到脂肪酸的相对分子质量为256、280,分别对应棕榈酸和亚油酸,故此磷脂为PI 16∶0-18∶2。
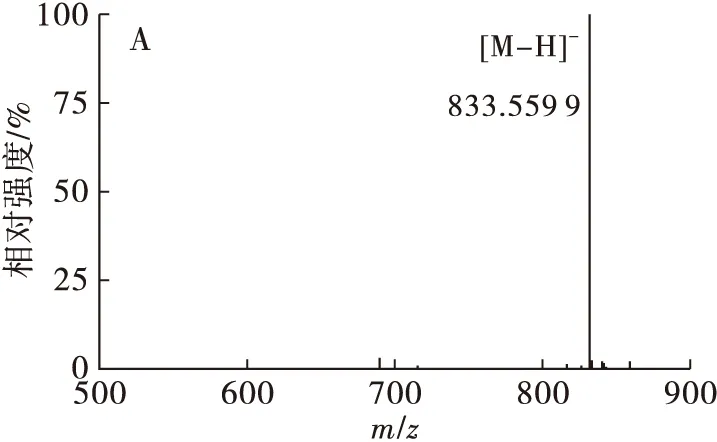
图4 棉籽PI 16∶0-18∶2的低能量(A)和高能量(B)ESI-质谱图
2.3 8种植物油料的磷脂组成
通过以上方法检测,采用面积归一化法计算磷脂含量,8种植物油料中磷脂分子的组成及相对含量见图 5。由图5可知,油料中PE、PC和PI的含量最为丰富,大豆、葵花籽、棉籽中磷脂含量顺序是PE>PC>PI,这与文献[20]结果一致。值得关注的是,油菜籽((27.8±3.48)%)、长柄扁桃仁((26.31±2.08)%)和美藤果仁((23.77±1.40)%)中的PI含量较高,均超过大豆((21.25±1.85)%)。因此,油菜籽、长柄扁桃仁和美藤果仁可考虑作为提供PI的油料原料。对比其他油料,棉籽和亚麻籽的溶血磷脂(LPC和LPE)含量较高,分别为(10.26±1.58)%和(10.93±0.41)%,高于大豆((4.24±0.12)%),另外在葵花籽和油菜籽中未发现溶血磷脂。

注:1.葵花籽;2.美藤果仁;3.大豆;4.油菜籽;5.水飞蓟籽;6.长柄扁桃仁;7.棉籽;8.亚麻籽。图5 油料的磷脂种类及含量
对8种植物油料的5类磷脂的分子种进行了分析,结果如表2所示。与Imbs[21]、Beermann[22]、Wang[23]等的研究相比,除PC和PE之外,本文还实现了对PI、LPC和LPE的分离鉴定,并确定了其脂肪酸组成。由表2可知,8种植物油料中PC和PE的脂肪酸组成多以棕榈酸、油酸、亚油酸和亚麻酸为主,另外,多种油料的PC中含有少量的硬脂酸以及油菜籽的PC中含有少量的山嵛酸。8种油料的PC和PE分子种组成基本相似,分别以PC18∶1-18∶2、PC18∶2-18∶2和PE16∶0-18∶2、PE18∶2-18∶2为主。而油料的PI和溶血磷脂(LPC和LPE)分子种组成差异明显,油菜籽的PI以16∶0-18∶2((26.53±2.56)%)和18∶1-18∶2((28.29±2.45)%)为主,长柄扁桃仁的PI以16∶0-18∶1((56.10±3.96)%)为主,美藤果仁的PI以16∶0-18∶2((24.83±2.37)%)和18∶2-18∶2((19.13±0.21)%)为主。棉籽的溶血磷脂脂肪酸组成以亚油酸为主,LPC 18∶2和LPE 18∶2占比分别为(49.39±2.67)%和(47.17±3.30)%。亚麻籽的溶血磷脂脂肪酸以油酸为主,LPC 18∶1和LPE 18∶1占比分别为(38.34±2.94)%和(26.49±1.21)%。
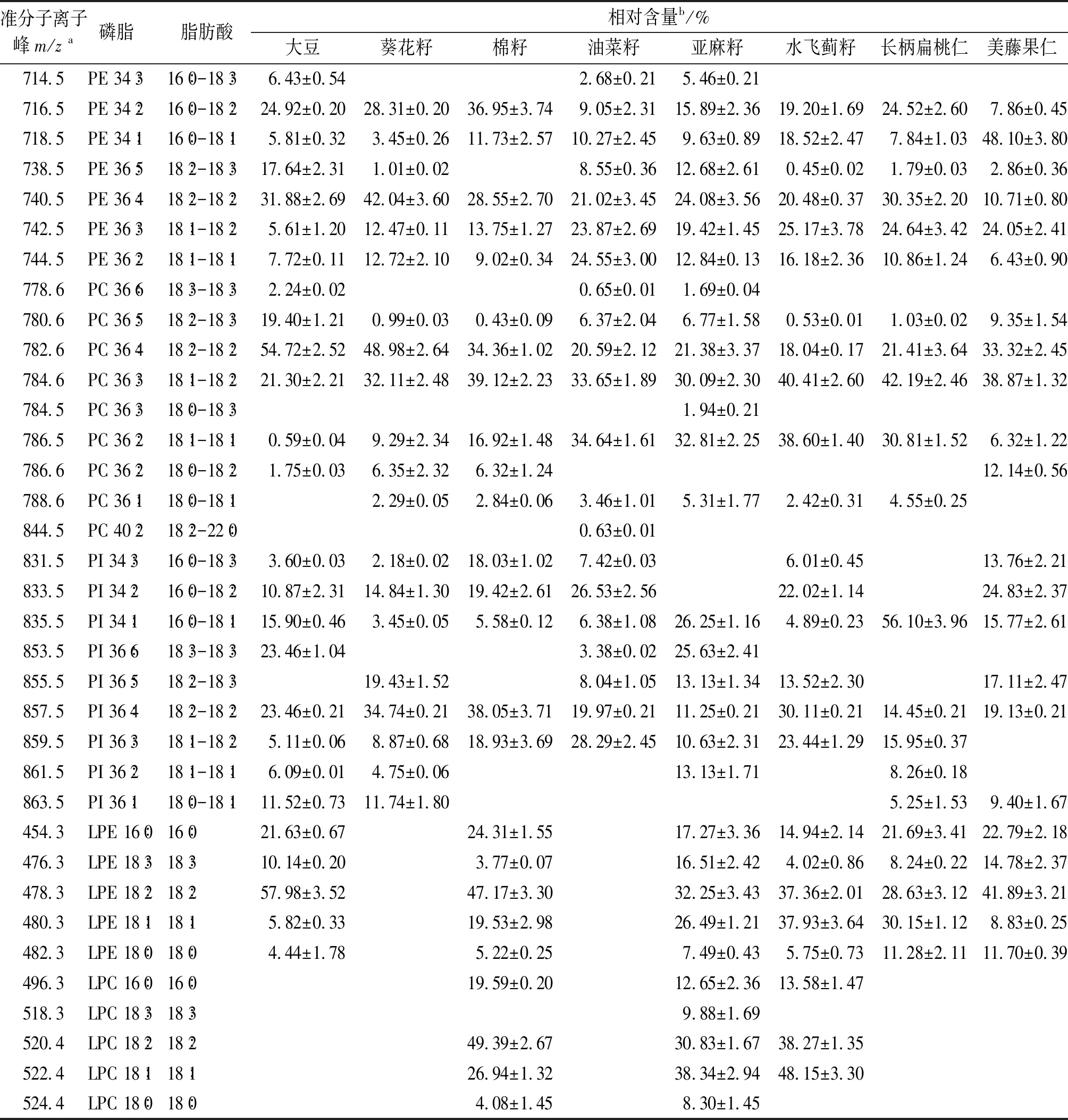
表2 8种油料的磷脂分子种及含量
3 结 论
联合应用HILIC-Q-TOF-MS与RPLC-Q-TOF-MS技术快速准确地分析了8种植物油料的磷脂组成。结果表明,8种油料的PC和PE分子种组成基本相似,分别以PC18∶1-18∶2、PC18∶2-18∶2和PE16∶0-18∶2、PE18∶2-18∶2为主。PI和溶血磷脂(LPC和LPE)分子种组成差异明显,油菜籽((27.8±3.48)%)、长柄扁桃仁((26.31±2.08%))和美藤果仁((23.77±1.40)%)的PI含量均高于大豆((21.25±1.85)%),这3种油料可作为PI的新型来源。油菜籽的PI以16∶0-18∶2和18∶1-18∶2为主,长柄扁桃仁的PI以16∶0-18∶1为主,美藤果仁的PI以16∶0-18∶2和18∶2-18∶2为主。棉籽和亚麻籽的溶血磷脂含量较高,其中棉籽溶血磷脂的脂肪酸组成以亚油酸为主,亚麻籽中则以油酸为主。
本文采用HILIC色谱,使用乙腈和水为流动相,与质谱检测器兼容性更好,分离效果极佳,灵敏度高,能同时分离鉴定出PC、PE、PI、LPC和LPE,使定性分析和定量分析更为准确,并通过C18反相色谱柱分离出磷脂的同分异构体。此外,本文采用MSE扫描模式,样品不需要进行甲酯化等复杂预处理,根据得到的准分子离子和碎片离子信息直接推断油料磷脂脂肪酸组成。PC和LPC的特征碎片离子为[HPO4(CH2)2N(CH3)3]+,PE和LPE的特征碎片离子为[M+H-C2H8NO4P]+,PI的特征碎片离子为[C6H10O8P]-。本研究可为植物油料中磷脂的分离分析提供新方法,为油料中具有特殊生理功能的磷脂产品的开发奠定了基础。
——全棉籽的加工与利用

