氮受控对酒糟废水-微藻培育耦合体系的影响
蒋宜峰,杨世利,魏 威,王 萍,张 利,余 江,4
1)四川农业大学理学院,四川雅安 625014;2)四川大学建筑与环境学院,四川成都 610065;3)四川大学新能源与低碳技术研究院,四川成都 610065;4)四川大学宜宾产业技术研究院,四川宜宾 644000
目前,人类正面临水资源短缺、能源匮乏的双重危机与挑战,基于微藻培养的污水深度处理和生物质能源生产耦合系统由此应运而生,并日益成为众多研究者关注的热点[1-2].微藻生产生物能源过程中,利用污水培养富油微藻,不仅可以利用微藻使污水再生循环利用,还可以为能源微藻生产生物柴油提供资源[3-6].张波等[7]研究表明,以废水作为培养基培养高附加值微藻的关键在于优良藻种的筛选.
氮是构成微藻蛋白质的重要元素,是微藻细胞生长的必要元素之一.不同氮浓度会影响微藻细胞的生长速度,在氮限制状态下,藻体中蛋白质的合成会受到影响,如细胞中蛋白质浓度降低和蛋白质合成停止[8].而在氮浓度异常高的情况下,微藻细胞生长培养基中的氮磷质量比会失调,此时细胞只会过度吸收氮,不利于细胞分裂,从而抑制微藻生长[9-12].只有当培养环境中的氮在一定的浓度范围内才会有利于微藻生长,且不同藻种对氮浓度的要求也存在差异.迄今,有关能源微藻在不同种类废水中的生长特性的研究仍鲜见报道.本研究利用室内受控实验,通过调控酒糟废水的总氮浓度,考察莱茵衣藻和二形栅藻两种微藻在单一和共培养条件下的生长状况、废水中营养盐的吸收去除效率以及微藻藻蛋白质合成情况,获得适合微藻生长的酒糟废水的总氮浓度,对能源微藻与酒糟废水耦合培育体系的深入研究具有重要意义.
1 材料与方法
1.1 实验材料
莱茵衣藻(Chlamydoomonasreinhardtii)和二形栅藻(Scenedesmusdimorphus)均属于绿藻,取自于四川大学藻类学藻种室.
1.2 酒糟废水培养基
本实验所处理的酒糟废水取自中国四川某酒厂.实验前,经多级皂土(250.00 mL液体加入10.00 g皂土)、离心处理(4 800 r/min,10 min),并调节pH值至中性后置于120 ℃高压灭菌30 min,以去除废水中的悬浮物和病原微生物.处理前后废水的pH值、有机物(即化学需氧量,chemical oxygen demand,COD)、总氮(total nitrogen, TN)和总磷(total phosphorus, TP)等物理化学指标见表1.

表1 酒糟废水基本物理化学指标
通过预处理,采用不同稀释倍数(原水的体积分数为100%;稀释2倍后体积分数为50%;稀释4倍后体积分数为25%;稀释8倍后体积分数为12.5%)的酒糟废水用于培养微藻,发现在未稀释废水的培养基中微藻均未能有效繁殖,而在不同稀释倍数培养条件中微藻均能生长良好,可能是由于废水在未稀释状态下含有其他浓度较高的有毒有害物质,从而对微藻生长造成一定影响.
1.3 实验方法与指标测定
1.3.1 实验方法
本研究以稀释2倍的酒糟废水作为培养基,调节总氮初始浓度,设置5.00、14.00、40.25、120.00、360.00和1 100.00 mg/L等6个质量浓度梯度组,分别独立培养莱茵衣藻和二形栅藻,同时设置两种微藻的共培养实验组.其中,每组设3个平行对照组,对照组总氮的初始质量浓度为40.25 mg/L,而培养基中总磷质量浓度(16.4 mg/L)及其他介质条件保持不变.设置培养条件为:温度为(25±1)℃,光照强度为2 000 lux,每天人工摇动培养瓶使微藻始终均匀悬浮于培养液中,定期取一定量培养液,测定微藻生物量(恒质量法),以及培养液总氮、总磷和有机物质量浓度和pH值等指标.实验周期为17 d.
1.3.2 指标测定方法
1)微藻生物量、比生长速率测定.把藻细胞沉淀置于60~80 ℃箱烘干至恒质量,取出后于干燥器中自然冷却并称其质量.微藻比生长速率μm为衡量微藻细胞生长的指标之一,计算公式[12]为
(1)
其中,X1是起始取样时间t1的生物量;X2是结束取样时间t2的生物量.
2)蛋白质产量测定.采用改良考马斯亮蓝G-250 染色法测定上清液中的蛋白质浓度,即微藻的蛋白质质量浓度(按鲜质量计)[13].
3)氮、磷和有机物的吸收速率和去除率测定.氮、磷和有机物的吸收速率v计算公式[12]为
(2)
其中,ρ0为起始时培养液中TN、TP和COD的质量浓度;ρt为结束时培养液中TN、TP和COD的质量浓度;V为培养液体积;t为培养时间.
TN、TP和COD的去除率r为
(3)
1.4 数据统计与分析
运用Microsoft Excel 2016和SPSS 22.0软件进行数据统计分析,并用OriginPro 9.1软件制图.
2 结果与讨论
2.1 氮调控对微藻生长特性的影响
不同N质量浓度条件下,各组微藻生长趋势如图1和图2.由图1和图2可见,不同的总氮质量浓度对微藻生长的影响比较明显.实验周期内,当初始TN质量浓度为5 mg/L时,莱茵衣藻、二形栅藻和共培养下的μm分别为0.258、0.160和0.175 d-1,均为实验组最低.随着TN质量浓度升高,μm先升后降,莱茵衣藻的μm在TN质量浓度为120 mg/L时达到最大值0.390 d-1,与初始TN质量浓度分别为40.25 mg/L(0.380 d-1)和360.00 mg/L(0.386 d-1)时相比,μm分别上升了2.67%和1.06%;二形栅藻和共培养微藻均在初始TN质量浓度为40.25 mg/L时达到最大值,分别为0.32 d-1和0.35 d-1.

图1 氮调控下微藻的生长曲线
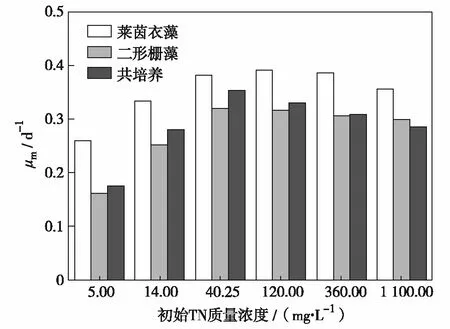
图2 氮调控下微藻比生长速率的比较
初始TN质量浓度较低组(5.00 mg/L和14.00 mg/L),前7 d内,微藻生长速度随着培养时间延长,呈增长趋势,但总体滞后于其他实验组,到第 7 天开始生长进入平缓期.实验结束时,初始TN质量浓度为5.00 mg/L 的莱茵衣藻和二形栅藻的生物量均处于较低水平,分别为110.0 mg/L和37.5 mg/L,同样,共培养条件下的最终生物量也仅约37.5 mg/L;而初始TN质量浓度为14.00 mg/L的莱茵衣藻和二形栅藻,生物量最终达388.00 mg/L和175.00 mg/L,共培养条件下生物量达到223.75 mg/L,也明显低于其他组.
初始TN质量浓度40.25 mg/L和360.00 mg/L两组的莱茵衣藻呈现出良好的生长趋势,直到第11天其生长速率才均有所降低,最终生物量分别达到879.5 mg/L和974.5 mg/L.对于单一培养条件下的二形栅藻,初始TN质量浓度为40.25 mg/L和360.00 mg/L时,在培养前9 d内生长趋势同步,到第11天时TN质量浓度为40.25 mg/L组的生物量达到最大,为775 mg/L,TN浓度为360 mg/L组在第13天生物量达到562.5 mg/L.莱茵衣藻和二形栅藻共培养条件下,同样的初始TN质量浓度,最终生物量分别达到762.50 mg/L和356.25 mg/L.
从图1可看出,初始TN质量浓度为120 mg/L组的莱茵衣藻生长最佳,从第3天开始生长速度明显增大,到第9天开始其生物量已高于其他组,实验结束时生物量高达1 045 mg/L.二形栅藻单一培养条件下,前7天内,微藻生物量随培养时间呈快速上升趋势,并在第7 d达到最大值(743.75 mg/L).实验发现,共培养条件下的微藻生长曲线低于单一培养条件,实验结束时微藻生物量达到500 mg/L,这与控氮变磷条件下共培养的微藻生长曲线略高于单一培养下的二形栅藻有一定差异[6],表明共培养体系的影响因素更为复杂.从图1还可见,组莱茵衣藻明显受到了环境中高浓度氮的胁迫,且随着培养时间的增长,培养基中仅有的磷被消耗殆尽,出现了氮磷质量比极度失调的情况,而细胞对氮营养的过量吸收,不利于细胞分裂,从而生长受到明显的抑制[9],也导致该组莱茵衣藻的最终生物量比其他组低很多.
2.2 氮调控对微藻蛋白质浓度的影响
氮调控下微藻蛋白质质量浓度的变化见图3.由图3可见,不同培养条件下的微藻蛋白质质量浓度整体上均随培养时间的增加而逐渐增多,但TN质量浓度为5.00 mg/L和14.00 mg/L组的蛋白质质量浓度均明显处于较低水平,尤其是5.00 mg/L组的蛋白质质量浓度始终处于最低,培养到第17天时莱茵衣藻和二形栅藻的蛋白质质量浓度最终分别为5.64 mg/L和8.25 mg/L,共培养条件下的微藻蛋白质质量浓度为5.10 mg/L.相关研究发现,低氮水平改变了微藻与脂肪酸生物合成相关的碳代谢,使光合作用形成的糖类由于氮的缺乏,不能有效合成氨基酸,转而形成脂肪酸积累在细胞内[14-15].在氮缺乏时,随着培养时间的增加,微藻在营养缺乏的培养基中生长,生理活动不能正常进行,藻体蛋白质等内含物合成减弱,细胞分裂减缓或受阻,细胞生长迟缓[8].TN质量浓度为1 100 mg/L组的蛋白质质量浓度也始终保持较低水平,其中,莱茵衣藻最终蛋白质质量浓度仅有48.08 mg/L,这可能是因为该组的氮磷质量比严重失调,氮质量浓度超高(意味着严重的磷限制),处于这样的培养环境中,藻细胞分裂受到强烈抑制,生物量低,导致莱茵衣藻蛋白质质量浓度比其他组都低.
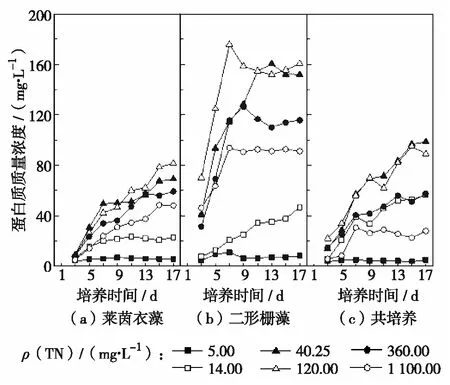
图3 氮调控下微藻蛋白质质量浓度的变化
当初始TN质量浓度为120 mg/L时,微藻蛋白质合成情况最好,最终莱茵衣藻蛋白质质量浓度为81.48 mg/L,二形栅藻蛋白质质量浓度为160.62 mg/L,共培养微藻蛋白质质量浓度为88.96 mg/L.此外,总氮质量浓度在40.25~360.00 mg/L时,微藻蛋白质合成情况较好,这可能是因为在氮充足等环境良好的情况下,藻体细胞代谢正常,生长良好,蛋白质等细胞内初级代谢产物能正常合成[16].
2.3 氮调控下微藻对氮磷及有机物去除效果的影响
2.3.1 不同N质量浓度下微藻对TN去除效果的影响
从图4和图5可知,莱茵衣藻对TN的吸收速率随TN质量浓度的升高逐渐上升,单一培养下的二形栅藻和共培养下的两种微藻对TN的吸收速率随着TN质量浓度的升高先降后升.当初始TN质量浓度为40.25 mg/L时,二形栅藻和共培养下微藻对TN的吸收速率最终分别为0.090 1 d-1和0.066 8 d-1.当初始TN质量浓度为1 100 mg/L时,3种培养条件微藻TN吸收速率分别为1.776 6、2.628 8 和4.254 9 d-1.莱茵衣藻对TN的去除率随着初始TN质量浓度的增加先升后降.TN质量浓度为14 mg/L的莱茵衣藻,TN去除量达到13.32 mg/L,去除率最高达95.15%,基本达到了地表水环境质量标准(GB 3838—2002)的III类水总氮要求(≤1.5 mg/L)[2].初始TN质量浓度低于40.25 mg/L时,二形栅藻和共培养的微藻对TN的去除效率几乎保持一致,均高于同等培养条件下莱茵衣藻对TN的去除效率,但无明显差异(P>0.05).随着初始TN质量浓度升高,二形栅藻对TN的去除优势在3种微藻中显得更加明显.初始TN质量浓度为1 100 mg/L时,微藻的TN去除量急剧增加,达到所有实验组中的最大值,分别为788.55 mg/L(莱茵衣藻)、801.27 mg/L(二形栅藻)和777.33 mg/L(共培养),但去除率均在70%左右.

图4 氮调控下微藻对TN吸收速率的比较
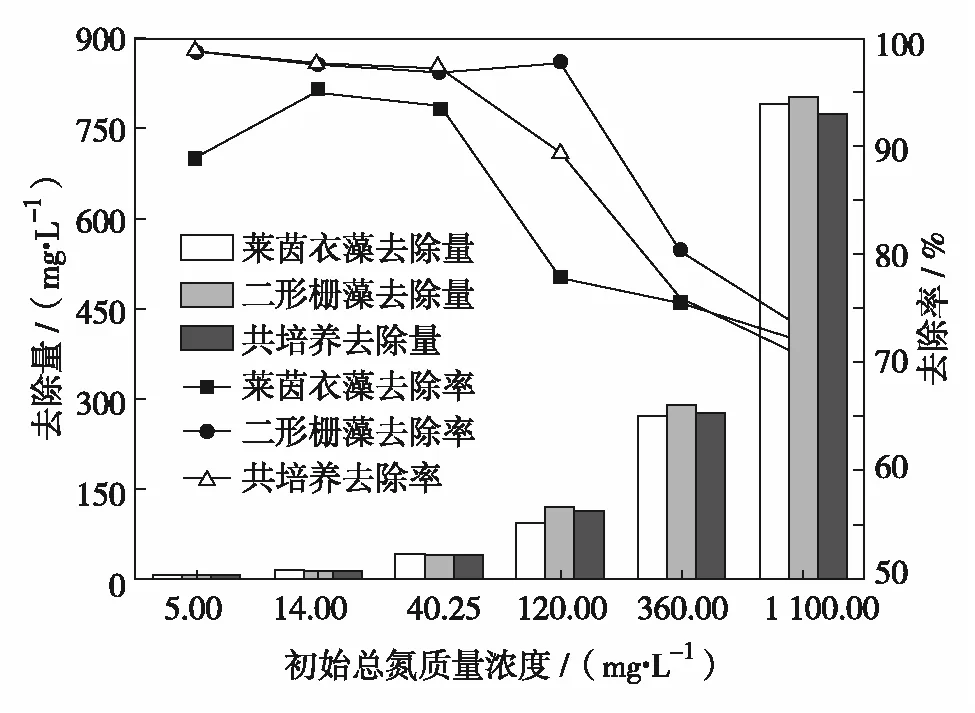
图5 不同N质量浓度下微藻对TN去除率及去除量的比较
根据式(3)可知,当微藻对TN的吸收量一定时,微藻质量越低,单位质量的微藻对TN的吸收速率越高.由于TN质量浓度为1 100 mg/L时,微藻生长均受到不同程度的抑制,藻细胞对TN过量吸收,不利于藻细胞的分裂[9],从而出现TN去除量高而藻体生物量低的情况,致使该实验组微藻的TN吸收速率比其他组明显增大.
综合比较各实验组中微藻对TN的吸收速率、去除率和去除量可知, 初始TN质量浓度为40.25 mg/L时,微藻对TN的去除效果最优,莱茵衣藻、二形栅藻和共培养下的微藻对TN的去除率分别达到93.68%、96.85%和97.37%,基本达到了地表水环境质量标准(GB 3838—2002)的IV类水总氮的要求(≤1.5 mg/L)[2].
2.3.2 氮调控下微藻对磷去除效率的影响
实验周期内,各组微藻对TP的吸收速率、去除率及去除量见图6和图7.总磷的去除路径主要包括藻体的吸收作用和磷酸盐的吸附沉淀作用.对比废水中3种微藻培养下的TP浓度变化(图6)与微藻的生长曲线(图1)可知,TP去除与微藻的生长趋势基本吻合.

图6 氮调控下培养液中TP质量浓度的变化

图7 不同N浓度下微藻对TP去除率和去除量的比较
对莱茵衣藻来说,当初始总氮质量浓度大于14 mg/L 时,TP的去除率均超过80%,尤其当氮磷质量比为2.45、初始总氮质量浓度为40.25 mg/L时,对TP的最终去除量达14.89 mg/L,去除率达90.81%;当初始总氮质量浓度为5 mg/L时,藻体对TP的去除率最终只有9.81%.此外,莱茵衣藻对TP的去除效率明显高于二形栅藻.当初始总氮质量浓度为40.25 mg/L时,二形栅藻和共培养下的微藻对TP的去除率只有70.80%和74.74%.共培养下微藻对TP的去除效果与二形栅藻较为一致,这也说明在共培养条件下二形栅藻对废水的资源化利用起主导作用,并可能对莱茵衣藻吸收TP起到一定程度的抑制,这与本课题组就控磷对二形栅藻吸收磷营养盐的研究结果基本一致[6].
王海英等[17]利用城市污水培养蛋白核小球藻,发现在培养第6 天时,培养基中TP的去除率已达到80%以上,但随培养时间延长,去除效果逐渐变低,与本实验结果较为接近.经处理后,废水中总磷质量浓度基本达到发酵酒精与白酒工业水污染物排放标准(GB 27631—2011)间接排放小于3.0 mg/L 的要求.
2.3.3 氮调控下微藻对COD去除效果的影响
实验周期内,各组微藻对酒糟废水中COD的吸收速率、去除率及去除量见图8和图9.随着培养时间的延长,酒糟废物水培养基中COD的质量浓度呈现明显下降趋势,实验结束时,莱茵衣藻实验组COD的质量浓度均达到最低值,各实验组中COD的质量浓度分别为87.5、182.0、512.5、502.0、547.5和570.0 mg/L,COD去除率最大分别达到62.28%、72.00%、72.57%、73.12%、70.68%和69.48%.从图9可见,总体上莱茵衣藻对COD的去除效果低于二形栅藻,但不存在显著性差异.而二形栅藻各实验组COD的质量浓度在实验初期随着微藻的生长呈明显降低趋势,到第13天实验组培养基内COD的质量浓度达到最小值,分别为37.0、82.0、259.5、317.0、510.0和820.0 mg/L,COD最大去除率分别达84.05%、87.38%、86.10%、83.03%、72.69%和56.09%.随着培养时间延长,第13天后培养基内COD的质量浓度逐步增大,可能是因为藻体在生长一段时间后,由于培养基内营养物质的减少及光照不足等原因,藻体自身分泌产生一些有机物,降低微藻自身对COD的去除效果.共培养条件下微藻对培养基内的COD去除规律与二形栅藻类似,在第15天左右实验组培养基内的COD质量浓度达到最小值,分别为32.0、87.0、272.5、385.0、660.0和795.0 mg/L,COD的最大去除率分别达86.21%、86.62%、85.41%、79.38%、64.66%和57.43%.经处理后,废水中COD的质量浓度基本达到发酵酒精与白酒工业水污染物排放标准(GB 27631—2011)间接排放小于400 mg/L的要求.

图8 氮调控下培养液中COD质量浓度的变化

图9 不同N质量浓度下微藻对COD去除率和去除量的比较
3 结 论
1)单一培养条件下,莱茵衣藻对磷的需求总体上大于二形栅藻对氮的需求,当初始TN质量浓度为40.25 mg/L、初始氮磷质量比为2.45时,莱茵衣藻最终生物量达879.5 mg/L,藻蛋白质量浓度达69.00 mg/L,对TN、TP和COD的最终去除率分别达到93.68%、90.81%和72.57%;二形栅藻的生物量最高达775 mg/L,藻蛋白质量浓度达154.53 mg/L,对TN、TP和COD的最终去除率分别达到96.85%、70.80%和82.06%.
2)共培养条件下,莱茵衣藻在生长方面和对氮磷等资源化利用方面受二形栅藻抑制影响较明显,当初始TN质量浓度为40.25 mg/L、初始氮磷质量比为2.45时,对TN和TP的去除率分别为97.37%和74.74%;共培养条件下微藻对酒糟废水COD的去除规律与二形栅藻类似.
3)利用酒糟废水-微藻培育耦合体系,单一培养体系和共培养体系,酒糟废水水质总体均能达到地表水环境质量标准(GB 3838—2002)和发酵酒精与白酒工业水污染物排放标准(GB 27631—2011)的要求.

