功能与疾病中的RBFox蛋白家族
魏朝亮,夏 明,谷明瑶
广东省基因组稳定性与疾病防治重点实验室,深圳大学医学部基础医学院,广东深圳518060
真核细胞中广泛存在着核糖核酸(ribonuleic acid, RNA)结合蛋白,其中脊椎动物中有数千个,而人类的RNA结合蛋白至少有3 000个[1].RNA结合蛋白通常含有一个或多个RNA结合结构域,包括RNA识别基序、双链RNA(double-stranded RNA)结合结构域、K-同源(K-homology, KH)结构域(I型和II型)等,能够识别并结合RNA[2].大部分RNA结合蛋白与前体mRNA(pre-miRNA)形成不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein, hnPNPs),并存在于细胞核中,还有一些则与成熟mRNA结合存在于细胞质当中[3].RNA结合蛋白在多种细胞生物学过程中起重要作用,除了RNA剪接这个传统功能外,它们还广泛参与从脱氧核糖核酸(deoxyribo nucleic acid, DNA)复制和RNA合成到蛋白翻译的整个调控过程[1].
RBFox家族是一类古老且重要的 RNA 结合蛋白家族,普遍存在于从低等生物(如线虫和昆虫)到高等哺乳动物体内的特定组织细胞当中[3].fox基因最初是在线虫中被鉴定并克隆出来,通过调节性别基因的可变剪接来调控线虫的性别[4].目前已知的RBFox蛋白家族有RBFox1(又称A2BP1或Hrnbp1)、RBFox2(又称Rbm9、Fxh、Hrnbp2或RTA)和RBFox3(又称Hrnbp3、D11Bwg0517e或NeuN).RBFox1主要在横纹肌(心脏与骨骼肌)和大脑中高度表达[5],并能促进生殖细胞增殖分化[6];RBFox2的表达较为广泛,除了大脑、横纹肌、卵巢和干细胞,还在胚胎发育过程中高度表达[7-8];RBFox3主要在大脑组织中表达,是神经元成熟的标志物[9].RBFox蛋白均含有一个高亲和力、进化保守的RNA识别结构域RRM[10],优先结合RNA的(U)GCAUG基序并发挥其生物学功能[3].在结构上,RBFox蛋白的RRM结构域为典型的β1α1β2β3α2β4结构,包含4个反向平行的β折叠和2个α螺旋,这种特殊的分子结构域赋予了RBFox蛋白对RNA异常高的亲和力和特异性[10].
近年来,针对RBFox蛋白功能的研究发现,其与多种疾病的发生有着莫大的关联.本课题组的前期研究发现,在压力超负荷引起的心力衰竭模型中,RBFox2蛋白几乎缺失,并伴随着心脏兴奋-收缩耦联功能的明显下调[11].随后,文献[12]研究揭示了RBFox2-Mir-34a-Jph2通路在心力衰竭发展过程中起关键作用.为进一步了解RBFox蛋白的研究进展,本文就RBFox蛋白在生物学功能以及疾病方面的研究成果进行评述,给后期的研究提供借鉴.
1 RBFox蛋白的生物学功能
1.1 RBFox蛋白的剪接调节功能
可变剪接是真核生物特有的调节机制,通过可变剪接过程,单个基因可以编码出具有不同结构和不同生物学功能的蛋白质,是蛋白质多样性的重要来源[13].RBFox蛋白最经典的作用是参与RNA加工过程中的可变剪接,如图1(c),可通过直接结合(U)GCAUG序列发挥剪接调节作用[14].RBFox蛋白调节可变剪接具有位置依赖效应,RBFox蛋白剪接作用的激活或抑制,取决于它们结合位点所处的位置,结合位点位于外显子上游,RBFox蛋白能抑制剪接作用,但位于外显子下游时则激活剪接作用[14].RBFox蛋白也可以通过远端内含子区域中进化保守的RNA桥(RNA-RNA二级结构)相互作用而调节mRNA的可变剪接[15].除此之外,RBFox还能通过其C末端结构域(C-terminal domain, CTD)与大型剪接调节因子复合物(large assembly of splicing regulators, LASR)结合形成RBFox/LASR复合物而发挥剪接调节作用[16-18],RBFox的剪接激活需要通过其富含酪氨酸的域进行自我聚合,CTD中的低复杂性(low complexity, LC)序列包含重复的酪氨酸,其介导RBFox/LASR的高级组装[17].充分且全面地了解RBFox蛋白调节可变剪切的具体机制可为疾病的发生机制的研究提供更多的理论依据.JACKO等[19]认为RBFox蛋白调节的剪接程序增加了AnkG对β红膜肽的亲和力,促进有丝分裂后神经元的结构与功能的成熟.SINGH等[20]在成年小鼠骨骼肌中敲除高度保守的RBFox1和RBFox2选择性剪接调节因子后,发现小鼠肌肉质量迅速下降,认为RBFox的缺失致数百个基因转录物的剪接发生改变,损害骨骼肌质量和破坏蛋白质稳态.
1.2 RBFox蛋白的转录调节功能
RBFox蛋白在RNA转录过程中也发挥了重要作用.HU等[12]发现,在小鼠心肌细胞中发现RBFox2能够招募Polycomb复合物2(polycombrepressive complex 2, PRC2),来抑制基因的转录活性(图1(a)).文献[3,12]研究显示,RBFox2沉默后能消除大多数双价基因启动子上PRC2的靶向作用,从而影响转录过程.RBFox2蛋白通过结合在转录起始区域与染色体联合的新生RNA相互作用,能与体内负责催化组蛋白H3第27位赖氨酸的甲基化修饰的PRC2复合体直接偶联,介导PRC2复合体在全基因组的定位来抑制转录.除了小鼠心肌细胞,类似的机制也在小鼠胚胎成纤维细胞(MEFs)、小鼠胚胎肌母细胞(C2C12)以及人的肾上皮(293T)和宫颈癌(Hela)细胞系中得到了确证.有意思的是,RBFox2与PRC2复合体的结合区域在RBFox2独特的C末端结构域,而该结构域与家族内其他两个RBFox蛋白的相似度很低,提示RBFox2在转录层面的调控作用要大于其他两个RBFox蛋白.
1.3 RBFox蛋白对miRNA代谢的调节功能
RBFox蛋白可调节microRNA(miRNA)的代谢.miRNA 是一类内源基因编码的长约22个核苷酸的非编码单链RNA 分子,它可通过抑制翻译和调节mRNA 的转录后降解来调控基因表达,是机体正常发育和维持细胞稳态所必不可少的分子.SAYED等[21]研究表明,miRNA表达的失调能诱导许多人类疾病的发生[21].CHEN等[22]发现,RBFox1和RBFox2能与miRNA的初级转录产物的末端区域结合,抑制miRNA从初级转录产物向miRNA前体转变,从而抑制miRNA的生物合成,如图1(d).KIM等[23]通过紫外交联免疫沉淀结合高通量测序的方法(crosslinking-immunprecipitation and high-throughput sequencing, CLIP-seq),在神经元分化的P19细胞和小鼠中枢神经系统中发现,RBFox3能直接与miRNA的初级转录产物(pri-miRNA)结合,一方面通过与pri-miRNA末端环的结合,促进核酸内切酶对pri-miRNA的切割加工而促进miRNA的合成,另一方面通过与pri-miRNA的茎区结合而抑制核酸内切酶的切割加工来抑制miRNA的合成.HU等[12]发现在压力超负荷引起的心力衰竭模型中,RBFox2蛋白缺失会通过转录调控作用诱导一系列miRNA上调,造成心脏兴奋-收缩耦联功能明显下调,最终导致心脏衰竭.
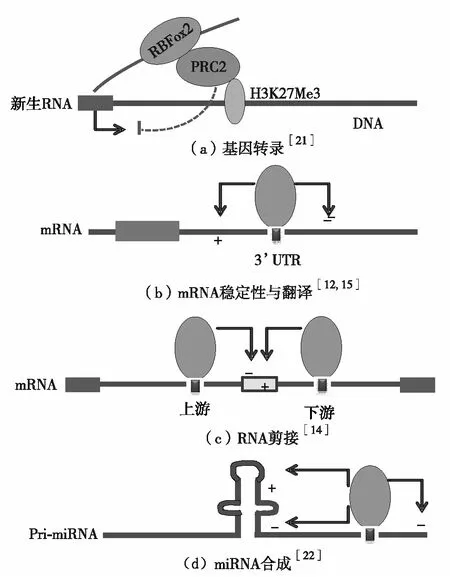
图1 RBFox蛋白在基因转录、mRNA稳定、RNA剪接以及miRNA代谢等多层面的调控作用
1.4 RBFox蛋白对mRNA的稳定性的调节功能
文献[12,15]研究表明,RBFox蛋白还能调控mRNA的稳定性(图1(b)).在3’非编码区(3’UTR)中,具有(U)GCAUG序列转录物的丰度与许多组织中的RBFox蛋白表达量呈正相关,RBFox蛋白通过富集于mRNA的3’UTR 区域,提高了mRNA的稳定性和蛋白翻译水平[12,15].有意思的是,在不同物种中,RBFox1蛋白与细胞质中的3’UTR(U)GCAUG结合作用有所不同.小鼠中的RBFox1蛋白通过与细胞质中3’UTR(U)GCAUG基序的结合提高mRNA的稳定性,增加了mRNA丰度并促进了翻译[24],但是果蝇细胞质中的RBFox1与其3’UTR中的(U)GCAUG序列结合能抑制mRNA的表达[13].VERMA等[25]在内源性RBFox2水平极低的COS M6细胞中诱导表达野生型RFBox2后,相对于RBFox2剪接缺陷表达组而言,Pnn、Spcs1、Ddx39和Mcm7等带有RBFox2结合位点的基因mRNA水平显著提高,其中,Pnn是辅助剪接激活因子,Ddx39则为一种具有pre-mRNA剪接与转录活性的RNA解旋酶,Mcm7是DNA复制和细胞生长的重要调节因子,RBFox蛋白的正常表达能提高这些参与细胞周期和代谢等基因的mRNA稳定性,保护其不被降解,从而维持这些基因在机体内的正常调控作用.
2 RBFox蛋白在多种疾病中的调控作用
越来越多的研究将编码RNA结合蛋白的基因突变与各种疾病联系起来,突出了这些蛋白质在人类健康方面的重要性.RBFox作为重要的RNA结合蛋白,在调节疾病发生方面发挥重要作用.
2.1 心脏疾病
心脏疾病是一类较常见的循环系统疾病,主要包括先天性心脏病、冠心病、高血压性心脏病、风湿性心脏病以及心肌病等.数据显示,RBFox蛋白在心脏中高度表达,对于维持心脏的各种功能发挥着不可替代的作用.KALSOTRA等[26]研究发现,RBFox蛋白不同亚基在小鼠生命不同阶段表达量存在差异.其中,RBFox1主要在小鼠出生后的心脏中诱导表达;RBFox2在小鼠心脏的整个发育过程均有普遍的表达.已有大量研究表明,RBFox蛋白通过介导剪接调节过程来维护心脏功能的正常运行.在RBFox蛋白表达异常或缺失的情况下,能引发一系列心脏疾病的发生.在对心力衰竭方面的研究显示,RBFox2的沉默能导致心脏失代偿而引发扩张性心肌病,最终导致心力衰竭[11].在WEI等[11]建立的小鼠心脏横向主动脉缩窄(transverse aortic constriction, TAC)诱导心力衰竭模型中发现,TAC处理后RBFox2蛋白大大减少,这很可能在功能上与压力超负荷引起的心力衰竭相关.HU等[12]提出在压力超负荷引起的心力衰竭模型中,RBfox2的缺失能上调Mir-34a miRNA的表达,它直接靶向心脏兴奋-收缩耦联关键蛋白Junctophilin-2(JPH2).在小鼠体内实验证实,系统性地给予Mir-34a拮抗剂能够恢复JPH2蛋白的表达,从而减轻RBFox2缺失所导致的心力衰竭,揭示了RBFox2-Mir-34a-Jph2通路在心力衰竭发展过程中起关键作用,可通过Mir-34a拮抗剂干预心力衰竭,为晚期心脏疾病的治疗提供新思路和新靶点[12].GAO等[27]在小鼠心力衰竭心脏中发现,RBFox1表达的缺失显著加重了压力超负荷诱导的心脏肥大症状,并增加了小鼠的死亡率,而恢复RBFox1的表达活性后可显著改善RNA剪接重编程,缓解压力超负荷诱导的小鼠心脏病理性肥大和应激性心力衰竭的症状.在对斑马鱼中的研究结果显示,敲除RBFox1导致进行性心脏收缩功能障碍和心力衰竭,将RBFox1和 RBFox2同时敲低后导致剪接错误调节,从而引起心脏和骨骼肌缺陷[28].众所周知,Ca2+对维持心脏功能异常重要,血管平滑肌细胞的电压门控L型钙通道(L-type calcium channels, LTCC)Cav1.2的激活引起Ca2+内流,对维持血管肌源性张力和血压起着关键作用.WANG等[29]发现在扩张型心肌病(dilated cardiomyopathy, DCM)患者的心脏中,RBFox1表达量显著低于健康心脏,他们认为RBFox1是通过调节Cav1.2外显子33 的可变剪接,从而参与扩张型心肌病和缺血性心肌病的发生.尽管已经有很多研究表明RBFox蛋白在心脏疾病中的作用,但影响RBFox2表达的机制还需深入研究.
2.2 神经系统疾病
神经系统疾病多发生于中枢神经系统和周围神经系统,主要表现为感觉、运动、意识和神经功能障碍,给患者的生活和工作带来诸多不利.YEO等[8, 30]研究显示,RBFox蛋白在神经细胞中高度表达,在神经元发育和分化过程中起重要作用,有助于成熟神经元细胞的特异性表达,RBFox蛋白的缺失能诱发一系列神经系统性疾病.RBFox1基因缺失病患常伴有面肩肱型肌营养不良症(facioscapulohumeral muscular dystrophy, FSHD)、大头畸形,以及小头畸形等多种神经发育和神经精神疾病[31].而RBFox2在中枢神经系统(central nervous system, CNS)的特异性丧失会破坏小脑发育[32].在小鼠的研究中显示,敲除RBFox3基因后,小鼠出现冷痛觉过敏和认知能力受损等症状[33].PINTO等[34-36]研究均表明,RBFox蛋白与癫痫、自闭症谱系障碍(autism spectrum disorders, ASD)、阿尔茨海默病(Alzheimer’s disease, AD)等神经系统疾病有关.一方面,RBFox能通过调节mRNA的稳定性来影响ASD或AD的发生.例如,在对ASD患者的研究发现,RBFox1能通过增加结合位点mRNA的稳定性来调节ASD相关基因的表达[37],而在AD患者中,RBFox1的下调可致编码突触传递蛋白的mRNA不稳定,造成突触功能的丧失[38].另一方面,RBFox表达水平改变导致的剪接调节异常也能影响ASD或FSHD的发生[32],但具体机制尚不清楚.
2.3 糖尿病
糖尿病是由胰岛素分泌不足或生物学作用受损,或两者兼有导致的一组以高血糖为特征的代谢性疾病.临床上主要通过治疗手段控制糖尿病患者的血糖水平,目前尚无根治方法.JUAN-MATEU等[39]研究显示,RBFox基因的沉默能促进胰岛素的分泌而增加胰岛素的含量,降低糖尿病患者的血糖水平,但也会引发可变剪接异常并导致心脏糖尿病并发症[40].VERMA等[41]发现在患I型糖尿病的小鼠心脏早期发育阶段,RBFox2以蛋白激酶C(PKC)依赖性方式被磷酸化,进而调节整个基因组的可变剪接.鉴于RBFox蛋白与糖尿病之间存在的重要联系,对RBFox蛋白的研究显得尤为重要.明确RBFox蛋白在糖尿病中的调控机制,不仅有利于糖尿病的控制与治疗,还能对糖尿病心脏病并发症研究提供帮助.
2.4 癌症
癌症又名恶性肿瘤,是危害人类健康的重大疾病之一.由于肿瘤本身的复杂性,一直是研究的热点,也是难点.肿瘤转移是引发癌症病人死亡的首要原因.肿瘤细胞的侵袭转移一方面主要是通过上皮间质转化(epithelial-mesenchymal transition, EMT)来实现,它能促进原发癌的侵袭和转移,在癌症转移过程中发挥着重要的作用.研究证明,RBFox蛋白在不同肿瘤细胞中涉及大量剪接[42-43],肿瘤细胞在EMT期间发生的可变剪接中也有部分受RBFox蛋白调节[44].除剪接调控作用,研究者还发现在肝癌细胞当中,RBFox3蛋白一方面能调节5-氟尿嘧啶(5-FU)介导的肝癌细胞EMT过程来抑制细胞迁移和侵袭[45],另一方面通过调节人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)信号通路促进肝癌细胞的生长、迁移和侵袭[46].RBFox蛋白敲除后能导致与EMT相关的蛋白如E-钙粘蛋白表达水平下调[47].RBFox主要通过介导EMT过程参与肿瘤细胞的转移,但肿瘤转移的机制和途径极为复杂,RBFox蛋白调控的具体机制有待深入和完善.
2.5 其他疾病领域
已有研究表明,RBFox调节的可变剪接除了对斑马鱼的心脏和骨骼肌功能维持至关重要外[48],还能通过调节与肌肉分化相关的剪接转换来促进成肌细胞融合[49].RBFox1的沉默不但能造成肌肉细胞骨架畸变[50],且会损害视觉感知能力[51].另外,内皮细胞缺失RBFox2能抑制血小板和巨噬细胞的可变剪接程序,从而导致动脉粥样硬化[52].
结 语
目前,对RBFox蛋白功能与机制的研究多数是借助动物模型或人类病理组织中的神经组织和肌肉组织,在其他病理组织中功能与调控机制的研究却鲜见报道.研究表明,RBFox蛋白在肿瘤细胞中高度表达,且能影响恶性肿瘤细胞的侵袭与迁移能力,鉴于肿瘤本身的复杂性,RBFox蛋白介导的肿瘤转移相关调控机制仍然值得更多的研究者去探索.虽然RBFox蛋白在细胞多层次的调控方面取得了突出的进展,但如何在复杂组织中彻底敲除RBFox仍是一个难以攻克的问题,一旦解决,必能为人类相关疾病的治疗提供更准确有效的方法.
现有研究成果多侧重于对RBFox1与RBFox2的功能与机制研究,对RBFox3功能与机制的研究却寥寥无几,因此,加强对RBFox3的研究有助于填补整个RBFox蛋白家族调控网络中的空白.另外,大部分的研究提出RBFox蛋白能通过调节剪接过程或mRNA稳定性等方式来影响疾病的发生,但上游调控RBFox蛋白的关键因子及其相关机制至今尚未阐明.因此,完善RBFox蛋白在机体当中的整个调控过程,对于多种疾病的临床治疗具有重大意义.

