长期继代培养的转基因苹果外源基因遗传及表达稳定性分析
李玉生 陈 龙 程和禾 赵艳华 吴雅琴 李友刚 吴永杰
(河北省农林科学院 昌黎果树研究所,河北 昌黎 066600)
利用基因工程技术对果树进行基因改造,可以克服传统果树育种的局限性[1-2],同时也是研究基因功能和调控机制的一个重要手段。转基因植物的离体保存需要进行多次继代培养,在此过程中培养的外植体有可能发生遗传变异[3-4],包括染色体的缺失、增加[5]和染色体组的加倍[6-8],甚至遗传物质的改变,其中遗传物质的改变主要表现为DNA甲基化水平的改变,并且甲基化水平的改变会随着继代次数的增加而改变[9-10]。从而导致外源基因的丢失、失活或基因重排进而影响外源基因在转基因植株中传递的稳定性。
外源基因能够稳定遗传并高水平表达是转基因果树进入生产环节的先决条件[11]。目前,关于外源基因遗传稳定性的研究在转基因水稻[12-13]、大豆[14-16]、玉米[17]、棉花[18-19]以及苹果[2]等作物中有很多报道,但这些研究主要集中在有性繁殖方面。在无性繁殖情况下关于外源基因在转基因苹果中的遗传稳定性方面的研究只有少量报道,如王倩倩等[20]对继代培养13年的转CpTI基因和NPTII基因苹果中外源基因的DNA进行检测,发现外源基因可以在长期继代保存的组培苗中稳定存在,此研究中只在染色体DNA水平上验证了外源基因的稳定性,并没有验证转录水平和转录后水平上外源基因的稳定性。Flachowsky等[21]研究结果表明在部分继代4年的转attE基因组培苗中T-DNA可以稳定遗传,并发现在部分株系间呈现表达差异及基因沉默现象,但在此研究中并没有研究功能基因attE基因的遗传表达稳定性。有研究表明受体中的内源基因有可能与外源基因产生共抑制从而导致外源基因沉默或表达不稳定的现象[22]。
许多国家对转基因植物的大田试验有着严格的限制,以防止基因漂移等潜在的生态安全问题。利用组织培养无性繁殖的方法保存转基因植物种质可以防止这种情况的出现[23-24]。然而,关于利用无性繁殖手段进行长期继代保存的转基因苹果中外源基因的遗传稳定性的研究鲜有报道。本研究以离体培养9年(继代95次)的转基因苹果组培苗为试材,采用卡那霉素(Kan)抗性筛选、PCR/RT-PCR、qRT-PCR和荧光显微检测等技术对长期培养的苹果组培苗中外源基因的遗传稳定性和不同株系间的表达差异进行分析,旨在为转基因苹果后代稳定地离体保存提供参考,以期为进一步研究转基因苹果中外源基因的整合及表达机制奠定理论基础。
1 材料与方法
1.1 试验材料
供试材料为本实验室保存9年的苹果(MalusdomesticaBorkh.)品种‘嘎拉’的同一个转化试验中7个独立转基因株系组培苗。转化用根癌农杆菌菌株为EHA105,购自生工生物工程(上海)股份有限公司;转化载体为携带GFP基因(绿色荧光蛋白基因)的pCAMBIA-1302载体,购自武汉转导生物实验室有限公司;转化方法为农杆菌介导的叶盘转化法[25]。继代培养基为:MS+3.0 mg/L 6-BA+0.25 mg/L NAA+200 mg/L 羧苄青霉素(Cef)+50 mg/L Kan+30 g/L蔗糖+6.8 g/L琼脂;继代培养条件为:25 ℃,2 500 lx光照强度,每5周继代1次。
1.2 试验方法
1.2.1PCR/RT-PCR扩增检测转基因植株中外源GFP基因的遗传稳定性
采用CTAB法提取对照植株和转GFP基因植株基因组DNA,根据质粒载体pCAMBIA-1302中GFP基因序列设计PCR/RT-PCR反应特异引物GFPS/GFPA(表1),进行PCR扩增,检测基因组中GFP基因存在情况;用Trizol提取试剂盒(天根生化科技(北京)有限公司)根据操作说明提取野生型和转化株系总RNA;用生工生物工程(上海)股份有限公司的AMV First strand cDNA Synthesis Kit进行反转录合成第一链cDNA,利用PCR/RT-PCR反应特异引物GFPS/GFPA(表1)进行RT-PCR扩增,检测GFP基因在长期保存的转基因苹果组培苗中的转录情况。
PCR/RT-PCR反应程序为:94 ℃预变性5 min;94 ℃变性40 s,53 ℃退火1 min,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min。扩增片段约620 bp。1.0%琼脂糖凝胶进行电泳,溴化乙锭染色,在紫外凝胶成像系统下观察结果并拍照。
1.2.2转基因植株中外源NPTII基因及卡那霉素抗性检测
以基因组DNA为模板,扩增引物NPTII-S/NPTII-A(表1),进行PCR扩增。PCR/RT-PCR反应程序为:94 ℃预变性5 min;94 ℃变性40 s,49 ℃ 退火1 min,72℃延伸1 min,共30个循环;最后72 ℃延伸10 min。扩增片段长为790 bp。
取继代培养的转化株系和非转基因植株组培苗新梢,接种在含有Kan 50 mg/L的继代培养基(MS+3.0 mg/L 6-BA+0.25 mg/L NAA+200 mg/L Cef+30 g/L蔗糖+6.8 g/L琼脂)中,40 d后观察对照植株与转化植株的生长状况。
1.2.3荧光显微观察检测转基因植株中外源GFP基因的表达稳定性
在Olympus BX51(Olympus Optical Co.,Japan激发光谱450~490 nm)荧光显微镜下检测7个转基因株系组培苗刚发育成叶的茎尖组织,观察不同转化株系中外源GFP基因的表达情况,拍照记录并用Image J软件分析光密度值。
1.2.4外源GFP基因的相对荧光定量PCR分析
采用1.2.1节中方法提取野生型和7个独立的转化株系总RNA,并进行反转录合成第一链cDNA,-20 ℃下保存备用。
根据GFP基因序列设计荧光定量特异引物GFP-F/GFP-R(表1),扩增长度为116 bp。内参基因为苹果Actin-7基因,内参基因引物为Actin-Fn/Actin-Rn(表1),扩增长度为151 bp。GFP基因的相对荧光定量分析,按照ABI公司的SybrGreen PCR Master Mix试剂盒说明进行扩增。荧光定量PCR反应在Roche公司的LightCycler480 Software Setup型荧光定量PCR仪上进行,反应程序是 95 ℃ 预热3 min;随后95 ℃ 15 s,60 ℃ 40 s,进行40个循环,然后4 ℃保存。根据2-ΔΔCT法[26]计算GFP基因在mRNA水平上的相对表达量。
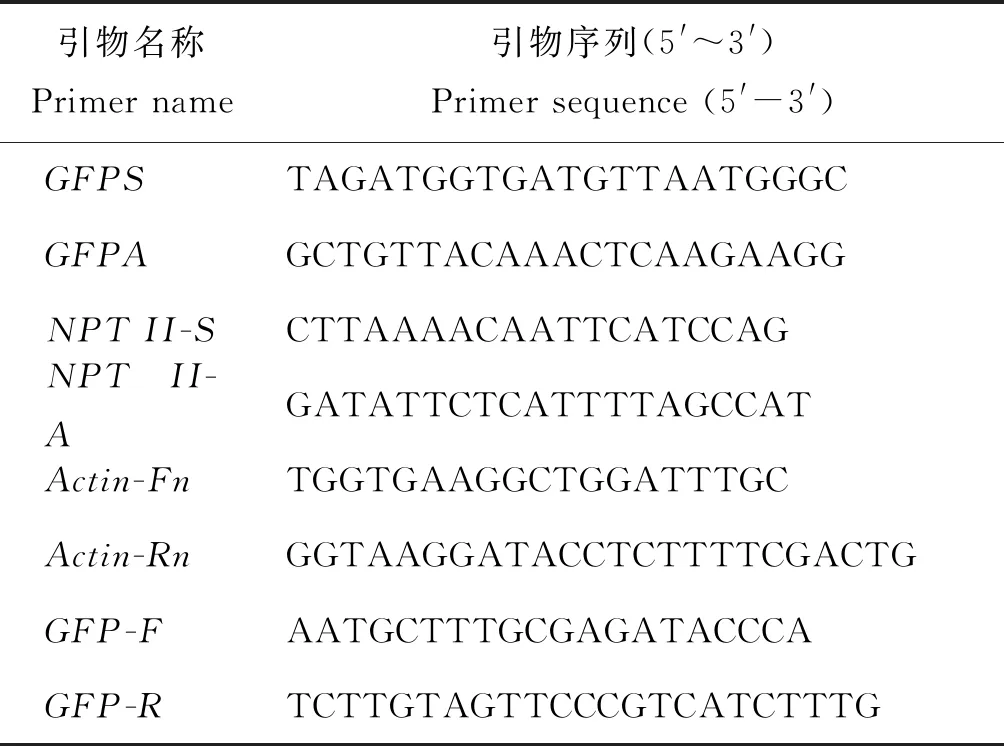
表1 PCR/qRT-PCR引物序列Table 1 Primer sequences for the PCR and qRT-PCR amplification
1.2.5拷贝数与表达量相关性分析
使用SPSS Statistics 17.0数据处理软件对不同转基因株系的外源基因的拷贝数与mRNA水平表达量进行皮尔森相关性分析。
2 结果与分析
2.1 转基因苹果中外源GFP基因的PCR/RT-PCR检测
由图1可知,对照组均未扩增出任何条带,而在所有苹果转基因植株中均扩增符合预期的条带。PCR/RT-PCR扩增结果说明GFP基因在苹果‘嘎拉’转基因组培苗中离体继代培养9年后仍然稳定存在,并且能够正常转录。
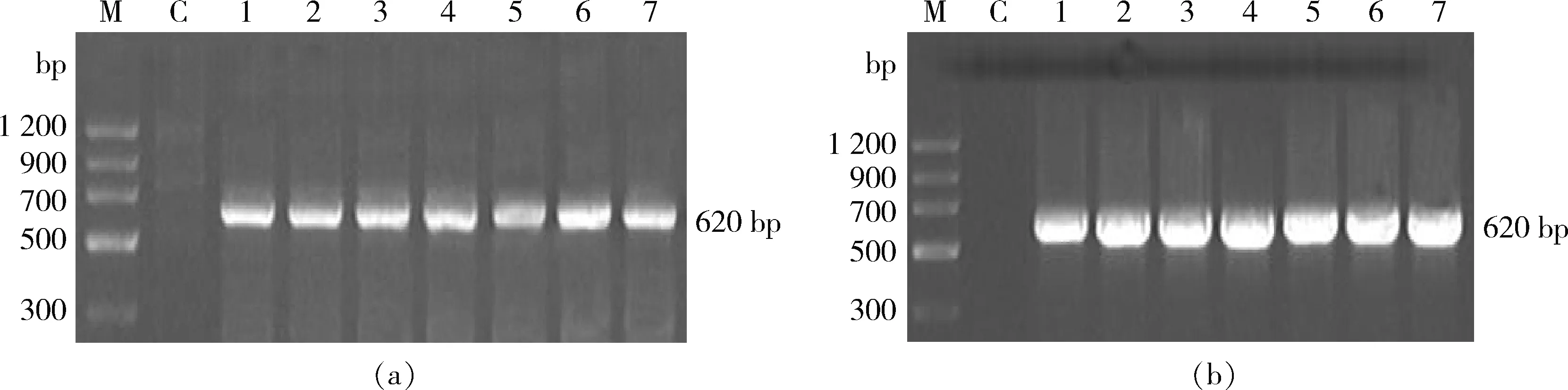
M, 2 000 bp marker; C,对照 control; 1, gp6410; 2, gp5601; 3, gp1414; 4, gp3408; 5, gp3417; 6, gp3418; 7, gp3602。图1 转GFP基因苹果‘嘎拉’组培苗PCR(a)和RT-PCR(b)检测Fig.1 PCR (a) and RT-PCR (b) analysis of GFP gene in transgenic plantlets in vitro of ‘Gala’ apple
2.2 转基因植株中外源NPT II基因及卡那霉素抗性检测
由图2可知,所有转基因株系均扩增出1条790 bp的特异条带,野生型对照植株未扩增出特异条带。说明外源NPTII基因在苹果转基因组培苗中离体继代培养9年后仍然稳定存在。
对在含有Kan 50 mg/L的继代培养基上生长40 d后的野生型植株及各转化系植株进行形态学观察发现,在卡那霉素的筛选压力下7个转化株系均能正常生长,叶片均表现出有活力的绿色(图2(b))。野生型植株呈现出活力下降、生长缓慢,并且叶片变为棕褐色,趋于死亡(图2(c))。结果表明,NPTII基因在继代9年的转化株系中不但稳定存在而且还可以正常表达,并表现出卡那霉素抗性。

M, 2 000 bp marker; C, 对照 control; 1, gp6410; 2, gp5601; 3, gp1414; 4, gp3408; 5, gp3417; 6, gp3418, 7, gp3602。图2 转基因植株中外源NPT II基因及卡那霉素抗性检测Fig.2 Detection of exogenous NPT II gene and kanamycin resistance in transgenic plants
2.3 转基因苹果外源基因拷贝数
内参Actin-7基因标准曲线的直线回归相关系数R2=0.997 5,说明线性关系重复性较好,可以满足荧光定量的标准曲线精度要求。Actin-7基因Ct值与模板初始拷贝数之间的相关性方程为:y=-3.212x+52.64,其中y代表Ct值,x代表模板初始拷贝数对数值。
GFP基因的标准曲线的直线回归相关系数R2=0.996,线性关系重复性较好。GFP基因Ct值与模板初始拷贝数之间的相关性方程为:y=-3.140x+49.13,其中y代表Ct值,x代表模板初始拷贝数对数值。
对7个不同转化株系进行绝对荧光定量PCR反应,每个株系设置3个重复。获得各转化株系Ct值(表2)。根据内外源基因的标准曲线方程,计算各转化株系对应的外源基因初始模板拷贝数,并由外源基因相对于内参基因的比值估算相对拷贝数[27-28](表2)。
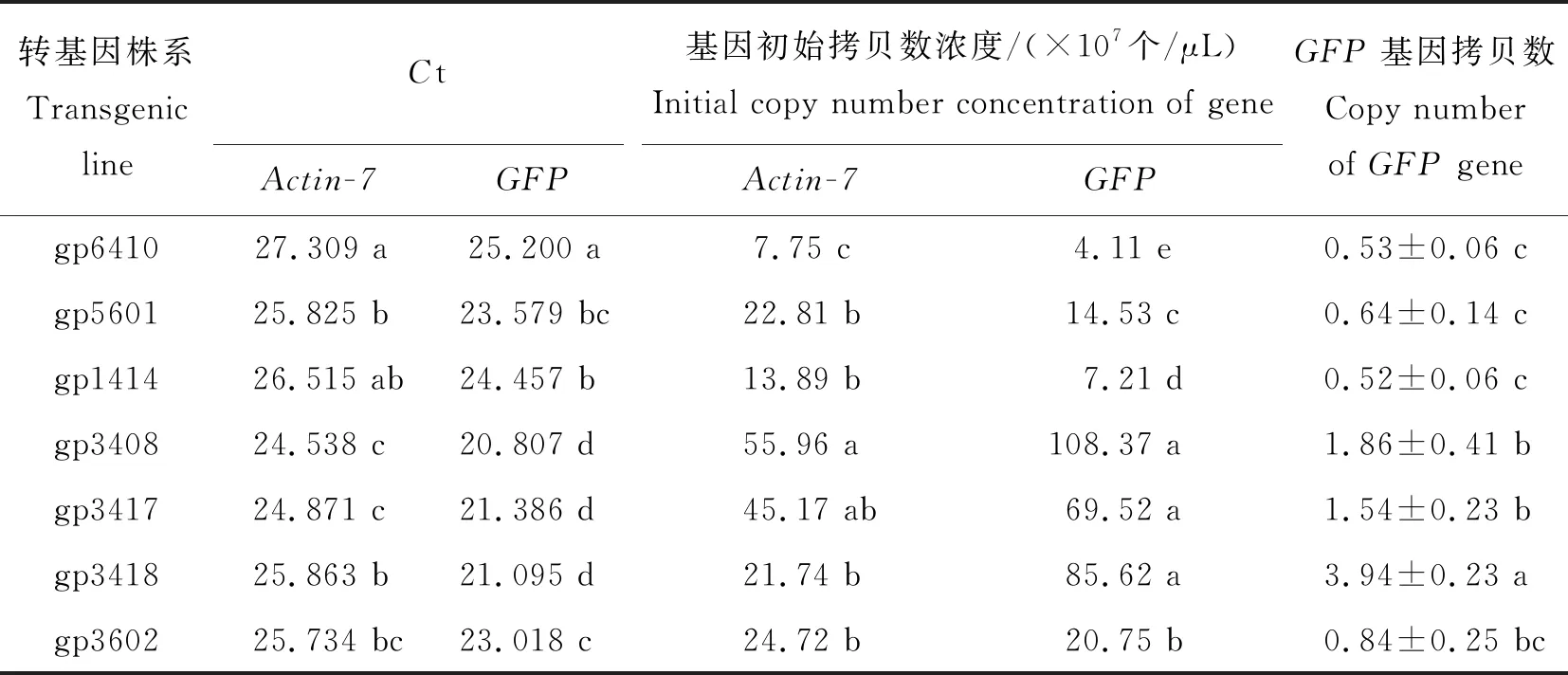
表2 Actin-7基因和GFP基因在7个转化株系中的Ct值及拷贝数Table 2 Ct values and copy number of Actin-7 gene and GFP gene in 7 transformed lines
2.4 荧光显微镜检测转基因株系GFP基因的表达情况
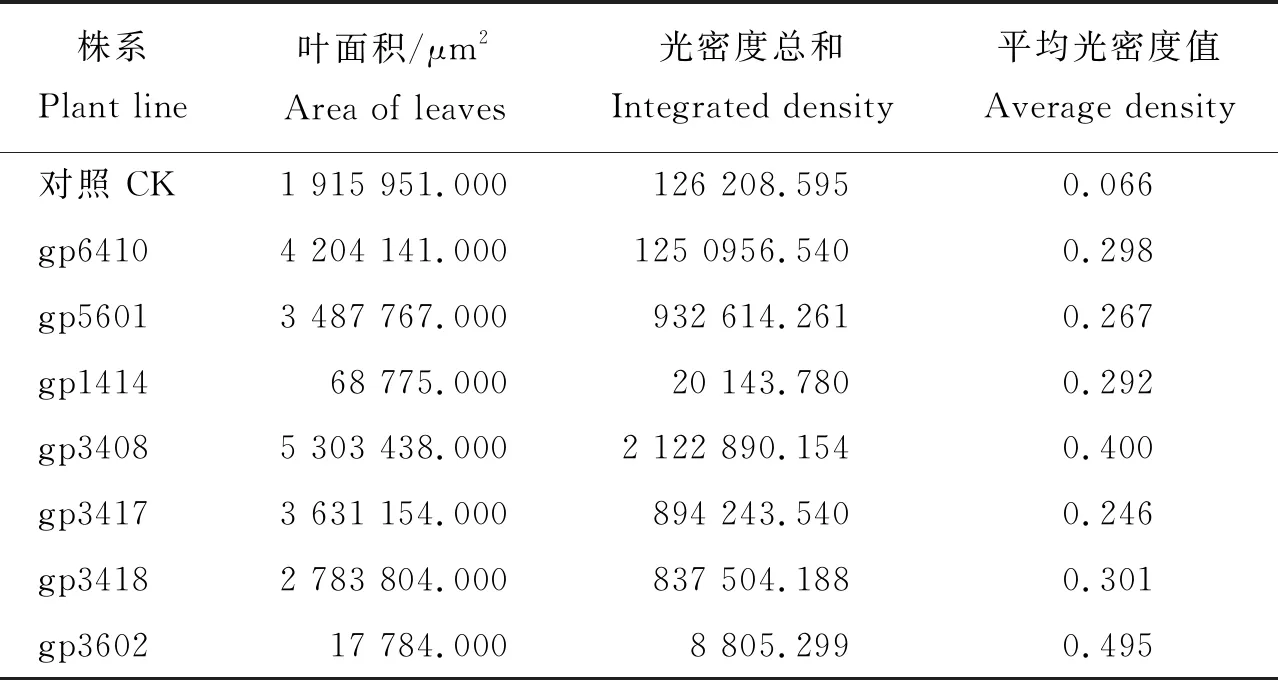
在荧光显微镜下检测,7个转GFP基因株系的嫩叶均不同程度地发出绿色荧光(图3)。由表3可知,7个转GFP基因株系的嫩叶发出的绿色荧光表达强度有明显差异,其荧光强度由弱至强的排序为:gp3417 (a) 对照植株 Control; (b) gp6410; (c) gp5601; (d) gp1414; (e) gp3408; (f) gp3417; (g) gp3418; (h)gp3602图3 荧光显微镜观察继代培养9年的转基因苹果叶片GFP基因表达情况(标尺=500 μm)Fig.3 Expression of GFP gene in transgenic apple leaves cultures for 9 years under fluorescence microscope (Scale bar=500 μm) 表3 7个不同转基因株系的绿色荧光平均光密度值Table 3 The average density of the green fluorescent in 7 different transgenic lines 由图4可知,野生型植株中没有检测到GFP基因的表达;7个苹果转化株系中GFP基因均有转录表达,相对表达量分别为1.00、0.53、0.51、2.76、0.21、1.44和5.80,GFP基因表达量有显著差异(图4),表达量由低至高的排序为:gp3417 将外源GFP基因的拷贝数与转基因苹果的GFPmRNA的表达量进行皮尔森相关性分析结果显示:皮尔森相关系数r=-0.009,说明拷贝数与表达量呈极弱负线性相关;双尾检验的显著性P为0.984,说明GFP基因在mRNA水平上的表达量与其拷贝数无显著相关性(表4)。 外源基因的遗传稳定性主要包括目的基因整合的遗传稳定性、目的基因表达的稳定性和目标性状表现的稳定性等方面[29]。已有研究表明离体培养的植物在多次的扩繁与继代过程中经常会出现体细胞无性系变异,变异率最高可以达到30%~40%[30],转基因植株经过多次继代保存后也有可能受到体细胞无性系变异的影响,从而导致外源基因的丢失、失活或基因重排进而影响外源基因在转基因植株后代中的遗传稳定性,制约了转基因植物在生产中的应用。 WT, 野生型植株wild type plants; gp6410, gp5601, gp1414, gp3417, gp3418 and gp3602 represent transgenic lines. 不同字母表示在0.05水平上差异显著。Different letters in each column indicate significant difference at 0.05 level according to Tukey Test.图4 转基因苹果外源GFP基因mRNA表达量Fig.4 Expression of GFP gene mRNA in transgenic apple 表4 转基因苹果外源基因拷贝数与GFP mRNA 表达量的相关性Table 4 Correlation analysis between GFP mRNA expression and exogenous gene copy number of transgenic apples 本研究在外源基因的整合稳定性、转录水平以及表达水平3个方面评价了7个长期在含有 50 mg/L 卡那霉素筛选压下培养的转基因苹果株系。7个转化株系均由含有NPTII、GFP基因的pCAMBIA-1302载体进行转化。 通过PCR/RT-PCR扩增,所有株系中均可检测到NPTII基因和GFP基因,将7个转化株系的组培苗接种在含有卡那霉素的培养基上,所有转基因株系均表现有卡那霉素抗性,而非转基因植株则逐渐死亡,同时,荧光检测结果显示7个转化株系均呈现不同强度的绿色荧光。以上研究结果说明外源基因可以在长期保存的组培苗中稳定遗传,并且在转基因植株中能正常表达NPTⅡ蛋白和GFP蛋白,但7个不同株系间GFP基因的表达强度并不一致。此现象在其他转基因植物中也广泛存在[31-33],说明在转基因植物中经常会发生外源基因在受体植物中的表达活性受到抑制而导致不同转化株系间外源基因表达不一致、各独立转化体间表型出现显著差异的现象[34]。 基因的表达水平高低直接由其转录本的丰度体现,转录本的丰度越高,则该基因的表达水平越高[35]。相对荧光定量PCR结果表明,7个不同转化株系间GFP基因的表达量有显著差异,且各株系间外源基因表达量与荧光平均光密度值基本一致(表3和图4),只有gp5601和gp1414这2个株系绿色荧光强度和mRNA表达量对应关系相反。综上,7个不同转化株系之间外源基因的遗传差异主要发生在转录水平上,即由DNA转录为mRNA的过程中。转录水平的基因沉默主要有2种影响因素:一是外源基因整合位点处于高度甲基化的转录活性较低的区域,导致外源基因失活不稳定引起基因沉默[32,35-36];二是外源基因在转基因植物中的拷贝数也可以引起基因沉默,当外源基因以单拷贝整合到多个位点或串联的多拷贝整合到一个位点或多个位点均可造成外源基因不同程度的失活[33,37]。 本研究通过对外源基因表达有显著差异的7个转基因株系进行外源基因拷贝数鉴定发现,转基因苹果不同株系间外源基因的拷贝数并不尽相同(表2),并且将外源基因的拷贝数分别与mRNA的表达量进行皮尔森相关性分析后发现两者呈现极弱负相关,并没有显著的相关性。在组培过程中DNA甲基化水平的变化趋势不同与外植体的类型有较大关系[10],如:在火龙果中随着继代次数增加,DNA甲基化水平增加0.9%[38];在大麦上的研究结果表明随着继代次数的增加DNA甲基化水平反而降低[39];而石斛组培苗在经过4次继代后并没有发现DNA的甲基化[40]。在本研究中同为单拷贝的株系gp6410、gp5601、gp1414和gp3602之间mRNA表达量有显著差异,这种现象说明外源基因的整合位点的确可以影响其mRNA的表达量,但这种表达量的差异是由于外源基因整合位点基因组序列本身的差异引起,还是因为继代过程中整合位点的DNA序列甲基化水平变化造成,还有待进一步研究。在7个转基因株系中以单拷贝gp3602株系表达量最高,而多拷贝的株系gp3408、gp3417和gp3418的表达量并没有随着拷贝数的增加而升高,此现象可能是由于多个高度相似的内源基因的存在抑制了外源基因的表达,相关性分析结果显示它们之间并没有显著相关性,说明还有其他因素影响转基因苹果中外源基因的表达,也有待进一步研究。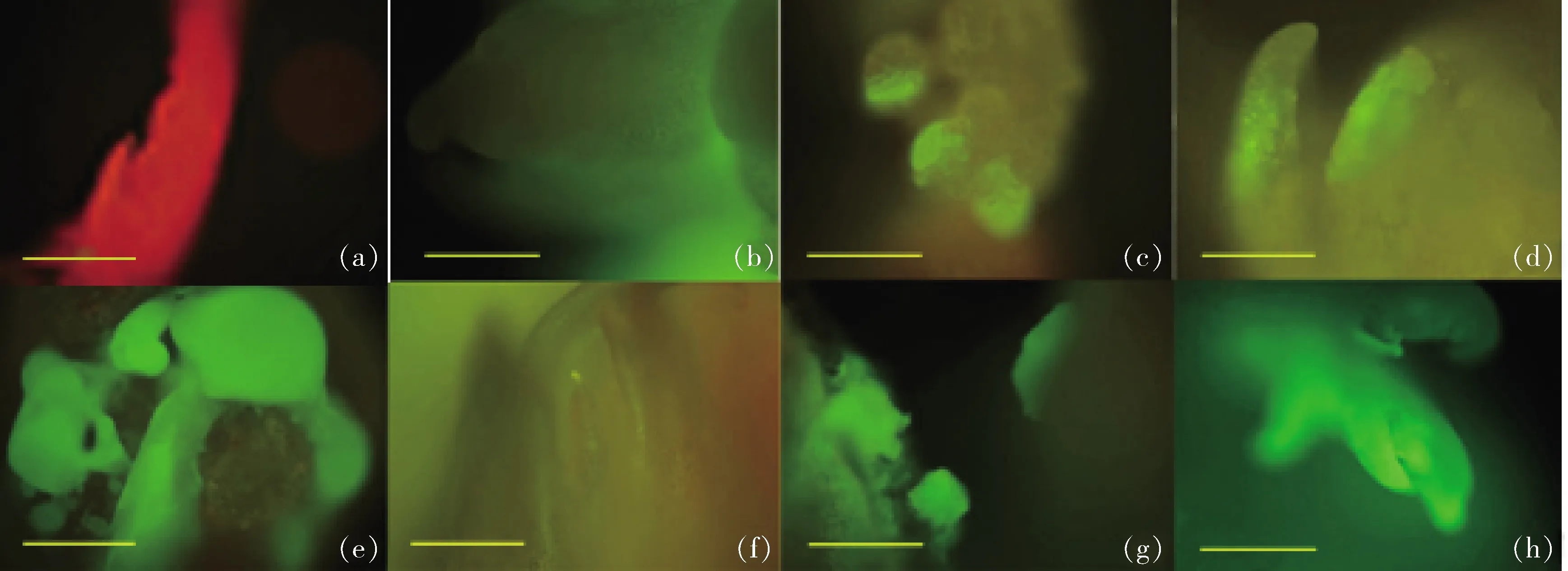
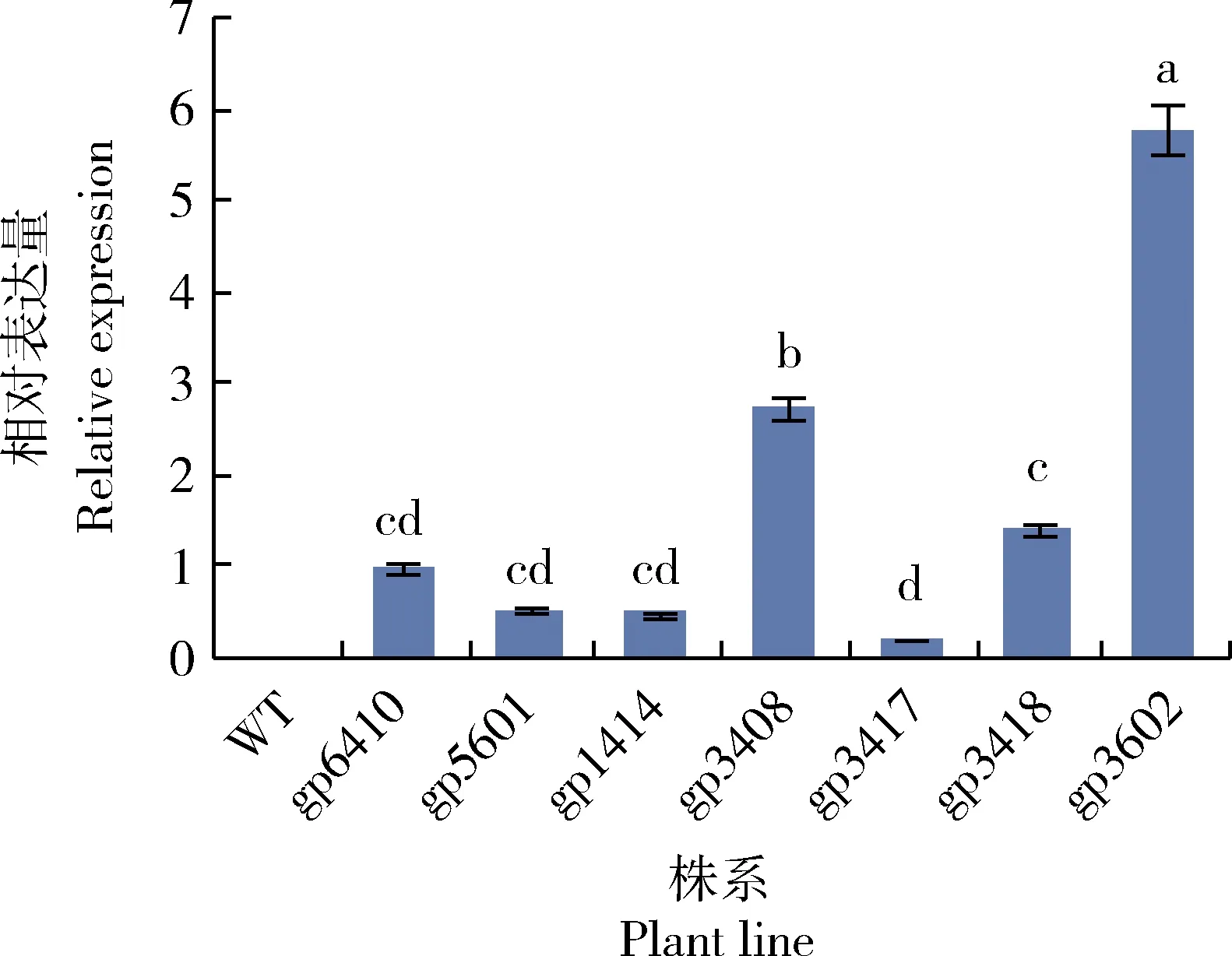
2.5 不同转化株系间GFP基因相对表达量测定
2.6 转基因苹果外源基因拷贝数与表达量的关系
3 讨 论