血管性痴呆大鼠氧化应激、炎症反应与SIRT1的相关性研究*
段新飞 宋利宏 胡 科 董小雪 房娉平 张 英 贾俊栋 刘卫红 阚敏宸
血管性痴呆(Vascular Dementia, VD)是造成痴呆的第二大病因,仅次于阿尔茨海默病,且其患病率呈逐年上升趋势[1, 2]。VD是由于心脑血管疾病以及血流动力学的改变引发的患者认知、学习功能障碍。高血压、糖尿病、肥胖、吸烟均是诱发血管性痴呆的危险因素[3]。目前有关VD的发病机制尚未完全阐明。大多数研究报道,VD脑组织氧化应激水平增加,促炎因子的水平增加,表明脑组织高水平的氧化应激和炎症反应参与血管性痴呆的发病过程[4, 5]。因此,减轻脑组织氧化应激和炎症反应不失为改善VD的重要措施。
沉默信息调节因子1(Silent Information Regulator 1,SIRT1)是Sirtuin家族的成员之一,广泛分布于脑组织中,如海马和小脑等[6]。现有的研究发现SIRT1参与多个生物学过程,具有抗炎、抗氧化应激的作用[7, 8]。另有研究表明,SIRT1调节突触可塑性并参与记忆的形成[9]。然而,SIRT1在VD中的作用有待深入研究。据此,本研究拟探讨上调SIRT1对VD大鼠认知功能、氧化应激以及炎症反应的影响,以期为VD的防治提供新思路。
1 对象与方法
1.1 对象 清洁级SD大鼠30只来自于河北医科大学生物医学工程中心[SYXK(冀)2019-007],体质量为240~260 g。丙二醛(MDA)、超氧化物歧化酶(SOD)以及谷胱甘肽过氧化酶(GSH-Px)购买于南京建成生物工程研究所,白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)酶联免疫试剂盒由武汉伊莱瑞特生物科技有限公司提供,抗SIRT1抗体购买于美国Abcam公司,白藜芦醇购自美国Sigma公司。
1.2 方法
1.2.1 实验分组及VD大鼠模型制备 30只SD大鼠单笼喂养,适应环境1周后将其分为三组:假手术组(Sham组)、血管性痴呆模型组(VD组)和SIRT1激动剂组(RSV组)。本研究VD组采用双侧颈总动脉永久性结扎(2VO)致脑缺血损伤进而建立VD大鼠模型。以35 mg/kg的剂量腹腔注射5%的水合氯醛麻醉大鼠,将麻醉好的大鼠以仰卧位固定其头部和四肢,颈部备皮并消毒,沿正中线作一皮肤切口,分离筋膜和肌肉,暴露出双侧颈总动脉,然后双重结扎动脉的近心端和远心端,用碘酒消毒并缝合伤口,术后要维持大鼠体温在(36±2)℃,并连续3 d注射青霉素用于预防感染。Sham组仅暴露出双侧的动脉,不做结扎处理。RSV组大鼠在进行2VO手术后连续4周给与白藜芦醇(20 mg/kg)。给药完毕后进行行为学分析和生化检测。
1.2.2 水迷宫实验 Morris水迷宫用于检测各组大鼠学习记忆情况,整个实验分为定位航行和空间探索两部分。定位航行实验:每天将实验大鼠从不同的象限放入水迷宫中,记录其找到隐藏在水迷宫中平台的时间,即逃逸潜伏期,若超过120 s大鼠仍未找到平台,则引导其到平台停留10 s,本阶段实验持续5 d,且每天大鼠进入水迷宫顺序均不一样。训练期结束后进行空间探查实验,撤掉平台,记录大鼠穿过平台的次数以及在目标象限(原平台所在象限)所花费的时间。
1.2.3 MDA、SOD、GSH-Px活性检测 水迷宫实验结束后,将大鼠麻醉处死快速取出脑组织并分离出双侧海马,一侧海马于-80 ℃,一侧海马组织用预冷的生理盐水冲洗并将其匀浆4度离心15 min,取上清液用于后续的实验。MDA、SOD、GSH-Px活性的检测按照试剂盒说明严格进行。
1.2.4 IL-1β和TNF-α的检测 将海马组织匀浆并取上清液用于后续实验。IL-1β和TNF-α浓度检测操作严格按照Elisa说明书进行,测定结束后按照说明书根据标准品浓度和所测的吸光度值绘制出所需标准曲线,然后按照标准曲线计算IL-1β和TNF-α浓度。
1.2.5 Western blot检测SIRT1蛋白表达水平 将海马组织匀浆并取上清液,用BCA法测量各组上清液中蛋白总浓度。根据所检测蛋白分子量制备所需浓度的分离胶和浓缩胶。将样品经变性等处理后加入凝胶泳道中进行电泳。电泳结束后,将凝胶置于转印槽内,将蛋白转至PVDF膜上。之后将PVDF膜置于55 ℃的脱脂牛奶中封闭,接着将膜转至一抗中孵育过夜。次日再孵育二抗2 h,最后于凝胶成像系统下显影。
1.2.6 统计学方法 本研究采用SPSS 20.0软件对所得数据进行分析处理,组间对比采用单因素方差分析,P<0.05视为差异有统计学意义。
2 结果
2.1 三组大鼠海马SIRT1蛋白表达水平比较 VD组大鼠海马SIRT1的蛋白表达水平较Sham组降低(P<0.01)。RSV组大鼠海马SIRT1蛋白表达水平高于VD组(P<0.05)。见图1。

注:与Sham组比较,*P<0.01;与VD组比较,△P<0.05
2.2 三组大鼠认知功能比较 与Sham组比较,VD组大鼠逃逸潜伏期延长(P<0.01);且VD组大鼠穿过平台的次数以及在目标象限停留时间百分比低于Sham组(P<0.05)。与VD组比较,RSV组大鼠在定位航行实验中的逃逸潜伏期缩短(P<0.01);RSV组大鼠在空间探查实验中穿过平台的次数和在目标象限停留时间百分比均提高(P<0.05)。见图2。
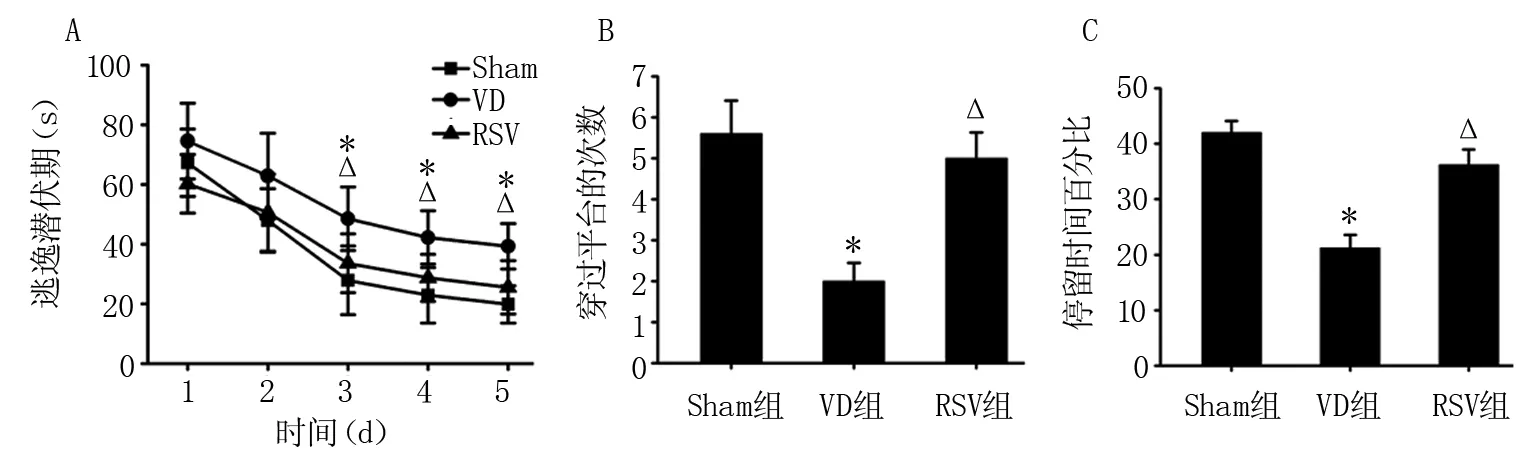
注:A:逃逸潜伏期;B:穿过平台的次数;C:在目标象限停留时间百分比;与Sham组比较,*P<0.01;与VD组比较,△P<0.05
2.3 三组大鼠海马组织氧化应激水平比较 结果显示,与Sham组比较,VD组大鼠海马MDA的活性增加(P<0.001),SOD和GSH-Px活性减少(P<0.05)。与VD组比较,RSV组大鼠MDA的活性降低(P<0.01),SOD和GSH-Px活性升高(P<0.05)。见图3。

注:A:海马区MDA的水平;B:海马区SOD的水平;C:海马区GSH-Px的水平;与Sham组比较,*P<0.05,**P<0.01;与VD组比较,△P<0.05,△△P<0.01
2.4 三组大鼠海马组织炎症水平比较 ELISA结果显示,与Sham组比较,VD组大鼠海马IL-1β和TNF-α的表达水平升高(P<0.01)。与VD组比较,RSV组大鼠海马IL-1β和TNF-α的表达水平降低(P<0.01)。见图4。
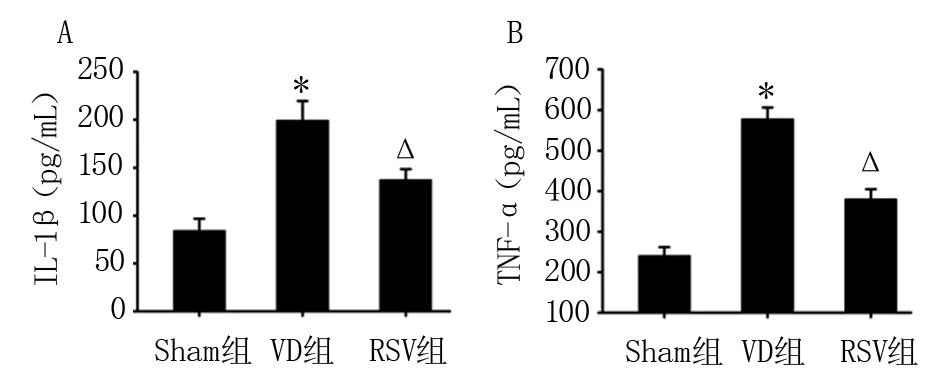
注:A:海马区IL-1β的水平;B:海马区TNF-α的水平;与Sham组比较,*P<0.01;与VD组比较,△P<0.01
3 讨论
VD是由于脑血管疾病以及缺血或出血性疾病引起的认知功能障碍,多发于老年人群[10]。VD严重影响了患者的生活质量,加重家庭、社会的负担。目前,有关VD的发病机制尚未完全阐明,氧化应激以及炎症是VD的重要发病机制[11, 12]。据此,本研究深入探讨了VD氧化应激和炎症反应的具体机制。
SIRT1是Sirtuin家族成员之一,为NAD+依赖性去乙酰化酶。SIRT1广泛表达于脑组织,特别是海马神经元内。研究发现,SIRT1参与细胞增殖、分化、衰老等多个生理功能[13, 14]。另有研究报道,SIRT1调控突触可塑性,是学习以及形成的重要基础[15, 16]。因此,本研究观察了SIRT1在VD中的重要作用。本研究采用2VO法复制VD大鼠模型[17]。与其他研究一致[18],2VO处理大鼠逃逸潜伏期延长,穿过平台的次数以及在目标象限停留时间百分比低于Sham组,表明VD模型复制成功。通过Western blot检测SIRT1的表达,发现VD大鼠海马区SIRT1的表达降低;给与SIRT1激动剂处理后,VD大鼠SIRT1的表达恢复至正常水平,表明白藜芦醇上调VD大鼠SIRT1的表达,提示SIRT1参与VD的病理过程。
为了进一步明确SIRT1在VD中的重要作用,本研究通过上调SIRT1的表达,观察其对VD大鼠认知功能,氧化应激以及炎症反应的影响。白藜芦醇是目前运用较广的SIRT1激动剂[19, 20]。结果显示,白藜芦醇处理缩短了VD大鼠在定位航行实验中的逃逸潜伏期,增加VD大鼠在空间探查实验中穿过平台的次数和在目标象限停留时间百分比,表明上调SIRT1的表达可提高VD的认知功能。此外,本研究还检测了白藜芦醇处理之后各组大鼠氧化应激指标的变化。RSV组大鼠MDA的活性降低,SOD和GSH-Px活性增加,表明上调SIRT1可减轻VD大鼠海马氧化应激。此外,本研究还观察到白藜芦醇处理大鼠海马促炎因子IL-1β和TNF-α的水平低于VD组,表明上调SIRT1的表达可抑制VD大鼠炎症反应。该项研究的发现进一步阐明了VD的病理机制,为该病的防治提供了新靶点和新思路。
综上所述,本研究发现VD大鼠海马SIRT1的表达明显降低,且上调SIRT1的表达可改善VD认知功能障碍,减轻海马区氧化应激损伤以及炎症反应,表明SIRT1介导VD氧化应激以及炎症反应的发生发展过程。

