胶质母细胞瘤术后甲氨蝶呤间质化疗同步放化疗临床观察
李丰展 盖立平 杨艳敏 麻来峰
河南省直第三人民医院,河南 郑州 450000
国外流行病学调查研究显示,恶性胶质细胞瘤(glioblastoma,GBM)在中枢神经系统肿瘤中的发病率仍占首位;由于其浸润性生长、异质性强的生物学特性,致其术后易残留、化学药物治疗敏感性不一,因此其致残率高,存活率低,目前仍是全球难治性肿瘤之一[1]。国外大型随机对照临床试验[2]显示,即使经过手术、联合放射治疗和化学药物治疗(以下简称放化疗)等积极治疗,Ⅳ级胶质母细胞瘤3 a生存率也仅有16.0%。如何根除手术后残留的肿瘤组织及阻止复发仍是当今神经外科研究的热点。本研究回顾性分析河南省直第三人民医院2012-01—2017-01收治的90例Ⅳ级胶质母细胞瘤患者的临床资料,将术中瘤腔内置入化疗泵术后注射甲氨喋呤(methotrexate,MTX)间质内化疗并同步放化疗治疗模式的42例患者与术后仅进行同步放化疗的48例患者进行对比,探讨术中瘤腔内置入化疗泵术后注射MTX进行间质化疗并同步放化疗治疗的作用。
1 资料与方法
1.1纳入与排除标准纳入标准:(1)原发性胶质母细胞;(2)没有突破室管膜侵入脑室内;(3)肿瘤位于额颞部;(4)头颅CT及MRI扫描明确显示脑肿瘤影及受压脑组织;(5)无重要脏器衰竭;(6)临床资料完整,无失访。排除标准:(1)继发性胶质母细胞瘤;(2)肿瘤位于后颅窝(发病部位位于脑干及小脑者)。
1.2一般资料纳入GBM患者90例,接受术中瘤腔内置入化疗泵术后注射MTX并进行同步放化疗治疗模式的42例患者为A组,术后仅进行常规放化疗治疗的48例患者为B组。2组一般临床资料比较无明显差异(P>0.05)。见表1。
1.3治疗方法A组42例患者在术中磁共振、导航及黄荧光等技术引导下,在显微镜下行肿瘤组织全切或次全切,术中将Ommaya囊输出端置入瘤腔,保持瘤腔封闭,Ommaya囊埋置于皮下。术后将2 mL(10 mg)MTX注入化疗囊,进行间质内化疗,连用3 d。术后采用经典STUPP方案治疗。STUPP方案[3]:替莫唑胺(TMZ)同步化疗,口服TMZ 75 mg/m2,疗程42 d,化疗结束后4周,根据患者对TMZ耐受情况,口服TMZ 150~200 mg/m2,连续用药5 d,28 d为1个疗程,化疗6个疗程。B组48例患者肿瘤切除方法及技术同A组,不植入Ommaya囊,术后采用STUPP方案治疗。2组每4~6周复查头颅CT及增强MRI对颅内肿瘤生长情况进行观察。
1.4评价指标(1)对2组患者肿瘤复发时间、中位生存时间及3 a存活率进行比较,评价2组治疗效果;(2)对2组患者术后并发症进行对比,如癫痫、颅内感染、粒细胞障碍等。

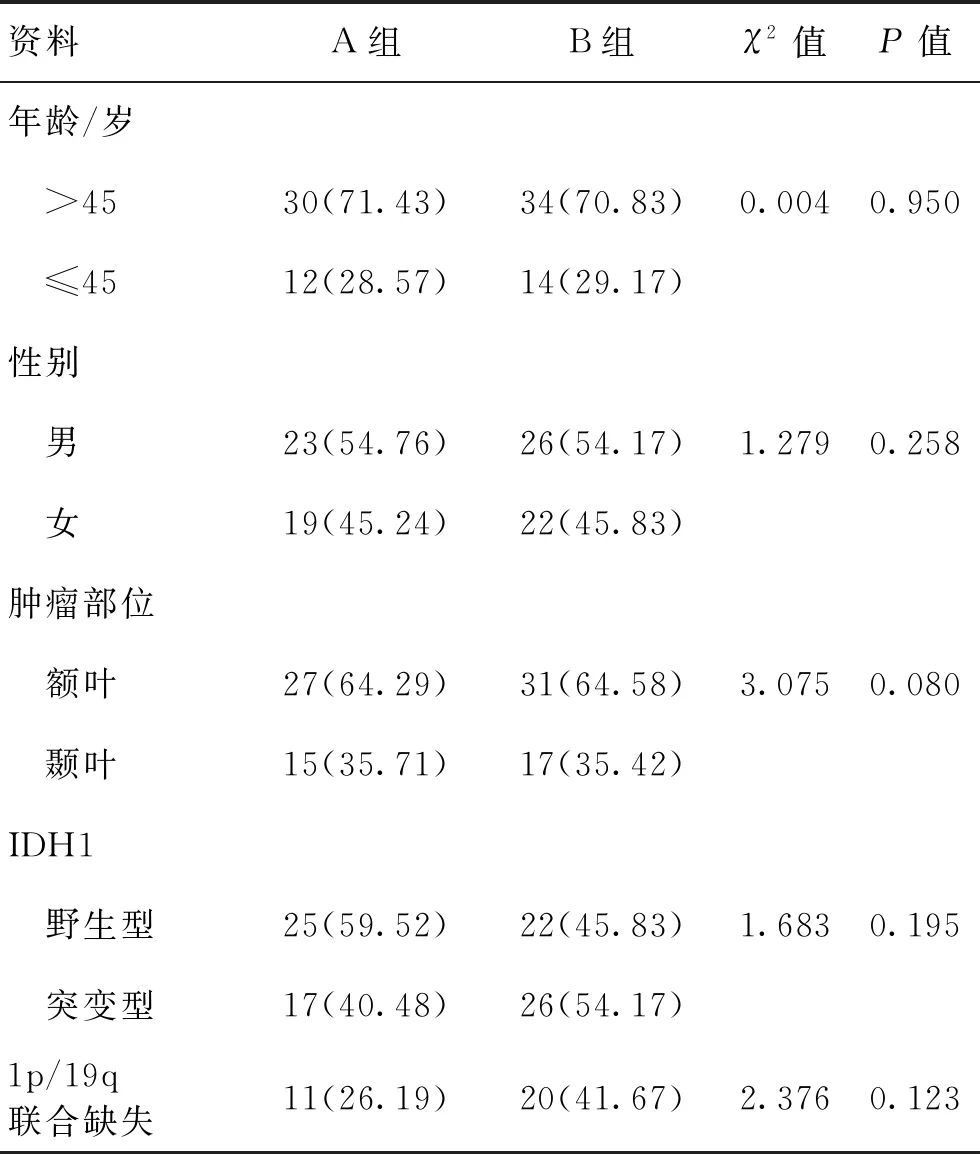
表1 2组一般资料对比 [n(%)]
2 结果
2.12组术后并发症发生情况比较2组术后颅内感染、消化道出血、肾功能受损比较无明显差异(P>0.05),术后癫痫、粒细胞障碍比较差异有统计学意义(P<0.05)。术后半年2组并发症发生情况未见明显差异(P>0.05)。见表2。
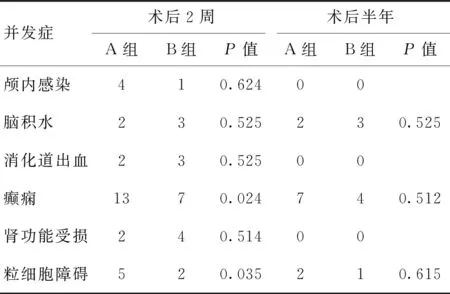
表2 2组术后并发症对比 (n)
2.22组肿瘤复发时间比较A组与B组肿瘤复发时间进行正态分布检测,P值分别为0.098、0.083,符合正态分布,2组比较采用t检验,差异有统计学意义(P<0.05)。见表3、图1。
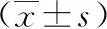
表3 2组患者肿瘤复发时间对比
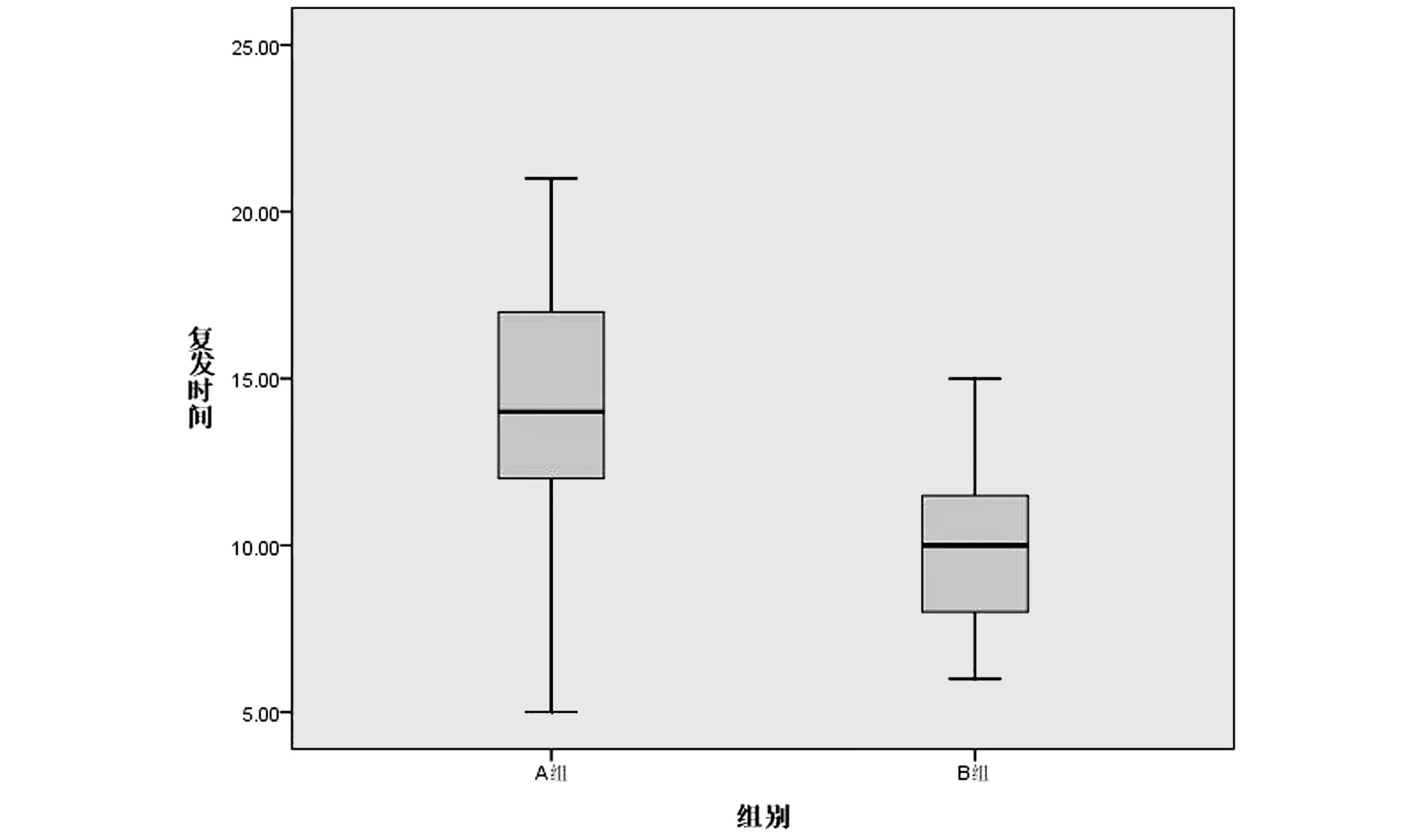
图1 2组患者肿瘤复发时间对比Figure 1 Comparison of tumor recurrence time between the two groups
2.32组患者中位生存时间及年存活率比较2组患者生存时间不符合正态分布,采用Mann-WhitneyU检验,差异有统计学意义(P<0.05);A组中位生存时间2.10(1.35~2.70)a,B组中位生存时间1.55(1.30~2.10)a;A组秩和均值(51.50)>B组秩和均值(40.25),A组生存时间优于B组。见表4。
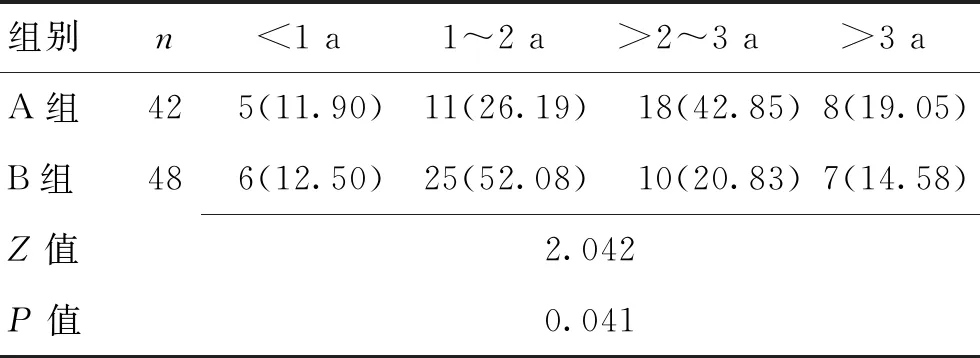
表4 2组患者3 a存活率比较 [n(%)]
3 讨论
3.1间质化疗对GBM患者治疗的影响胶质母细胞瘤由于其分子生物学具有多形性、核高度分裂性及微血管内皮细胞高度增生性致其生长方式呈侵袭性,同时研究报道胶质瘤细胞能够分泌基质金属蛋白酶(MMP)和诱导血管上皮因子(VEGF)高表达,这一特点更有利于对正常神经组织侵袭,同时进一步加重血管渗漏及瘤周水肿[4-6]。患者往往预后较差,既往研究报道未经治疗的患者生存率不足3个月[5,7-10]。近年来,综合治疗措施不断完善,但治疗效果仍比较有限。临床实践中由于肿瘤生长部位(如位于功能区、毗邻重要血管等)和浸润性生长的特性,往往对其难以实现全切,而肿瘤残留恰恰是日后复发的重要根源。据RTOG临床试验对645例胶质母细胞瘤患者前瞻性研究显示,只做活检的患者中位生存时间仅为6.6个月,而近全切患者能够延长4.7个月达到11.3个月[6,11-15]。因此,如何更有效杀死残留肿瘤组织是延长患者复发及改善预后的重要因素。通过手术对肿瘤进行大体切除明确病理诊断后,后续放化疗可进一步杀死肿瘤细胞延长患者生存时间。由于受血脑屏障限制,很多化疗药物不能到达脑内,即便到达也很难达到有效浓度,若增加药物剂量往往加大患者全身药物不良反应,致使患者不耐受;同时放疗造成颅内小血管闭塞及神经胶质增生,进一步阻碍化疗药物进入肿瘤组织内[7,16-20]。而正常脑组织-肿瘤交界区肿瘤头端细胞丰富,且细胞处于增殖期,核分裂活跃,生长积分高,而此区域毛细血管物质交换率又远低于正常脑组织[8,21-25]。考虑上述因素,本研究通过术后直接向瘤腔内注射化疗药物,使肿瘤间质及周边保持较高的药物浓度,在不增加全身化疗药物剂量下对肿瘤起到直接的杀灭和诱导凋亡(apoptosis)的作用,减少全身毒性反应。本研究之所以选择MTX,是由于MTX作为抗代谢药物,具有细胞周期特异性,选择性作用于DNA合成期(S),对增殖状态肿瘤细胞有效,而对瘤周非增殖状态脑细胞几乎无影响[26-27]。ZELLER等[9]研究证实MTX对神经胶质瘤有效,直接进入瘤内化疗是最有效途径,同时渗出瘤周,对交界区增生活跃的肿瘤细胞具有一定杀灭作用。
3.2间质化疗对肿瘤复发时间及生存期的影响本研究显示间质化疗的效果明显优于未进行间质化疗。间质化疗避开血脑屏障化疗药物直接作用于肿瘤细胞,大大提高对肿瘤杀灭作用。EORTC26981-22981研究[10]显示,TMZ对胶质母细胞瘤有效,放化疗能够延长患者中位生存期及总生存期。研究报道肿瘤中心区由于存在较高比例的缺氧细胞而降低对射线敏感性(富氧细胞放疗敏感性比乏氧细胞高2.5~3.0倍),胶质母细胞瘤患者放疗抵抗与坏死区存在乏氧细胞且细胞生长周期为S期对射线抵抗力较强有关,因此恶化肿瘤生长环境来提高放疗敏感性[11]。尽管目前对于放疗增敏剂缺乏大规模高质量研究,部分研究报道MTX具有放疗增敏作用。既往研究表明1p/19q染色体缺失对TMZ化疗更敏感,同时NOA-04研究表明IDH1突变对预后有利影响强于1p/19q联合缺失和MGMT启动子甲基化[12]。本研究显示A组IDH突变型及1p/19q联合缺失患者数量尽管与B组未见明显差别,但A组此类患者数量明显低于B组,但A组肿瘤复发时间及中位生存时间、3 a存活率均明显优于B组,表明进行间质化疗具有一定放疗增敏作用,在胶质母细胞瘤治疗中具有一定的价值。
3.3术后并发症虽本研究2组颅内感染率差异无统计学意义,但进行间质化疗组颅内感染发生率仍高于未使用组,阴性结果可能与本次研究病例数较少有关。根据过往经验在临床操作中严格掌握无菌操作,颅内感染是可以控制在理想范围内。A组术后癫痫发生率明显高于B组,表明间质化疗有增加癫痫的风险,分析原因可能为胶质母细胞瘤患者因坏死胶质增生增加癫痫风险,术后局部应用药物加大对脑皮质刺激易引起异常放电[13,28-30],临床中通过进行规律抗癫痫治疗后患者症状明显好转。
3.4本研究不足影响患者生存因素很多,如患者年龄、手术时机选择和术前一般状况等。研究过程中由于客观因素限制,干扰因素较多,病例较少且为单中心研究,只针对原发性胶质母细胞瘤进行研究,结果难免存在一定误差。
3.5展望随着基因检测、分子病理检测、靶向治疗、免疫治疗的不断提高,碳离子放疗、硼离子俘获、TTF电场治疗等新技术的不断出现,给胶质瘤患者治疗带来一定曙光[14]。尽管肿瘤发生涉及多基因、多信号通路,发生机制极为复杂[15,31-32],目前对于胶质瘤患者依然是把基础治疗做极致,手术尽力切除,并按照规范进行放化疗,患者依然能够获益。
采用甲氨喋呤间质内化疗并术后进行同步放化疗治疗模式能够延长患者肿瘤复发时间及中位生存时间,3 a存活率明显提高,在胶质母细胞瘤患者救治中具有一定的临床意义。

