磷酸化tau蛋白及其与总tau蛋白比对创伤性脑损伤病人病人预后的预测价值
夏承东 桂明 韩飞 杜向阳 黄大可
创伤性脑损伤(traumatic brain injury,TBI)是我国中青年人群死亡最主要的原因[1],重者死亡率可高达30%~60%[2]。虽然有格拉斯哥昏迷评分(GCS)、影像学检查、实验室检查预估预后,但许多指标难以进一步量化、准确化[3]。有研究表明,磷酸化tau蛋白(P-tau)及其与总tau蛋白比(P-tau/T-tau)可有效评估TBI病人预后和死亡率[4]。Tau蛋白是神经细胞微管相关蛋白中的一员,TBI时Tau蛋白将发生磷酸化成为P-tau。P-tau、P-tau/T-tau在预测阿尔兹海默症、慢性创伤性脑病、新生儿缺血缺氧性脑病的预后中发挥突出效能[5-6]。本研究探讨血清P-tau、P-tau/T-tau对TBI预后评估的应用价值。
对象与方法
一、对象
2017年6月~2019年6月于我院就诊的TBI病人90例。男47例,女39例,平均年龄(35.27±11.83)岁,交通事故伤63例,钝器伤8例,高空坠落伤10例,其他原因5例。纳入标准[7]:(1)交通事故、意外摔倒、击打等原因造成的TBI,经影像学检查证实;(2)年龄>18岁;(4)伤后24小时内入院;(5)肢体无其他部位严重创伤。排除标准:既往存在阿尔兹海默症、慢性颅脑损伤等神经系统疾病和脑外伤史;伴有失血性休克,心、肝、肾等重要器官功能障碍;伴有糖尿病、癫痫、恶性肿瘤;死因与TBI无关;排除临床资料完整度<70%和自动出院病例。本研究通过医院伦理学委员会审核,病人签署知情同意书。

表1 死亡病人和存活病人资料比较(例,%)()
二、方法
1.治疗及随访:采用GCS评分评估入院时意识状态,总分15分,评分越高意识状态越好,14分以上为正常,4~8分为昏迷,3分及以下为脑死亡或预后极差。所有病人据病情接受手术、营养神经药物、亚低温等治疗,经处理后生命体征均平稳。收集病人入组时基本资料,检测血清P-tau和T-tau。所有病人随访6个月,以电话随访或门诊方式进行,每15天1次。根据死亡和预后情况将病人分为死亡组、存活组、预后良好组预后不良组。
2.血清tau蛋白检测:于伤后6小时内检测血清P-tau、T-tau。取静脉血10 ml,加入肝素钠抗凝管中,4℃下离心10分钟。取上清液,于-80℃冰箱中储存。用ELISA法检测血浆中P-tau、T-tau,P-tau,试剂盒由上海恒远生物有限公司提供,tau蛋白试剂盒由美国Invitrogen公司提供。根据测量结果计算P-tau/T-tau。
3.预后评定:伤后6个月采用格拉斯哥预后评分(GOS)评估预后[8]:1分为死亡;2分为植物状态生存;3分为重度残疾;4分为中度残疾;5分为预后良好。得分1~3分纳入预后不良组,4~5分纳入预后良好组。
三、 统计学方法

结 果
1.死亡组和存活组资料比较见表1。4例失访,最终纳入86例。随访6个月期间23例死亡,其中12、4、5、2例分别于伤后1、2、3、5个月死亡。病人平均静脉血采样时间为伤后(2.65±0.91)小时。死亡组发病至入院时间、P-tau、P-tau/T-tau均高于存活组,GCS评分低于存活组,差异有统计学意义(P<0.05)。
2.P-tau、P-tau/T-tau与TBI死亡情况多因素分析见表2。P-tau(OR=41.679,P=0.001)和P-tau/T-tau(OR=163.771,P=0.000)均为TBI病人死亡的危险因素。

表2 TBI病人死亡相关因素Logistic回归结果
3.P-tau、P-tau/T-tau与病情严重程度相关性分析见表3。预后良好组GOS评分高于预后不良组,P-tau和P-tau/T-tau低于预后不良组(P<0.05);P-tau(r=-0.773,P=0.000)、P-tau/T-tau(r=-0.745,P=0.000)均与GOS评分呈负相关。
4.P-tau、P-tau/T-tau预测TBI预后:P-tau和P-tau/T-tau预测TBI病人死亡情况的最佳截点分别为2.182和0.029,此时AUC分别为0.767和0.873,诊断敏感性分别为91.30%和91.34%,两者敏感性无明显差异(P>0.05);P-tau和P-tau/T-tau预测TBI病人预后的最佳截点为2.520和0.030,此时AUC分别为0.968和0.961,诊断敏感性分别为94.11%和91.24%,两者敏感性无明显差异(P>0.05)。见图1~2。
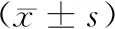
表3 两组P-tau、P-tau/T-tau比较
讨 论
我国脑外伤发生率大概为100/10万人[9],尽管许多病人及时接受手术,但预后仍不理想[10]。本研究中病人死亡率高达26.74%,与国内学者报道相近[11],可见TBI病人预后极差,早期、准确地评估TBI病人预后,有助于医师尽早制定治疗方案。Tau蛋白为一类分子量为48~67 kD的微管相关蛋白,在正常人血清或脑脊液中含量极低。病理条件下tau蛋白可发生磷酸化,P-tau及tau蛋白将从神经细胞中释放入血[12],这就提示P-tau、P-tau/T-tau可能成为TBI预后的预测指标。
Tau蛋白存在于神经元轴突中,可保持微管稳定、胞内运输的顺利进行[13-14]。本研究结果表明,死亡组发病至入院时间、P-tau、P-tau/T-tau均高于存活组;P-tau和P-tau/T-tau为病人死亡的危险因素。Valadka等[15]报道P-tau、P-tau/T-tau对TBI具有较高的诊断准确性。TBI常伴轴突损伤,其亦为预后不良和长期神经功能受损的决定因素之一[16],血清tau蛋白及P-tau含量一定程度上反映了轴突损伤程度,为P-tau和P-tau/T-tau预测TBI病人死亡情况提供了理论依据。有研究表明,升高的tau蛋白磷酸化水平所导致的神经毒性作用与其破坏轴浆运输、促使神经元死亡有关[17],这可能是TBI病人死亡的原因之一。
本文应用GOS评分对病人行预后分层,预后良好组P-tau、P-tau/T-tau低于预后不良组;P-tau、P-tau/T-tau均与GOS评分呈负相关。P-tau、P-tau/T-tau升高者可能具有更高的致残和死亡风险。有研究表明,升高的P-tau可能是神经元丢失、导致大脑神经功能缺损的一个主要原因[18]。大脑不同区域的组织P-tau水平升高可能提示对应神经功能受损,我们认为这可能是TBI病人P-tau、P-tau/T-tau与远期预后相关的原因,有望丰富动物研究以验证此观点。Shultz等[19]发现,TBI大鼠存在P-tau、P-tau/T-tau升高,通过行持续亚硒酸钠治疗以降低P-tau、T-tau水平可明显改善TBI大鼠预后,一定程度上支持了本研究结论。
P-tau和P-tau/T-tau预测TBI病人死亡情况的最佳截点分别为2.182和0.029,AUC分别为0.767和0.873;P-tau和P-tau/T-tau预测TBI病人预后的最佳截点为2.520和0.030,AUC分别为0.968和0.961,两者预测死亡和预后的敏感性均良好且分别无明显差异。Rubenstein等[20]研究发现,血清P-tau和P-tau/T-tau与TBI病人病情严重程度相关,受年龄影响小,具有良好的预后预测效能,并优于T-tau。但目前尚不清楚P-tau如何参与TBI的病情进展,及其在神经功能恢复过程中发挥的具体作用,可能与神经细胞微管功能及兴奋性有关。P-tau和P-tau/T-tau的增高或与其他物质共同导致远期神经功能障碍及异常神经网络活动,检测二者有助于医师判断病人预后。
TBI病人P-tau和T-tau水平在入院后不同时间点可能存在明显变化,本文未对二者变化与预后相关性进行探讨。血清P-tau和P-tau/T-tau对TBI病人死亡和预后具有较高的预测效能,未来有望成为预测TBI病人预后的重要指标。

