超声内镜引导下胆汁引流治疗ERCP治疗失败的恶性梗阻性黄疸患者疗效初步研究*
庄东海,张 振,吴善彬
目前,根治性肿瘤切除术是治疗恶性梗阻性黄疸的主要手段,但由于原发肿瘤具有隐匿性起病、早期诊断率低等特点,大多数患者在发现肿瘤时已经失去了根治性手术的机会[1-3]。常见的恶性梗阻性黄疸的原发疾病包括胆囊癌、胆管癌、胰腺癌、壶腹部癌和其他恶性肿瘤侵犯胆管。这些疾病往往较常见于老年患者。在临床实践中,针对恶性梗阻性黄疸的治疗思路主要是姑息性减黄,这样能够尽可能地减轻患者的病情,从而延长总体生存期,提高生活质量。到目前为止,内镜下逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)是治疗恶性梗阻性黄疸的最佳选择,但即便由经验丰富的内镜医师进行操作,ERCP治疗恶性梗阻性黄疸患者的操作失败率仍在3%~10%之间[4,5]。经皮肝胆管引流术(percutaneous transhepatic biliary drainage,PTBD)和超声内镜引导下胆汁引流术(endoscopic ultrasound-guided biliary drainage,EUS-BD)已成为ERCP治疗失败时治疗恶性梗阻性黄疸患者的常用替代方案。研究表明这些手术方法对于恶性梗阻性黄疸患者的姑息性胆道引流是行之有效的[6-10]。本研究的主要目的是比较了PTBD与EUS-BD两种手术方法治疗ERCP治疗失败的恶性梗阻性黄疸患者的疗效和安全性,以为临床提供相关的治疗经验,现报道如下。
1 资料与方法
1.1 研究对象 2013年1月~2018年12月我院收治的ERCP治疗失败的恶性梗阻性黄疸患者75例,术前经B超、CT或MRCP等影像学检查证实存在恶性胆管梗阻[11],其中胰腺癌15例、壶腹部癌12例、胆管癌27例、胆囊癌9例、胃肠道恶性肿瘤侵犯11例和非霍奇金淋巴瘤1例。排除标准:(1)严重的食管胃底静脉曲张;(2)严重的食管狭窄;(3)肝硬化、肝内外胆管结石、溶血性黄疸和胆汁淤积性肝病;(4)伴有心、肺、肾和血液系统疾病,不能耐受手术治疗。40例患者接受EUS-BD治疗,35例患者接受PTBD治疗,两组人口学资料和肿瘤类型分布比较,无显著统计学差异(P>0.05),具有可比性。本研究遵循赫尔辛基宣言的原则,并经我院医学伦理委员会批准通过。告知患者EUS-BD和PTBD治疗替代方案的细节,获得患者或其家属同意并签署纸质知情同意书。
1.2 治疗方法 使用日本奥林巴斯公司生产的TJF240和TJF260型电子十二指肠镜、乳头切开刀和针形切开刀,使用德国爱博公司生产的APC300/ICC200EA型高频发生器和斑马导丝。使用Pentax OS-A70超声内镜、EG-3870UTK线阵超声内镜和日本日立公司生产的HI Vision Avius超声系统。使用美国Wilson-Cook公司生产的19 G/22 G穿刺针、扩张管(气囊)和金属支架。使用材料还包括泛影葡胺造影剂和X线透视机等。排除相关手术禁忌证后,嘱患者术前禁食6 h以上。采用静脉麻醉或者全身麻醉。EUS-BD操作过程如下:根据内镜是否可以到达十二指肠乳头处,对能够到达者,采用超声内镜引导下对接技术或对不能到达者,采用超声内镜引导下顺行技术。在行超声内镜引导下对接技术时,首先使用超声内镜观察胆管,接着用19 G/22 G穿刺针穿刺,形成临时瘘管后放置导丝,通过胆总管和十二指肠乳头后进入十二指肠内,最后通过留置导丝行ERCP操作,成功后拔出导丝;在行超声内镜引导下顺行技术时,采用肝内胆管或上消化道造瘘,在胆管狭窄处放置支架并进行扩张。PTBD操作过程如下:首先对患者行超声检查,显示扩张的肝内胆管。然后,选择合适的扩张胆管进行穿刺,穿刺成功后拔出针芯,向胆管内注入复方泛影葡胺溶液10 ml,清晰显示胆管树状结构。在透视引导下插入导丝,将导丝穿过肝内胆管、壶腹并进入十二指肠。将金属支架置入胆总管内,必要时留置外引流管、固定。
1.3 血生化指标检测 使用德国西门子公司生产的ADVIA2400型全自动生化分析仪检测。

2 结果
2.1 两组手术情况 在40例EUS-BD治疗患者中,采用超声内镜引导下对接技术完成治疗16例(40.0%),在超声内镜引导下顺行技术完成治疗24例(60.0%),其中37例(92.5%)操作成功。由于肿瘤侵袭导致肝总管或肝内胆管狭窄或梗阻而未能完成操作3例(7.5%);在35例PTBD治疗患者中,28例(80.0%)操作成功。由于肿瘤侵袭导致肝总管或肝内胆管狭窄或梗阻而未能完成操作7例(20.0%);EUS-BD治疗患者操作时间为(50.8±28.4)min,PTBD治疗为(54.7±25.2)min。两组操作成功率和操作时间均无显著性统计学差异(P>0.05)。
2.2 两组血生化指标的比较 治疗前,两组血清总胆红素(TBIL)、白蛋白(ALB)和谷丙转氨酶(ALT)水平均无显著性统计学差异(P>0.05);治疗后,EUS-BD治疗患者血清TBIL水平显著低于,而血清ALB水平显著高于PTBD治疗组(P<0.05,表1)。
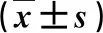
表1 两组血生化指标比较
2.3 两组并发症发生率比较 EUS-BD治疗患者术后并发症发生率为7.5%(3/40),其中胆道出血2例(5.0%),急性胆管炎1例(2.5%);PTBD治疗患者术后并发症发生率为22.9%(8/35),其中胆道出血3例(8.6%),肝包膜下出血1例(2.9%),胆汁性腹膜炎1例(2.9%),胆漏1例(2.9%),胆道感染2例(5.7%)。两组并发症发生率比较具有统计学差异(P<0.05)。
3 讨论
恶性梗阻性黄疸是胰腺癌、壶腹部癌、胆管癌、胆囊癌、胃肠道恶性肿瘤侵犯和淋巴瘤等肿瘤导致肝内外胆管梗阻的一类临床疾病。到目前为止,由于发病隐匿、早期发现率低等,大多数患者经影像学检查确诊时,原发肿瘤已进展至晚期,此时患者已失去了手术治疗的时机,通常生存期也较短[12,13]。ERCP是治疗恶性梗阻性黄疸合适的方法,能够尽可能地提高这些患者的生活质量,延长生存期,但在临床实践中ERCP操作失败的病例也较多[14-16]。PTBD被作为是ERCP治疗失败的恶性梗阻性黄疸患者的常规补救治疗方法,但临床实践发现PTBD并发症发生率较高,常见并发症主要是胆道出血、腹腔或肝脏包膜下出血和胆漏等。目前,具有实时超声引导的EUS-BD因其准确性高、安全性好、并发症少而被广泛应用于ERCP治疗失败的恶性梗阻性黄疸患者。
恶性梗阻性黄疸患者在疾病发生时,由于胆管压力增加,血清胆红素水平上升,造成机体出现一系列病理生理变化,例如肝肾功能损伤、凝血功能障碍等。EUS-BD技术是1996年由Wiersema et al报道的,已成为因恶性肿瘤或手术改变解剖结构而导致的胃肠道管腔梗阻患者在ERCP治疗失败后的替代方案[17-19]。EUS-BD的潜在优势是利用ERCP实现引流,并发症发生率比其他胆管引流方法低,EUS-BD在恶性梗阻性黄疸患者应用的可行性和有效性在许多研究中已经得到了证实[20-23]。EUS-BD和PTBD能够改善恶性梗阻性黄疸患者的肝功能,进一步比较治疗后肝功能指标的变化发现,EUS-BD治疗后,血清总胆红素下降和白蛋白的升高明显。本研究发现,采用EUS-BD和PTBD补救治疗,在ERCP治疗失败的患者,仍然有效。EUS-BD治疗患者操作成功率高,而EUS-BD治疗患者手术后并发症发生率显著低于PTBD治疗(P<0.05)。因此,EUS-BD治疗恶性梗阻性黄疸是可行的,其操作的安全性也能够得到保障。本研究采用PTBD治疗,有部分操作失败,其最主要的原因在于肿瘤阻塞或侵犯胆管,造成无法放置外引流管。在B超引导下行PTBD术能够提供准确的成像,清楚观察患者胆道周围的解剖情况,这样就可以较为精准地将导管置入目标胆管。无论EUS-BD还是PTBD手术,术后均出现一定数量的并发症,对这些并发症的及时发现和处理是十分必要的。一般而言,术区出血、胆漏等较常出现于术后早期,可能与手术操作本身有关。当患者术后出现头晕、乏力、便血和/或黑便时,提示患者有出血的可能,而当出现发热、腹痛、腹膜刺激症等时,则提示有胆漏的风险。一旦患者出现上述情况时,需密切监测患者生命体征,必要时重复内镜检查或介入治疗,同时辅助予以抗感染和营养支持等处理,多能获得良好的恢复效果。
综上所述,采用EUS-BD或 PTBD补救治疗经ERCP治疗失败的恶性梗阻性黄疸患者是可行和有效的,在提高手术技巧保证操作安全性的基础上,其疗效显著,可以暂时消退黄疸,减轻临床症状,提高生活质量,作为ERCP治疗失败的恶性梗阻性黄疸患者的替代方案,值得临床进一步研究。在临床工作中,同样需要注意EUS-BD术后患者病情的变化。当出现不适主诉或明显体征时,需要及时鉴别,及早发现并发症并给予适当的处理,以免贻误治疗。

