TACE术后肝细胞癌患者功能磁共振成像参数变化研究*
周彬彬,孙姚晨,黄海帆,鲍 健
肝细胞癌(HCC)在我国是较为常见的恶性肿瘤类型之一。近年来,HCC的发病率逐年上升,而很多HCC患者在被发现时已进入中晚期,失去了手术根治的时机[1-3]。对于这些患者,非手术治疗往往作为首选方案,其中以肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)最常用。目前,临床上常用于评估TACE治疗效果的影像学检查方法包括超声、CT、MRI和DSA检查,每种检查技术均各具优势和局限性[4-8]。近年来,具备更多功能的MRI新技术不断地被应用于临床。除了具有无创、无辐射、较高的时间和空间分辨率等优点外,功能MRI还能应用弥散加权成像(DWI)和动态增强扫描(DCE)等技术,对TACE术后HCC患者肝内病灶进行定量检测,作为临床评价疗效的依据[9-11]。本研究的目的是应用功能MRI评估了接受TACE治疗的HCC患者的疗效,现报道如下。
1 资料与方法
1.1 研究对象 2014年6月~2019年6月我院收治的HCC患者76例,男性50例,女性26例;年龄为(58.7±9.6)岁。诊断符合2011年版原发性肝癌诊疗规范,肝功能Child-Pugh分级为A级或B级,病灶为单发或多发,伴或不伴有门静脉侵犯和区域淋巴结转移。排除标准包括:(1)存在凝血功能障碍、顽固性腹水或上消化道出血病史;(2)伴有胆管癌、肝外转移;(3)门静脉主干完全阻塞。研究遵循赫尔辛基宣言的原则,并经我院医学伦理委员会批准通过,患者签署知情同意书。
1.2 TACE方法 在DSA下,经股动脉穿刺置管至肝固有动脉,造影了解肝内肿瘤及血供情况。超选择插管至供血动脉,给予碘化油(山东烟台鲁银药业公司)5~10 ml与丝裂霉素(浙江海正药业公司)2 mg、卡铂(百时美施贵宝公司,美国)300 mg和表阿霉素(辉瑞制药公司,美国)50 mg混合后,注入行血管栓塞。
1.3 MRI检查及图像处理 使用德国西门子公司3.0 T超导型MRI扫描仪进行检查。MRI功能成像包括DWI和DCE。DWI检查方法如下:采用自旋回波平面回波序列,b值=0 mm2/s、 500 mm2/s和1000 mm2/s。具体参数包括TR 1900 ms,TE 73 ms,层厚 6 mm,层间距 1.2 mm,矩阵 112×128,FOV 330~380 mm。对于每个定量MR序列,在多个解剖水平上通过肝脏最宽部分进行轴向成像。选择肝脏感兴趣区(ROI),在右肝和左叶实质内最大限度地扩大ROI大小,同时避免可见的血管、胆管、坏死囊性变和伪影区域。通过后处理工作站测定TACE治疗前后HCC病灶大小、病灶坏死率、正常肝脏平均表观扩散系数(ADC)值和病灶平均ADC值。DCE检查方法如下:采用屏气同性各向容积式插入法检查序列,具体参数包括TR 3.30 ms,TE 1.15 ms,层厚 2.5 mm,层间距 0.5 mm,矩阵 288×164,FOV 370 mm。应用高压注射器经肘静脉注射对比剂钆双胺注射液(欧乃影,GE公司),注射速率为2 ml/s,注射剂量为0.1 mmol.kg-1。在注射对比剂完毕后,予以生理盐水冲洗。病灶ROI选择参考DWI检查方法,记录容积转移常数(Ktrans)和组织间隙-血浆速率常数(Kep)。

2 结果
2.1 TACE治疗前后DWI表现 在TACE治疗前,病灶平ADC值小于TACE治疗后,且差异具有统计学意义(P<0.05),而正常肝脏平均ADC值并无明显变化(P>0.05);TACE治疗后,HCC病灶出现坏死,但病灶并无显著缩小(P>0.05)。在76例经TACE治疗的HCC患者中,应答59例(77.6%),治疗无效17例;在TACE治疗前,治疗有效与无效患者HCC病灶大小并无显著统计学差异(P>0.05),病灶平均ADC值之间也不存在显著差异(P>0.05),而在TACE治疗后,治疗有效患者病灶平均ADC值明显高于治疗无效患者,且差异具有统计学意义(P<0.05,图1~3)。
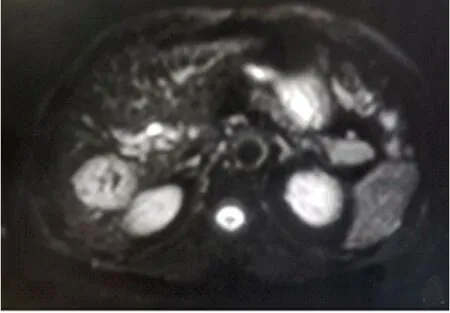
图1 肝细胞癌患者腹部MRI表现 男性58岁,肝右后叶占位性病变,DWI呈高信号
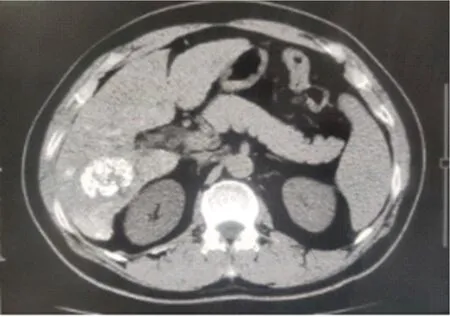
图2 肝细胞癌患者腹部MRI表现 TACE术后碘油沉积
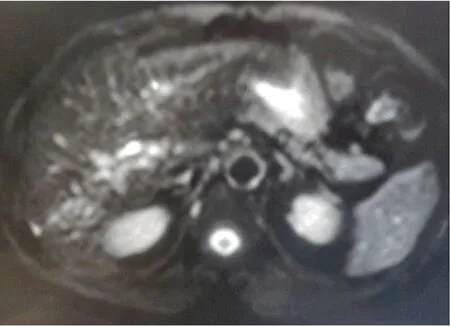
图3 肝细胞癌患者腹部MRI表现 在TACE术后1年,病灶强化范围明显缩小,DWI未见明显高信号
2.2 TACE治疗前后肿瘤动态增强扫描参数变化 在TACE 治疗后,肿瘤Ktrans值和Kep值较治疗前显著下降(P<0.05,表1);治疗有效患者Ktrans值显著低于治疗无效患者,且差异具有统计学意义(P<0.05),而Kep值在两组之间并无显著性差异(P>0.05,表2)。
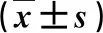
表1 TACE治疗前后功能磁共振成像参数变化比较
与TACE治疗前比,①P<0.05
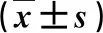
表2 治疗应答与未应答患者磁共振成像参数比较
3 讨论
TACE是不可手术切除治疗的中晚期HCC患者有效的治疗方法,经动脉注入或栓塞化疗药物使得HCC病灶发生坏死,达到抑制肿瘤进展、延长患者总体生存的目的。临床观察表明,TACE治疗后有相当一部分患者肿瘤病灶并未完全发生坏死,存在疾病复发的可能。所以,及时准确地评估TACE治疗后病灶是否残存肿瘤具有重要的临床意义。磁共振检查是一项无创、且不受碘油造影影响的成像方式,同时还具有软组织识别率高等特点,其在TACE术后疗效评估中的应用越来越广泛。本研究的目的是应用磁共振弥散加权成像和动态增强扫描对HCC患者在TACE治疗后肿瘤变化参数进行了评价。
DWI被广泛应用在肿瘤的诊断及疗效评估方面,能够反映组织结构中水分子扩散运动的情况,应用定量指标ADC值来表现存活与坏死组织之间的差异。根据现有的研究结果可知,增殖期肿瘤细胞壁完整,其水分子活动受到限制,直观体现为ADC值较低,而当HCC患者经过TACE治疗后,发生坏死的肿瘤细胞膜受到破坏,继而细胞通透性增加,水分子扩散不受到限制,此时测得的ADC值会较高[12-15]。本研究表明,HCC患者在TACE治疗前病灶平均ADC值小于TACE治疗后,且差异具有统计学意义。通过对患者疗效进行分层研究发现,对治疗应答患者TACE治疗后病灶平均ADC值明显高于治疗不应答患者,且差异具有统计学意义。这些结果与先前的研究结论相似。有些研究同时报道称ADC值的差异与TACE治疗后肿瘤病灶坏死程度存在正相关,即ADC值越大,那么该患者肿瘤坏死程度也越彻底,提示ADC是预测肿瘤组织存活状况的有效指标[16,17]。我们的研究通过比较TACE治疗前后HCC病灶大小、病灶坏死率发现,治疗后HCC病灶大小并无明显的变化,但肿瘤病灶坏死明显,表明TACE治疗的有效性。
动态增强磁共振成像是一种通过观察对比剂在患者体内的药代动力学表现而获取肿瘤定量血流动力学指标的技术,在分子功能层面上反映肿瘤组织的血容量、血流量和微血管表面通透性[18]。本研究主要应用两种动态增强指标,即Ktrans值和Kep值,进行TACE治疗定量的评估。Ktrans和Kep值的变化表明HCC患者肿瘤组织经过TACE治疗后瘤体供血血管减少,血流量下降,微血管表面通透性降低,提示TACE对肿瘤组织细胞起到了杀灭作用。本研究结果表明治疗后肿瘤Ktrans和Kep值均出现了明显降低,进一步比较治疗应答与未应答患者发现,两组Ktrans值存在显著性差异,但Kep值并无显著性差异,这些结果提示Ktrans值具备很好地评价HCC患者TACE治疗疗效的价值。除了本研究中所提及到的动态增强定量指标外,其他研究也作了其他定量指标的观察,认为在进行TACE治疗后,血管外细胞外间隙容积分数(Ve)值应当降低,原因是HCC组织细胞经过化疗药物治疗后会出现不同程度的坏死,此时整体组织微环境中的细胞外间隙出现增大[19]。通过随访TACE治疗后一段时间内HCC患者Ve值的变化发现Ve值的稳定性逐渐变差[20]。通过这些研究,可知动态增强磁共振成像参数对TACE治疗的HCC患者肿瘤病灶效果评估具有可行性,但目前其临床应用还处在探索过程中。

