甜橙bHLH转录因子家族的鉴定及生物信息学分析
孟富宣 杨玉皎 段元杰 吕陟远 陆晓英 郭淑萍 刘海刚
( 云南省农业科研学院热区生态农业研究所/元谋干热河谷植物园,云南 楚雄 651399)
转录因子(TF),又称为反式作用因子,通常包含4个功能区,即DNA结合域、转录调节域、核定位信号和寡聚位点[1-6]。目前的研究中,发现植物中的转录因子家族已经超过60个,根据DNA结合域中赖氨酸和精氨酸残基的数量,把转录因子分为四类,即锌指型(ZF)、螺旋转螺旋型(HLH)、碱性螺旋环螺旋型(bHLH)和碱性亮氨酸拉链(bZIP)。迄今为止,在高等植物中发现的最常见的转录因子家族是WD40、MYB、WRKY、bHLH和bZIP家族[7]。
bHLH TFs广泛存在于真核生物中,是继MYB家族之后的第2大家族[8-9]。bHLH TFs的DNA结合结构域包含约60个氨基酸,在转录因子序列的N端包含10~15个氨基酸的基本区域和约40个氨基酸的螺旋-环-螺旋区域,并且主要负责TFs与特定DNA序列的结合[9-13]。研究表明,同一个bHLH转录因子的2个α-螺旋或不同的bHLH TF的α-螺旋之间相互作用形成同源或异源二聚体,这些二聚体可以针对基因启动子的不同部分来调节目标基因[14-15]。与高度保守的BHLH结构域不同,TF序列的其余部分通常差异非常大。在靶基因启动子中,bHLH TFs主要与E-box序列(5′-CANNTG-3′)结合,最常见的形式是重复的Gbox(5′-CACGTG-3′)。DNA结合结构域中几个保守的氨基酸决定了转录因子对不同E-boxes核心序列位点的特异性[3,16]。Atchley等人根据动物bHLH TFs的进化关系和序列相似性将动物bHLH TFs分为6组(A-F)[10,17]。Heim等人发现多数植物的bHLH TFs属于B组[11]。随着分子生物学的快速发展,bHLH TF家族的多样性已被揭示,植物bHLH TFs基因在拟南芥(Arabidopsis thaliana)[14]、水稻(Oryza sativa)[13]、番茄(Solanum lycopersicum)[18]、短柄草(Brachypodium sylvaticum)[19]、花生(Arachis hypogaea)[20]和丹参(Salvia miltiorrhiza)[21]等多种植物中已经得到鉴定。高等植物的生长和形态发生是一个十分复杂的过程,是通过DNA和蛋白质之间的相互作用来实现的。已发现雌性藤本植物开花过程是由SPT和HEC编码基因共同调控的[22]。在拟南芥中,光形态发生的调节主要通过光敏色素调控基因相互作用来实现的[23]。在转录水平上,一般通过TF和相关基因的联合调控来实现高等植物逆境应答的调控。Abe等人发现拟南芥中RD22的产生主要是由干旱胁迫和脱落酸(ABA)的诱导。RD22启动子区含有MYC(bHLH)和MYB 转录因子识别位点,相应的转录因子与这些位点特异结合以调节基因表达[24-25]。
bHLH TFs还参与植物次生代谢,由R基因编码的玉米(Zea mays)Lc蛋白是植物中首次报道的bHLH TF,并且发现其在玉米花青素代谢途径中调控至少2个结构基因[26]。Goodrich等人从金鱼草(Antirrhinum majus)中克隆得到Delila基因,该基因编码具有与玉米R基因家族编码的蛋白质相似的螺旋-环-螺旋结构域的蛋白质,随后证实Ddila基因的表达与花色素苷的积累密切相关[27]。参与拟南芥花色素苷合成调控的bHLH TFs属于第III亚组,其中包括TT8、EGL3、GL3和MYCI TF家族[11,28]。
柑橘(Citrus reticulata)是具有重要经济价值的多年生木本果树作物之一,是世界第一大水果,全世界的总产量达1.2亿t,居所有水果之首[29]。柑橘主要在我国南方地区种植,栽培面积达229万hm2,产量达到2 944万t。本研究以甜橙(Citrus sinensis)为试验材料,通过全基因组数据库搜索鉴定,共鉴定出126个CsbHLH基因,并对其进行了理化性质、系统发育、染色体分布、保守基序、蛋白互作生物信息学分析,并分析了它们在不同组织的表达情况。为CsbHLH基因的功能研究奠定了基础,并有助于bHLH基因在其他植物物种中的功能研究。
1 材料与方法
1.1 甜橙bHLH转录因子家族的鉴定
从柑橘基因组数据库中下载了CsbHLH序列(http://citrus.hzau.edu.cn/orange/)。使 用Pfam数据库(http://pfam.janelia.org/search/sequence)中的隐马尔可夫模型(HMM)文件进行本地BLAST(Evalue-5)搜索,以筛选所有候选CsbHLH基因序列。保留含有已知保守结构域的候选基因,并通过对Pfam,NCBI Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和SMART(http://smart.embl-heidelberg.de/)数据库的核对以确定bHLH结构域(PF00010)的存在[30]。利用BLSATP方法在拟南芥基因组数据库(TAIR;https://www.arabidopsis.org/)获得甜橙bHLH同源基因的相关注释信息,参数为默认值[31]。拟南芥bHLH基因序列分别从拟南芥信息资源(TAIR)网站下载。对CsbHLH、AtbHLH序列进行生物信息学分析,并使用ExPASy(http://www.expasy.ch/tools/pi_tool.html)计算理化参数,MW、pI和GRAVY等。
1.2 甜橙bHLH基因的系统发育和多重序列比对分析
用MEGA 6.0中的邻距法(NJ,Neighborjoining)构建系统发育树,其中校验参数 Bootstrap=1 000。利用MEGA 6.0构建CsbHLH基因的个体系统发育树和来自2个物种(AtbHLH和CsbHLH)的bHLH基因的综合系统发育树,并对甜橙bHLH基因家族进行分类。使用ClustalX 2.11对CsbHLH基因的蛋白质序列进行多重序列比对,参数设定为默认参数。
1.3 甜橙bHLH基因保守基序分析
利用在线MEME系统(http://meme.sdsc.edu/meme/itro.html)来识别保守基序,参数设置为:重复次数“任意”,最高基序数“20”,基序长度“6-200”,其他均为默认值。
1.4 甜橙bHLH基因的染色体位置和基因重复
通过使用来自支架的染色体定位和注释信息来探索FRO基因在染色体上的分布,并且使用公开可用的数据库和Map Draw软件来根据物理位置显示精确的基因位置。还通过使用植物基因组复制数据库(PGDD,http://chibba.agtec.uga.edu/duplication/index/locus)在FRO基因家族中进行基因重复分析。
1.5 甜橙bHLH蛋白功能联系网络
利用 String 蛋白互作数据库(http://string-db.org/)对126 个bHLH蛋白的互作网络进行分析,物种参数选择模式植物拟南芥。
1.6 甜橙bHLH转录因子的表达分析
甜橙RNA-seq表达数据来自Citrus sinensis Annotation project数据库,利用Matrix2png interface软件对甜橙bHLH家族基因表达模式进行分析,绿、黑、红3个颜色表示基因的表达强度,绿色越强代表表达量越小,红色越强代表表达量越大,黑色为中间值。
2 结果与分析
2.1 甜橙中bHLH基因家族成员的鉴定及理化性质分析
研究者利用是否含有保守结构域bHLH基序(PF00010),在拟南芥[14]中鉴定出bHLHTFs 144条,鉴于此,利用该保守结构域鉴定柑橘中的bHLH基因,然后通过NCBI BlastP 和Citrus Sinensis Annotation Project数据库(http://citrus.hzau.edu.cn/orange/index.php)在柑橘基因组中搜索验证,最终获得126个bHLH基因(表1)。其内含子数目介于0~12之间,其中CsbHLH002、CsbHLH012、CsbHLH041、CsbHLH068、CsbHLH124、CsbHLH126不含有内含子,CsbHLH087最多含12个内含子。
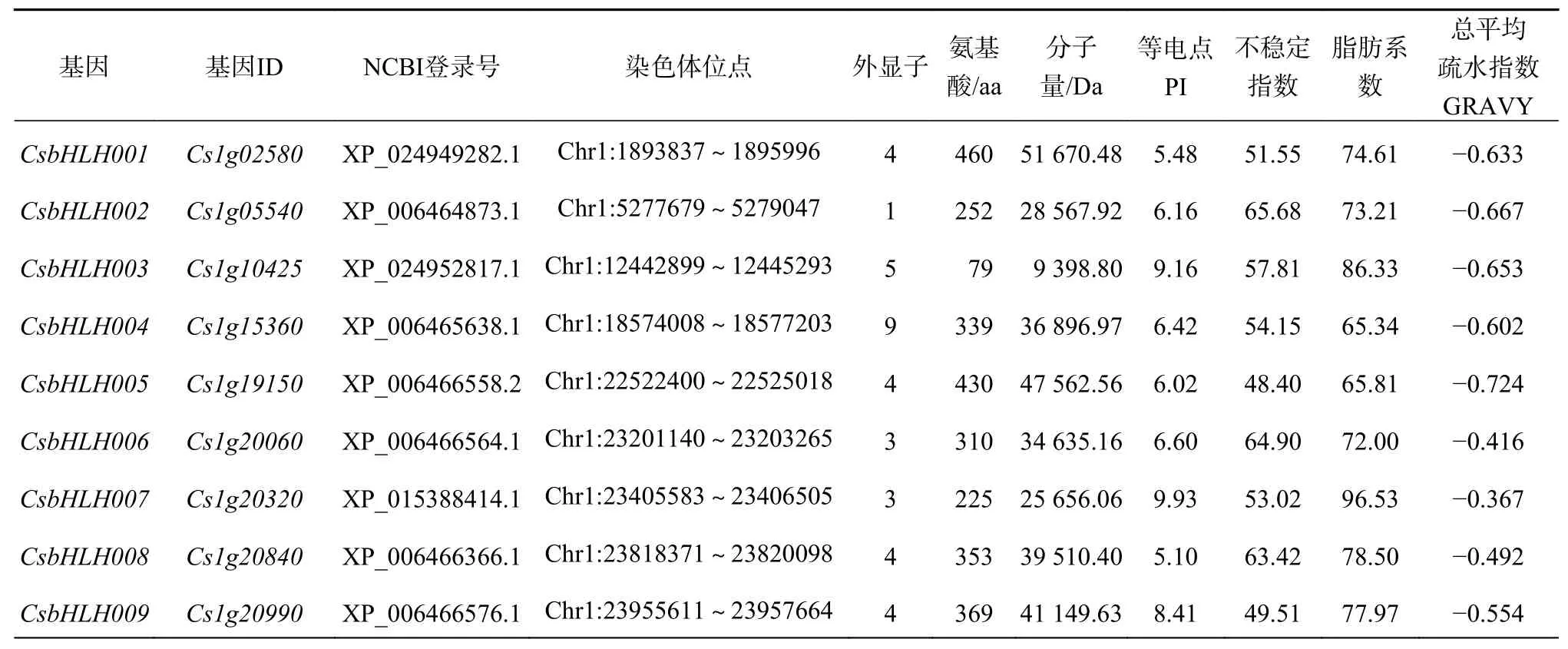
表 1 甜橙中鉴定出的CsbHLH基因家族成员及其基本特性Table 1 The CsbHLH gene family members in C. sinensis and their basic characteristics

续表 1

续表 1
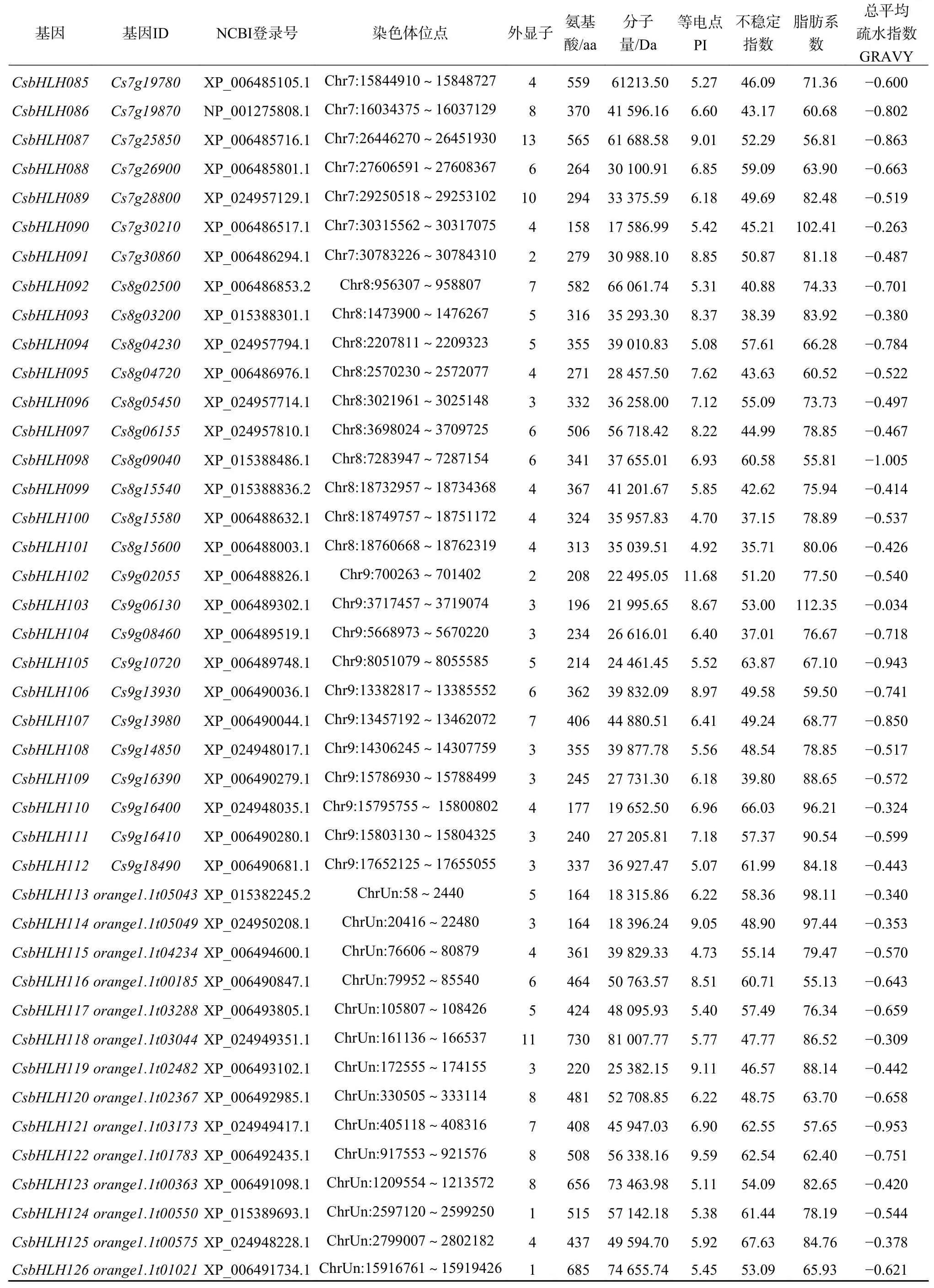
续表 1
根据基因在染色体上的位置,将甜橙126个bHLH基因分别命名为CsbHLH001~CsbHLH126,编码氨基酸数从79(CsbHLH003)~762(CsbHLH067),平均长度为359个氨基酸。通过Ex-pasy预测其分子量大小为9.40~83.84 kD,等电点为4.42(CsbHLH069)~11.68(CsbHLH102)。从以上理化性质来看,虽然bHLH TFs的保守结构域中存在碱性区域,但酸性氨基酸富集于蛋白质分子中,因此65.87%的甜橙bHLH家族蛋白等电点小于7,大部分呈弱酸性,此现象与拟南芥[14]及水稻[13]相同。甜橙中bHLH家族蛋白总平均亲水性在−1.005~−0.034之间,均为负值,说明该家族蛋白均属于亲水性蛋白;不稳定指数介于35.17~93.56之间,其中94.44%是不稳定蛋白(II>40),只有7个属于稳定蛋白(II<40);脂肪指数介于49.75~112.35之间;通过在线软件TargetP和CELLO v2.5对126个甜橙bHLH蛋白进行亚细胞定位,结果显示大部分分布在细胞质、细胞核、叶绿体以及线粒体基质上。甜橙126条bHLH蛋白经SignalP预测分析,均不存在信号肽,属于非分泌型蛋白。
2.2 甜橙bHLH基因的染色体定位与分布
bHLH转录因子在甜橙连锁群上的分布如图1所示。CsbHLH001~CsbHLH112在9条染色体中呈不均匀分布,“ChrUn”表示的是CsbHLH113~CsbHLH126基因存在于连锁群上,但不能定位到连锁群的骨架,还需进一步的基因组测序信息才能确定;其中7号染色体上分布最多为17条,4号染色体最少为7条。一般认为,基因之间的距离小于100 kb的即为串联复制,分析发现,甜橙染色体上存在基因串联复制现象的有Chr1上的CsbHLH010和CsbHLH011;Chr2上的CsbHLH016和CsbHLH017,CsbHLH026和CsbHLH027;Chr3上 的CsbHLH039、CsbHLH040和CsbHLH041;Chr5上 的CsbHLH052和CsbHLH053;Chr6上 的CsbHLH067和CsbHLH068;Chr7上的CsbHLH080和CsbHLH081;Chr8上的CsbHLH099、CsbHLH100和CsbHLH101;Chr9上的CsbHLH106和CsbHLH107,CsbHLH109和CsbHLH110。
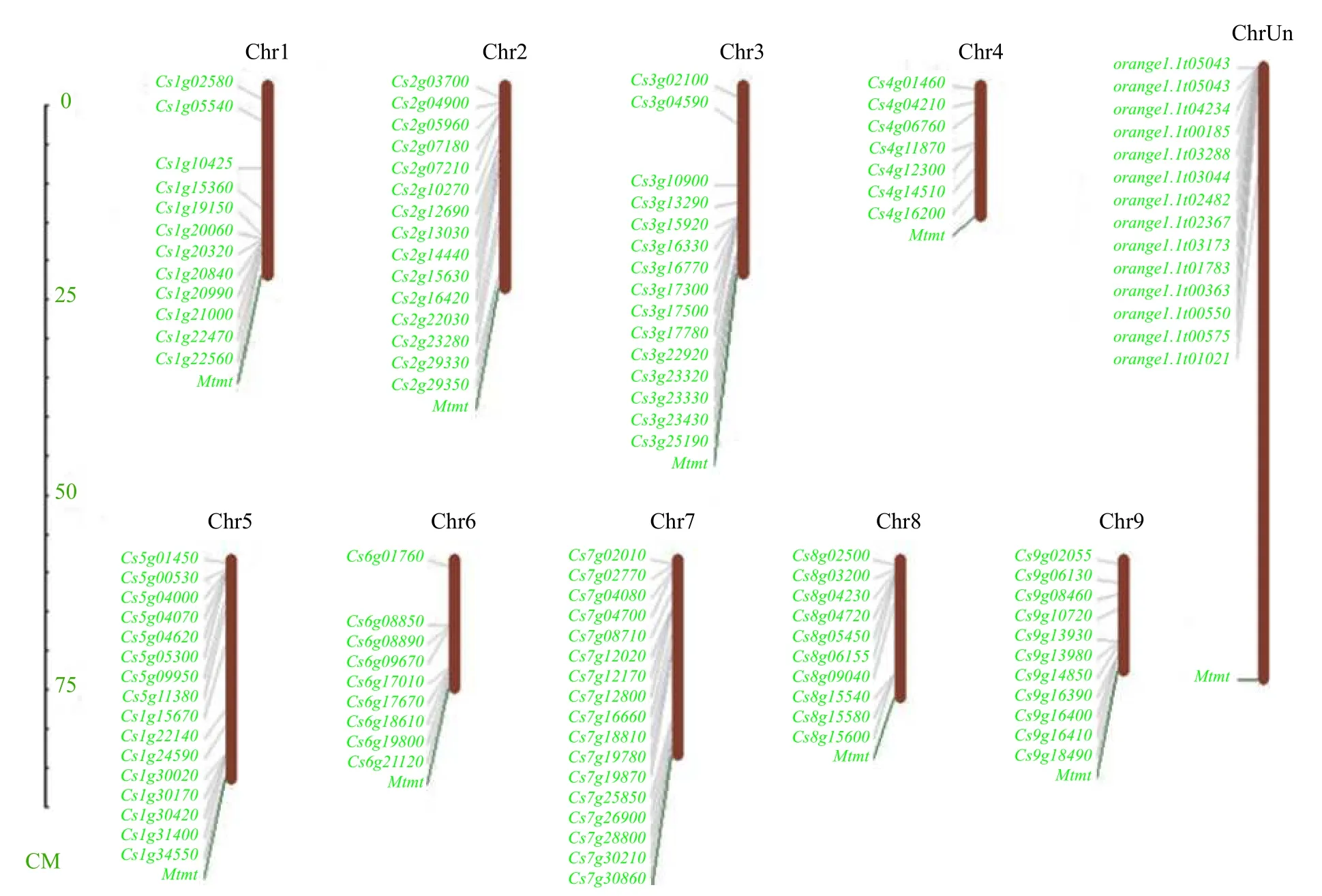
图 1 甜橙bHLH基因在染色体上的定位Fig. 1 Chromosomal locations of C. sinensis bHLH gene family
2.3 甜橙与拟南芥bHLH基因家族的进化关系
为了研究甜橙bHLH基因家族的进化关系,利用鉴定出的 126条甜橙bHLH蛋白序列与144条拟南芥bHLH蛋白序列构建进化树(图2)。根据拟南芥中bHLH TFs的分类系统和甜橙bHLH TFs进化树的分类情况,全部成员分为16个亚族,其中第XVI亚族中的bHLH成员数量最多,共19个,第I、V亚族中的成员数量最少,仅为2个。甜橙与拟南芥在第I、II、III、IV、V、VI、XI、XIII和XV共9个亚家族中的成员数量相同或相似,差异最大的是第XII 亚族,甜橙bHLH数量不及拟南芥的50%,而第I、III和XVI亚族中的bHLH成员数量均多余拟南芥,以上结果表明甜橙bHLH家族基因历史演变的过程中发生了基因扩增或收缩。
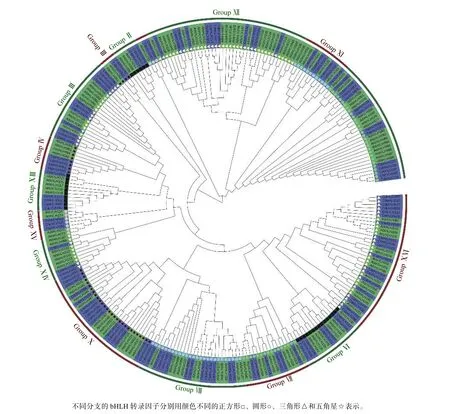
图 2 甜橙和拟南芥bHLH基因家族的进化树Fig. 2 Phylogenetic tree based on C. sinensis and arabidopsis bHLH transcription factors
2.4 甜橙bHLH家族基因保守基序分析
通过多序列比对和SMART分析发现,甜橙126个蛋白序列均含有bHLH结构域。根据鉴定出的甜橙CsbHLH基因的保守结构域序列,构建甜橙系统进化拓扑图,得到的结果与图2中所示的进化关系是基本一致的。甜橙bHLH保守基序进行分析结果如图3所示,每一个亚家族之间的转录因子尽管它们的长度差别很大,但是它们的保守基序长度及位置都很相似。motif1-10在图中用不同的颜色表示,10个保守基序的详细信息如表2所示。除bHLH保守结构域外,bHLH 转录因子家族还含有其他保守型的结构域,但Motif1和Motif2总是相邻,两者共同构成了bHLH结构域。这些保守元件是转录因子发挥其调控作用所必需的,对于维持蛋白质的三维构象和与靶基因的结合至关重要。
2.5 甜橙bHLH蛋白互作关系
甜橙bHLH蛋白互作预测分析绘制出调控图如(图4)所示。在植物生长和次生代谢中bHLH TFs起重要作用,而且多种植物胁迫反应中也有bHLH TFs的参与。在甜橙中bHLH104与ILR3可以协同作用调控PYE基因的表达,而PYE是植物铁吸收相关的重要转录因子,拟南芥中转录调控因子MYC2和MYC4协同调控了拟南芥的开花诱导,甜橙中MYC2和MYC4也具有协同调控作用。ICE1与SPCH、MUTE、FAM和bHLH093相互作用,正调控气孔的发育。AMS、DYT1和AT2G31210之间具有协同作用,且AMS和DYT1对植物花器官发生、形成、生长发育有调控作用,因此三者可能协同调控甜橙花器官的发生、形成及生长发育。甜橙中光敏色素互作蛋白PIL5、PIL6、PIF3和PIF7共同作用来调节光形态发生。
2.6 甜橙bHLH基因在不同器官表达情况
对甜橙126个bHLH基因在愈伤组织、花、叶、果实、混合样(Mixture1:幼果果肉果皮,Mixture:2:生长中期的果肉果皮,Mixture3:成熟期果肉果皮)的表达芯片数据进行了分析。结果如图5所示,CsbHLH013、CsbHLH047、CsbHLH062、CsbHLH105、CsbHLH02054、CsbHLH043、CsbHLH126、CsbHLH063、CsbHLH059、CsbHLH075、CsbHLH061、CsbHLH115、CsbHLH07313个基因在愈伤组织、花、叶、果实及混合样均大量表达。其中CsbHLH043(LRL1)在愈伤组织中的表达量最大,CsbHLH124(MYC4)在花和叶片中的表达量均最大,CsbHLH115在果实中的表达量最大,在组织中高度表达的CsbHLH基因可能具有相似的作用。
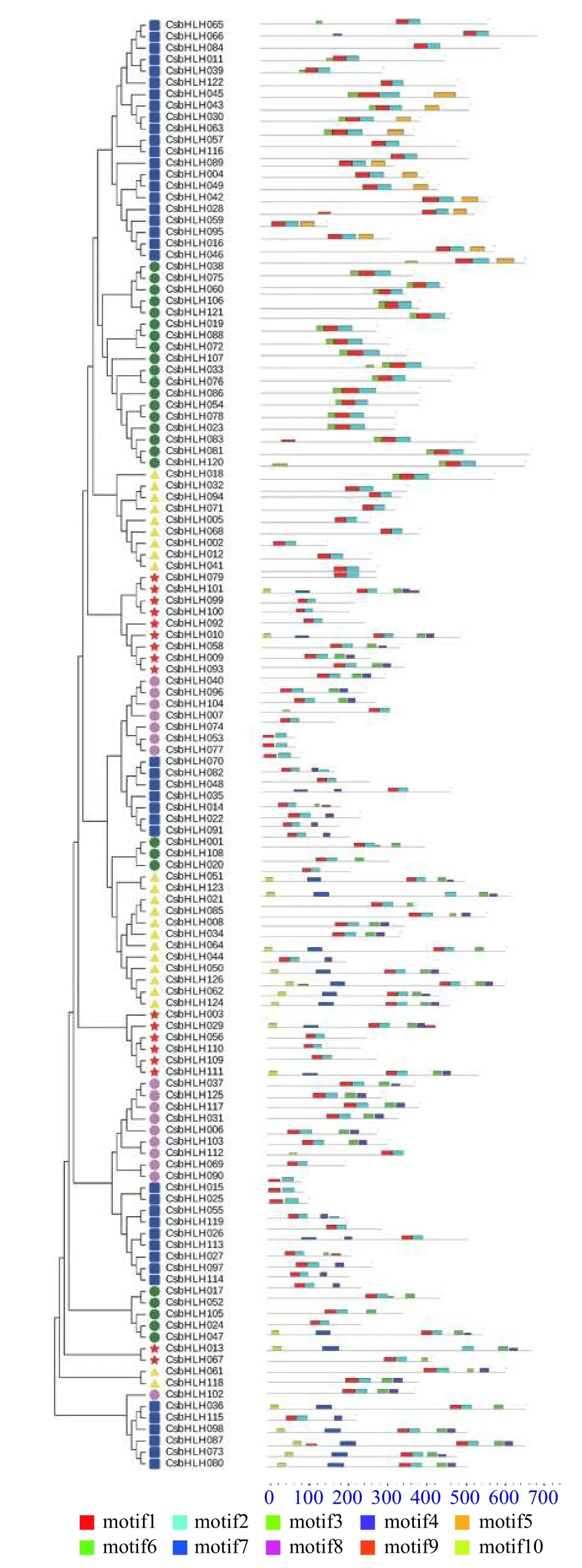
图 3 甜橙bHLH转录因子的保守基序分析Fig. 3 The conserved motifs analysis of C. sinensis bHLH transcription factors
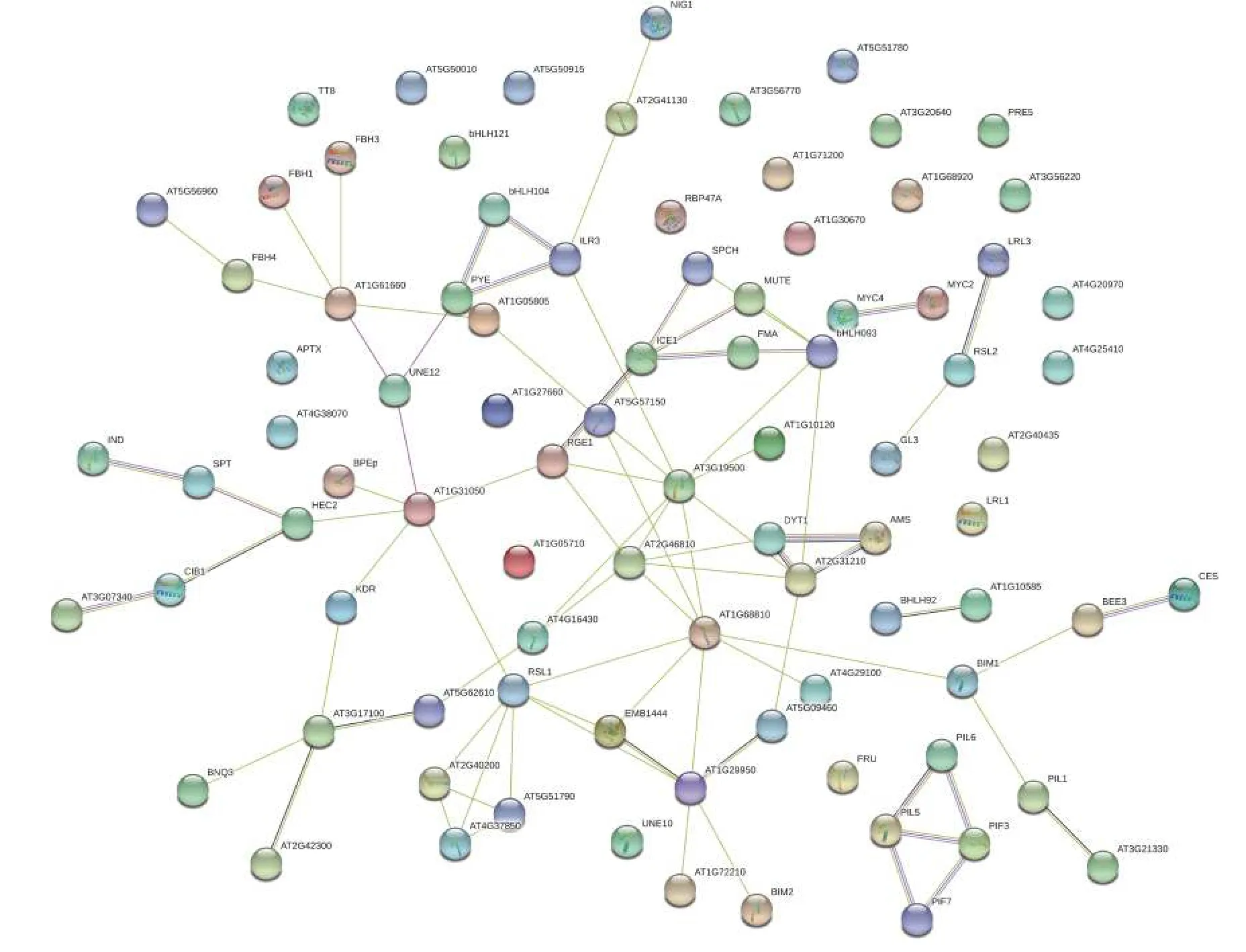
图 4 甜橙CsbHLHs蛋白功能关系网络Fig. 4 CsbHLHs protein function control network of C. sinensis
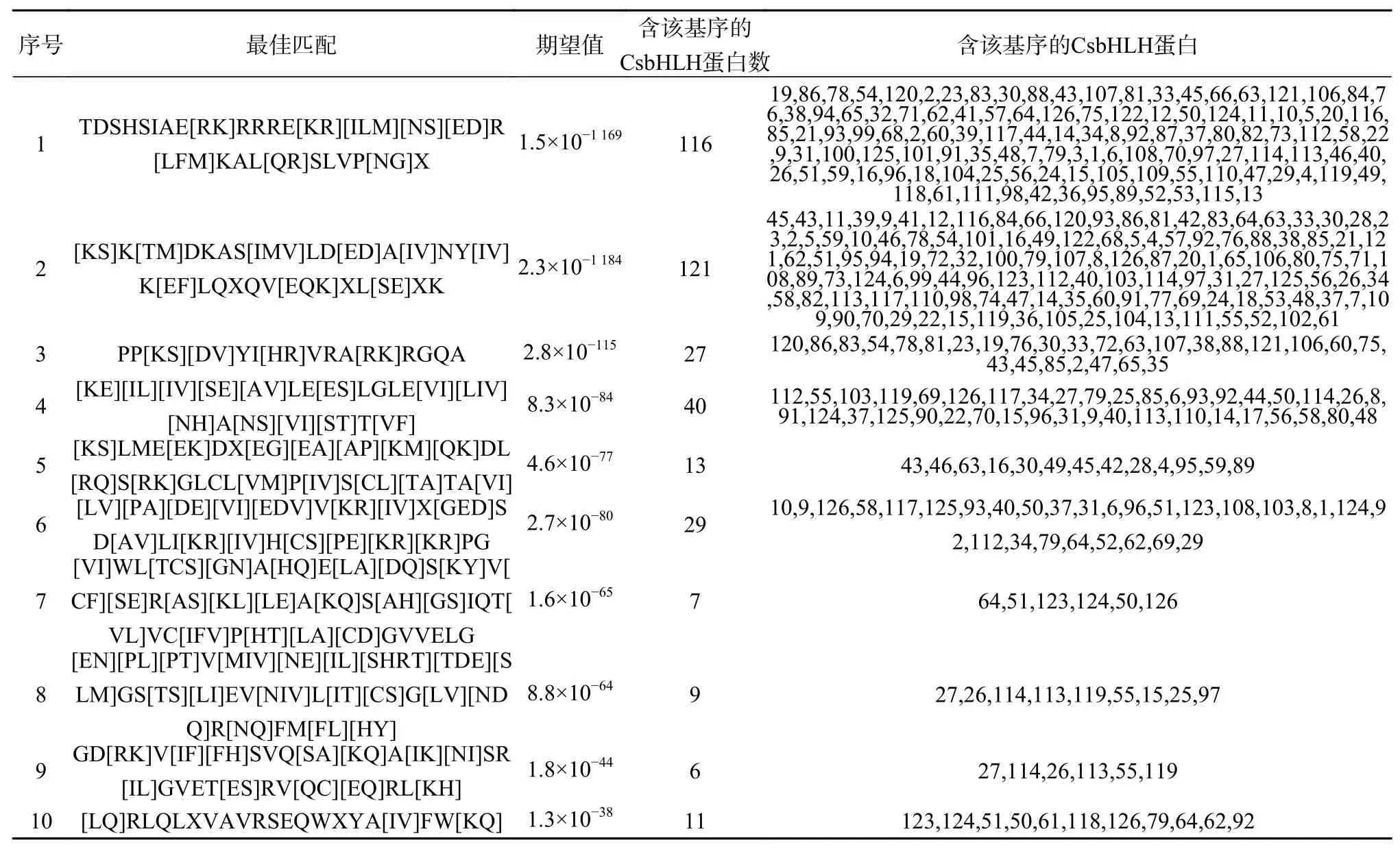
表 2 甜橙 bHLH 基因的保守基序Table 2 The conserved motifs of C. sinensis bHLH genes

图 5 甜橙bHLH基因在不同组织的表达分析Fig. 5 Expression analysis of bHLH gene in different tissues of C. sinensis
3 结论与讨论
bHLH家族在真核生物转录因子家族中是一个大家族,并在生物的生长发育、生理及新陈代谢过程中发挥着一系列的重要调节作用[32]。已经在诸如苹果(Malus domestica)[33]、樱桃(Cerasus pseudocerasus)[34]、短柄草[19]和拟南芥[14]等植物中鉴定了bHLH家族的转录因子,并对其生长与生物和非生物胁迫之间的关系也做了研究。耿晶晶的研究报道鉴定出56个甜橙bHLH家族成员,并分析了其在低温胁迫下的表达模式[35]。在本研究中,利用生物信息学的手段对甜橙中的bHLH TFs进行鉴定,并对其理化性质、保守结构域、系统进化关系、染色体上的位置分布及在不同组织中的表达情况等方面进行了分析,为bHLH基因家族在基因表达调控、结构和功能等研究提供参考,为揭示bHLH家族基因参与植物生长发育机制的调控提供参考。
通过分析验证从甜橙中鉴出了126个bHLH基因(表1),根据基因在染色体上的位置,将柑橘126个bHLH基因分别命名为CsbHLH001~CsbHLH126,bHLH保守结构域是由HLH区和碱性氨基酸区和两部分组成。研究者发现,在番茄bHLH转录因子家族中同样存在高度保守的Glu9、His5、Arg13及 Arg10 等氨基酸残基,在HLH区也存在高度保守的氨基酸残基Leu23 和 Leu64[18]。HLH区的保守氨基酸残基与二聚体形成相关,而碱性氨基酸区保守氨基酸残基与靶基因的结合紧密相关。
基因结构和染色体定位分析发现,甜橙bHLH基因家族内含子数量差异较大,基因在染色体上的分布也不均匀(图1),基因复制是基因重组以及扩增的最主要途径,其主要包括串联重复和大片段复制2种方式[36]。串联重复是指在同一条染色体的2个相邻基因,大片段复制事件发生在不同染色体上[37]。本研究中,126个CsbHLH基因中的22个(17.4%)参与到串联重复事件中;虽然基因复制事件不多,但依然可以推测,基因复制是甜橙bHLH基因家族扩增的主要模式。串联复制的序列与保守区域非常的相似,进化树中的它们的亲缘关系也很近,因此推测,在进化的过程中他们的功能也类似,但还有待进一步的研究验证。通过在线软件 MEME 对甜橙126条bHLH基因的保守基序进行分析,从中找到了10 个高度保守氨基酸基序,保守基序分析显示,同一亚家族中的大多数保守基序相似,表明每个亚家族中编码蛋白的功能是稳定的,Motif1和Motif2几乎存在于所有的CsbHLH蛋白中,且总是相邻,共同构成bHLH结构域,综上,所有这些bHLH保守基序在同一亚家族的独特性及保守性也是对甜橙bHLH基因家族的进化分类的佐证,同时推测,除bHLH结构域外的其他保守基序也是每个亚家族发挥其相应功能的关键。
为了研究甜橙bHLH基因家族的进化关系,本研究把126个bHLH 划分为16个亚族,同一亚家族内的成员大都具有相同的内含子模式和保守基序。bHLH TFs家族成员数量巨大,对其进行分类有一定难度。bHLH TFs参与植物多种调控代谢活动。
已发现植物开花过程是由SPT和HEC编码基因共同调控的[22],Zhang等[38]通过拟南芥突变株DYT1花药发育不良证实 DYT1是花药发育的必须调控因子,可以与bHLH010,bHLH089 和bHLH090通过互作来调节拟南芥的花药发育和转录表达[39]。预测分析发现AMS、DYT1和AT2G31210可能协同调控甜橙花器官的发生、形成及生长发育,而MYC2和MYC4协同调控甜橙的开花过程。ICE1调控CBF/DRB1基因的冷诱导转录,与CBF3/DREB1A启动子中发现的MYC识别位点(5'-CANNTG-3')特异性结合,通过与SPCH、MUTE和FAMA等的相互作用控制气孔细胞分化及保卫细胞的形成[40]。本研究中ICE1与SPCH、MUTE、FAM和bHLH093相互作用,对甜橙气孔的发育有正调控作用。根据Huq和Peter H.Quail的研究结果,bHLH 转录因子HFR1、PIF3和PIF4在光敏色素信号传导中发挥调节作用[41]。甜橙中光敏色素互作蛋白PIL5、PIL6、PIF3和PIF7共同作用来调节光形态发生。参与拟南芥花色素苷合成调控的bHLH 转录因子包括TT8、EGL3、GL3和MYCI TF家族[11],Zimmermann等人发现它们都与R2R3-MYB 转录因子相互作用,包括PAP1(AtMYB75)和PAP2(AtMYB90),TT8与MYB75/PAP1或MYB90/PAP2相互作用,参与调控黄酮类色素沉着,在调节无色花色素还原酶(BANYULS)和二氢黄酮-4-还原酶(DFR)中起关键作用[42]。分析与甜橙发育相关的组织表达数据,为CsbHLH基因家族提供了初步的器官特异性表达数据,为进一步阐明这些基因在甜橙的进化发育中的作用奠定了基础。

