MCA在IFN-α和TNF-β基因多态性检测中的临床应用
石彩歌 肖奇志 黄士荷 张素粉 王群慧 陈兴 聂继跃 郭天棋
干扰素-α(IFN-α)和肿瘤坏死因子-β(TNF-β)在机体抵御微生物感染和抗肿瘤中有着非常重要的作用[1-6]。研究表明IFN-α和TNF-β上特定位点的基因多态性与免疫系统清除病原体及肿瘤患者的病情发展具有相关性[7-10]。其中IFN-α的rs6475526位点基因多态性与直肠癌发病有关;TNF-β的rs2239704位点的基因多态性可能与血液肿瘤的病情发展具有一定的相关性;TNF-β的rs909253位点的基因型多态性与胃癌和乳腺癌等肿瘤的发生密切相关。开展细胞因子的基因多态性临床检测研究有助于进一步开展细胞因子抗肿瘤和抗病毒机制的研究,提高对癌细胞病变过程的认识。本文以荧光探针熔解曲线技术平台为基础,建立了一个能够单管同步检测IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点基因多态性的三重检测体系。
1 资料与方法
1.1 基因多态性熔解曲线分析检测体系的建立
本研究开发了一个能够在单个实时荧光PCR体系中同步检测IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点的9种基因多态性的熔解曲线分析检测体系。其技术原理如图1所示,采用二重PCR扩增和三色荧光探针熔解曲线方案。其中IFN-F引物(5’-ACATTATTAAGTTGGGAGAAG TGTC-3’)和IFN-R引物(5’-ATGTATACATAAACTCAAG AGGTCA-3’)可扩增IFN-α基因片段并通过FAM荧光探针(5’-FAM-CACCTTATCATGTCTCTTAGAAGAAAGAAAGGTGBHQ1-3’)同步检测rs6475526位点的3种基因多态性;TNF-F引物(5’-CAGTCAGAGAAACCCCAA-3’)和TNF-R引物(5’-CTTCCTCTATAAAGGGACCTG -3’)可扩增TNF-β基因片段并通过Cy5荧光探针(5’-Cy5-TAGGACACTGCGGGGCGGTAGTCCT-BHQ2-3’)检测同步检测rs6475526位点的3种基因多态性,通过ROX荧光探针(5’-ROXTAGAGAGGAATCATGGCAGA-BHQ2-3’)检测同步检测rs909253位点的3种基因多态性。
检测体系的PCR反应体系体积共计25 μL,检测体系成分 如 下:1 X TaqHS Buffer,3 mM MgCl2,0.2 mM dNTPs,2.0 U的TaqHS聚合酶(Takara,大连宝生物工程有限公司),50 nM IFN-F引物和TNF-F引物,500 nM IFN-R引物和TNF-R引物,IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点的检测荧光探针各500 nM。检测仪器为SLAN-96实时荧光PCR仪(上海宏石医疗科技有限公司),检测程序如下:PCR扩增程序为95℃5 min;10个循环的95℃ 15 s,65℃至55℃(每个循环降低1℃) 20 s和76℃ 20 s;50个循环的95℃ 15 s,65℃ 20 s和76℃ 20 s;熔解曲线分析程序为95℃2 min;40℃2 min;随后按0.4℃/step的升温速率(每个step的维持时间是5 s),将反应体系的温度从40℃升温至85℃,并在此过程中采集FAM、Cy5和ROX通道的荧光信号。
1.2 临床试验入组病例资料
本次临床试验共入组本院2018年1月—2019年6月共计282例宫颈拭子样本。其中237例样本采集自宫颈疾病的患者,45例样本采集自体检健康人群。宫颈疾病的患者包括:宫颈癌患者46例;宫颈上皮内瘤变Ⅲ级(CIN Ⅲ)患者50例;宫颈上皮内瘤变Ⅱ级(CIN Ⅱ)患者46例;宫颈上皮内瘤变Ⅰ级(CIN Ⅰ)患者49例;宫颈炎患者46例。全部患者均因白带异常、宫颈炎、阴道流血、接触性出血、宫颈炎、阴道流血等症状出现而就诊。所有病例均有性生活史,就诊前一周内未使用过抗生素行阴道药物治疗。宫颈疾病患者的年龄范围为19~63岁,平均年龄及其标准偏差为(39.86±10.68)岁;健康人群的年龄范围为26~66岁,平均年龄及其标准偏差为(42.56±10.96)岁。经独立样本t检验后P= 0.124>0.05,宫颈疾病患者与健康人群间的年龄分布无统计学差异。
1.3 临床试验方案
临床试验采用双盲法对全部282例的入组样本同步进行熔解曲线分析检测体系与Sanger测序的平行检测,检测结果由第三方人员核对。临床试验具体方案如下:(1)用Qiagen人类组织和细胞DNA提取试剂盒提取宫颈拭子中的人基因组DNA。(2)将提取后的基因组DNA均分为两份,一份直接加样进行解曲线分析体系检测,另一份再均分为三份分别用进行PCR扩增后独立进行Sanger测序验证。(3)第三方人员核对熔解曲线分析检测体系与Sanger测序检测结果,并计算两种检测方法的一致率。
1.4 统计学方法
用SPSSV22.0软件统计IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点在不同类型病例中的基因多态性分布,并采用卡方(χ2)检验验证P值是否小于0.05,不同类型人群的基因型多态性分布是否具有差异性。
2 结果
2.1 基因多态性熔解曲线分析检测体系的建立
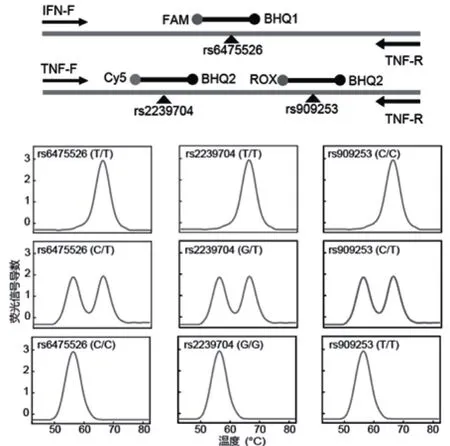
图1 多重荧光探针熔解曲线检测IFN-α和TNF-β基因多态性技术原理图
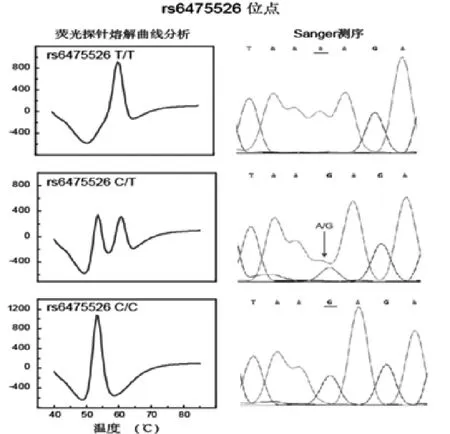
图2 多重荧光探针熔解曲线检测IFN-α的rs6475526基因多态性的检测结果图(左图);同一样本的Sager测序对照结果(右图)

图3 本次临床试验中rs6475526、rs2239704和rs909253位点基因多态性分布图
本研究基于荧光探针熔解分析曲线技术平台,建立了一个同步检测IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点基因多态性的检测体系。图2以FAM荧光通道IFN-α的rs6475526位点结果为例,左图为熔解曲线检测体系对rs6475526位点三种多态性基因型样本的检测结果:当在60.0℃处出现熔解曲线峰时为T/T基因型;当在53.0℃处出现熔解曲线峰时为C/C基因型;当在60.0℃和53.0℃处同时出现熔解曲线峰时为C/T基因型。检测结果对应的测序图谱详见图2右图,本次临床试验中Sanger测序采用反向引物测序,因此图谱中显示的是对应的互补碱基。
TNF-β的rs2239704位点检测荧光通道为Cy5荧光通道,当在74.2℃处出现熔解曲线峰时为T/T基因型;当在68.7℃处出现熔解曲线峰时为G/G基因型;当在74.2℃和68.7℃处同时出现熔解曲线峰时为G/T基因型。TNF-β的rs909253位点检测荧光通道为ROX荧光通道,当在61.5℃处出现熔解曲线峰时为C/C基因型;当在57.7℃处出现熔解曲线峰时为T/T基因型;当在61.5℃和57.7℃处同时出现熔解曲线峰时为C/T基因型。
2.2 临床试验结果分析
2.2.1 基因多态性统计分析 本次临床试验中,熔解曲线分析检测体系和Sanger测序技术对282例宫颈拭子样本的IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点基因多态性检测结果一致率为100%,具体基因型分布如图3所示,其中TNF-β的rs909253位点基因型分布为:C/C基因型83例(29.4%),C/T基因型120例(42.6%),T/T基因型79例(28.0%);rs2239704位点基因型分布为:T/T基因型144例(51.1%),G/T基因型99例(35.1%),G/G基因型39例(13.8%);IFN-α的rs6475526位点基因型分布为:T/T基因型122例(43.3%),C/T基因型129例(45.7%),T/T基因型31例(11.0%)。

图4 本次临床试验中不同组人群样本在rs6475526、rs2239704和rs909253位点上的基因型多态性分布差异图
2.2.2 患者健康状况与基因多态性关系分析 根据入组人群的健康状况和患病类型,本研究在图4中对检测结果进行归类分析。由于不同基因型样本例数差距较大,图4中采用样本基因型性分布率(基因型中特定人群数/该基因型的总入组人数)代替样本数进行统计。从统计结果中可以看出:IFN-α的rs6475526位点中,健康人群在T/C基因型中分布率(18%)高于T/T(15%)和C/C基因型(16%);TNF-β的rs2239704位点中,健康人群在G/G基因型中分布率(26%)高于T/T(15%)和T/G基因型(13%);TNF-β的rs909253位点中,健康人群在C/T基因型中分布率(18%)高于C/C(16%)和T/T基因型(14%)。经卡方(χ2)检验健康人群和患宫颈疾病人群在IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点中的基因多态性分布率的P值均小于0.05,即健康人群和患病人群在这三个位点的基因多态性分布率都具有差异性。
3 讨论
细胞因子的特定位点基因多态性与肿瘤细胞的产生和清除密切相关,IFN-α和TNF-β是其中两类重要的抗病毒和抗肿瘤细胞因子。已有研究表明IFN-α的rs6475526位点和TNF-β的rs2239704、rs909253位点的基因多态性与多种肿瘤的病情发展相关[7-10]。目前对基因多态性的检测方法的金标准依旧是传统的Sanger测序技术。Sanger测序技术对基因多态性的识别有很高的准确性,但是Sanger测序技术如果要检测多种细胞因子的不同基因位点就需要进行多管的PCR扩增后再进行多次的测序检测[11]。而且Sanger测序的检测通量非常有限,难以对大批量的样本开展临床试验。建立简便、快速并适合临床使用的基因多态性检测技术可为开展大规模的基因多态性临床试验,也进一步为研究基因多态性与疾病的相关性提供有力的工具。
已有大量研究报道证实多重荧光探针熔解曲线技术在基因多态性检测中具有很好的检测准确性和临床适用性[12-16]。本研究以IFN-αrs6475526位点和TNF-β的rs2239704、rs909253位点为模型,验证了多重荧光探针熔解曲线在细胞因子基因多态性临床检测中应用的可行性。在此基础上开展了小规模的临床验证实验。从图1技术原理中可以看出本文所建立的三色荧光探针熔解曲线分析检测体系可以在单个PCR管内同步检测9种基因多态性。无论是纯合样本还是杂合样本,检测结果与金标准Sanger测序技术完全一致(图2)。从图2杂合样本检测结果中可以看出熔解曲线分析检测体系检测结果比Sanger测序技术更容易判读。熔解曲线分析检测体系在一台实时荧光PCR仪上可在2小时内同步检测96例临床样本,且样本DNA上样后无需其它人工操作,对检测人员的操作要求不高。该体系的检测通量、操作简便性和临床适用性均明显优于传统Sanger测序技术。为了证实熔解曲线分析检测体系检测结果的可靠性,本研究通过在本院收集的282例宫颈拭子进行了小规模的临床试验。试验结果表明实熔解曲线分析检测体系和Sanger测序技术检测结果完全一致。本次临床试验结果在一定范围内反映了珠海地区人群在IFN-αrs6475526位点和TNF-β的rs2239704、rs909253位点中的基因多态性分布情况。根据人群健康状况进行进一步分析后可以看出健康人群样本和宫颈疾病患病人群样本在这三个位点的基因型多态性中的分布情况具统计学差异性(P<0.05)。可见这三个位点的基因多态性可能和宫颈疾病的发生和发展具有特定的相关性。
综上所述,本研究证明了荧光探针熔解曲线技术在IFN-α和TNF-β基因多态性检测中临床应用的可行性,为细胞因子基因多态性的临床检测增加了一种准确且高效的临床检测方法。所建立的荧光探针熔解曲线检测体系具备很好的设计弹性,通过改变引物和探针序列即可检测其它基因多态性位点,有望能够在细胞因子基因多态性的临床检测中广泛应用。

