脂质体注射剂的应用现状及其发展趋势
项心妍,杜 爽,丁 杨*,周建平**
(1中国药科大学药学院药剂系,南京211198;2南京圣和药业股份有限公司,南京211135)
纳米脂质体是第1 个被成功应用于临床的纳米药物递送系统,它是由天然无毒的磷脂和胆固醇等脂质分子通过有序排列形成的含有水性核心和脂质双层的球型囊泡。1965 年,Alec Bangham首次将脂质体作为研究生物膜的模型提出,而后因其具有粒径可塑、生物相容性好、毒性和免疫原性低等优点,以及可负载亲水性和疏水性药物的能力,脂质体从最初的人造细胞模型演变为如今成功应用于临床的药物递送系统,在制药领域受到越来越广泛的关注。据统计,1973 年至2015 年间FDA 受理了359 项纳米制剂产品申请(包括IND、NDA 和ANDA),其中占比最高的是脂质体(33%),其二为纳米晶(23%)[1]。现已开发出多种给药途径(如注射、口服、经皮、经鼻、经肺、眼用等)的脂质体制剂,在市售与临床研究中最常用的仍然是注射途径。本文总结了目前临床可用的脂质体注射剂所涉及的新技术与新产品,介绍了新型脂质体的研究热点(图1),并针对国内外脂质体注射剂的监管现状进行了分析。
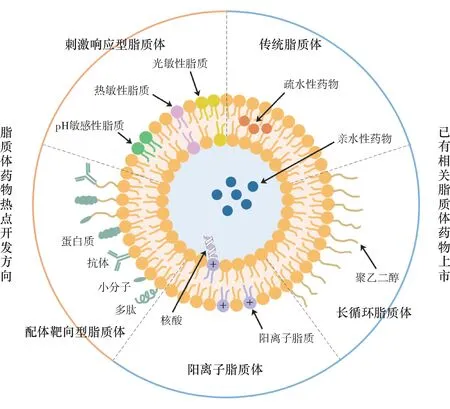
图1 脂质体的分类与结构示意
1 已有相关产品上市的新型脂质体技术
由于血浆中调理素的作用以及网状内皮系统(RES)的摄取,第1 代传统脂质体在注射后容易被快速清除,因此许多新型脂质体技术通过调节传统脂质体的脂质组成、结构、电荷等特性来改变药物的药代动力学和体内生物分布特征。目前有两种新型脂质体技术开发得较为成熟并且已有相应的产品上市,分别是Stealth 脂质体技术和阳离子脂质体技术。
1.1 Stealth脂质体技术
早期的Stealth 技术是指在传统脂质体表面掺入二硬脂酰磷脂酰乙醇胺的聚乙二醇化衍生物(DSPE-mPEG2000),使其交错重叠形成一定的空间位阻,该衍生物的高亲水性和柔韧性会干扰脂质体与血浆蛋白之间的疏水相互作用,从而减少RES 对脂质体的吸收,即发挥了隐形效果,实现脂质体在体内的长循环功能,通常该脂质体被称为长循环脂质体或隐形脂质体。此外,由于肿瘤脉管系统的渗漏性质,具有长循环特性的纳米制剂能够通过增强的渗透和滞留效应(EPR)被动地靶向肿瘤组织[2]。
运用Stealth 技术开发出了全球首个抗肿瘤脂质体产品Doxil®(阿霉素脂质体注射液),游离阿霉素的消除半衰期为0.2 h,AUC 为3.81 µg·h/mL,而Doxil®的消除半衰期可达41~70 h,AUC 为902µg·h/mL[3],同时临床研究表明它可以减少在心肌释药以降低阿霉素的心脏毒性[4]。此后,Sun 制药也使用Stealth 技术开发出了Doxil 的仿制药Lipodox®,我国也有3 款阿霉素长循环脂质体的仿制产品,分别为上海复旦张江生物医药股份有限公司的里葆多、石药控股集团有限公司的多美素和常州金远药业制造有限公司的立幸。顺铂和奥沙利铂等铂类药物也利用Stealth 技术开发出了一系列处于临床试验不同阶段的长循环脂质体制剂,例如顺铂脂质体Lipoplatin、SPI-077、LiPlaCis;奥沙利铂脂质体Lipoxal、MBP-426;L-NDDP(奥沙利铂脂溶性衍生物)脂质体Aroplatin 等,以上脂质体的处方中都含有不同比例的DSPE-mPEG2000,可不同程度地延长循环时间并降低铂类药物的全身毒性。顺铂脂质体Lipoplatin的循环时间比游离药物高20 倍,双分子层中的阴离子脂质DPPG 促进脂质体通过细胞内吞或直接与细胞膜融合而内化,并克服跨膜转移引起的耐药性,而另一种顺铂脂质体SPI-077 无法跨膜,需要经脂肪酶降解磷脂双分子层后才可释药,药物难以释放导致临床疗效有限[5]。还有在临床阶段的喜树碱脂质体SCKD602,将喜树碱半合成类似物CKD602 装载于长循环脂质体中,使得AUC 增加50 倍,治疗指数提高3~10 倍[6],此外越来越多的药物通过Stealth技术制成长循环脂质体,有效地改善了药物的疗效。
然而现在有一些研究报道了PEG 化脂质体存在“加速血液清除”(ABC)现象,对同一受试者多次注射PEG 化脂质体后,它会与脾脏产生的抗PEG IgM 抗体结合激活补体系统,被补体C3 片段快速调理后由Kupffer 细胞从体循环中清除[7]。目前已提出了几种减弱ABC 现象的方法,比如使用聚甘油、聚乙烯醇、聚乙烯吡咯烷酮或聚丙烯酰胺等聚合物替代PEG,结构的改变可以减少聚合物对脾脏B 细胞的刺激[8];将具有免疫抑制作用的神经节苷脂插入PEG 化脂质体,使反应性B 细胞产生耐受性而减少抗PEG IgM 抗体产生[9];临床上还可以改变给药方案,先服用较高剂量的空白脂质体并延长给药间隔[10]。此外,PEG 化脂质体也会通过激活补体系统而释放C5a 和C3a 等过敏毒素,从而激活巨噬细胞、嗜碱性粒细胞和肥大细胞分泌各种过敏原,引发“补体激活相关的假性过敏反应(CARPA)”,导致一列心肺反应。有研究表明可以使用补体抑制调节因子FH 或使用空白PEG 化脂质体消耗超敏反应的早期介体,中断信号传导从而减轻CARPA反应[11]。Stealth技术的出现改善了传统脂质体的稳定性和有效性,提高了脂质体药物的临床转化率,但长循环脂质体显示出的一些安全性问题仍需要进一步的研究。
1.2 阳离子脂质体技术
随着脂质体技术的不断发展,研究者们致力于开发新型的合成脂质以提高脂质体的载药能力,于是阳离子脂质应运而生,用于有效装载带负电的药物,尤其是对于核酸药物的递送备受关注。常用的永久带电的阳离子脂质有3类:单价阳离子脂质DOTAP、DOTMA、DIMRIE 和DOTIM,多价阳离子脂质DOGS 和DOSPA,阳离子胆固醇衍生物DC-Chol 和BGTC(图2)。阳离子脂质一般由带正电的头基通过连接键(如酰胺键、酯键和醚键)与疏水尾基(胆固醇或脂肪链)相连组成,其结构是决定细胞毒性和转染效率的重要因素。
永久带电的阳离子脂质的缺陷在于它会通过激活Toll 样受体4(TLR4),刺激产生炎性因子IL-6和TNF-α,从而引发免疫反应。目前的解决方法是着力于开发不饱和的可电离的阳离子脂质,将可质子化的胺基作为头基,用不饱和酰基链提高转染效率[12]。第1 代pKa为6.5 的可电离阳离子脂质1,2-二羟基-3-二甲基氨基丙烷(DLin-DMA)在pH 4 条件中带正电可有效封装带负电的药物,静脉注射后在pH 7.4的生理条件下接近中性可防止与血清蛋白的非特异性相互作用并改善循环时间,通过吸附内源性载脂蛋白E(ApoE)触发肝细胞表面受体的摄取,经内吞作用进入肝细胞,在细胞内体酸性环境中质子化并与带负电的内源性脂质相互作用导致内体膜失稳从而逃逸至细胞质。在DLin-DMA 的基础上,修改长度和不饱和度得到了许多可用的阳离子脂质(图3),其中二油甲基-4-二甲基氨基丁酸酯(Dlin-MC3-DMA,简称MC3)是目前用来递送siRNA 最有效的脂质,载体的进一步优化可通过掺入内体逃逸促进剂(如pH 敏感的聚合物或肽)或设计更安全有效的可电离脂质来实现。
全球首个siRNA 药物Onpattro®(Patisiran 阳离子脂质体注射液)于2018年获批上市,这也是首个用于治疗转甲状腺素蛋白淀粉样变性(hATTR)引起的神经损伤的药物,这款药物中使用的关键脂质即为可电离阳离子脂质MC3。此外,也有许多阳离子脂质体药物进入临床试验,如递送纺锤体驱动蛋白(KSP)-siRNA 和血管内皮生长因子(VEGF)-siRNA 的ALN-VSP02脂质体,递送分化簇31(CD31)-siRNA 和血管生成素(TIE-2)-siRNA 的AtuPLEX 脂 质体[13],以及MediGene 公 司 的Endo TAG-1(紫杉醇阳离子脂质体)和石药控股集团有限公司的紫杉醇阳离子脂质体。
由于肝脏不连续脉管系统的内在蓄积,阳离子脂质体已被证明可有效治疗肝脏相关疾病(如hATTR 和脂质代谢疾病),而对于肝外递送,靶向配体的修饰是较有希望的研究方向。Chen 等[14]用阳离子脂质体包载低氧诱导因子1α(HIF1α)-siRNA,通过掺入叶酸/油酸-二酰化低聚壳聚糖实现叶酸配体的修饰,免疫印迹实验和凋亡测试表明此脂质体显著减少了HIF1α 相关蛋白的产生并诱导了耐缺氧黑色素瘤细胞的凋亡,显著增强了HIF1αsiRNA 的抗黑色素瘤活性。此外,核酸与化药的共递送系统也是目前的研究热点,比如Wang 等[15]将一线化疗药物吉西他滨和骨髓细胞白血病蛋白1(Mcl-1)-siRNA 共载于阳离子脂质体,结果显示出协同增强的抗肿瘤作用并克服了吉西他滨的耐药性。阳离子脂质体技术的发展对核酸药物的开发意义重大,可以展望今后若能对患者转录组进行测序,基于RNA疗法的个性化医学指日可待。
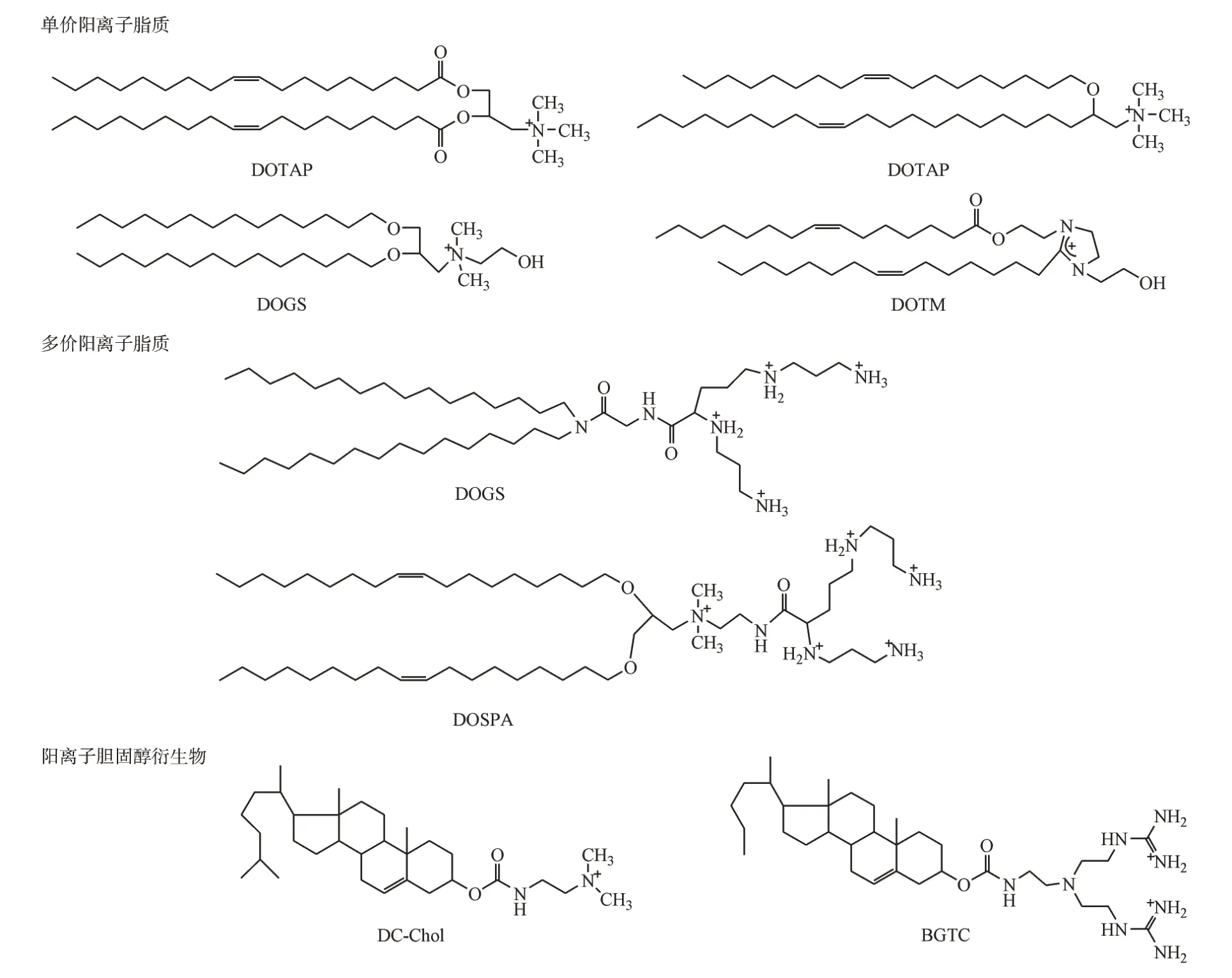
图2 阳离子脂质的分类
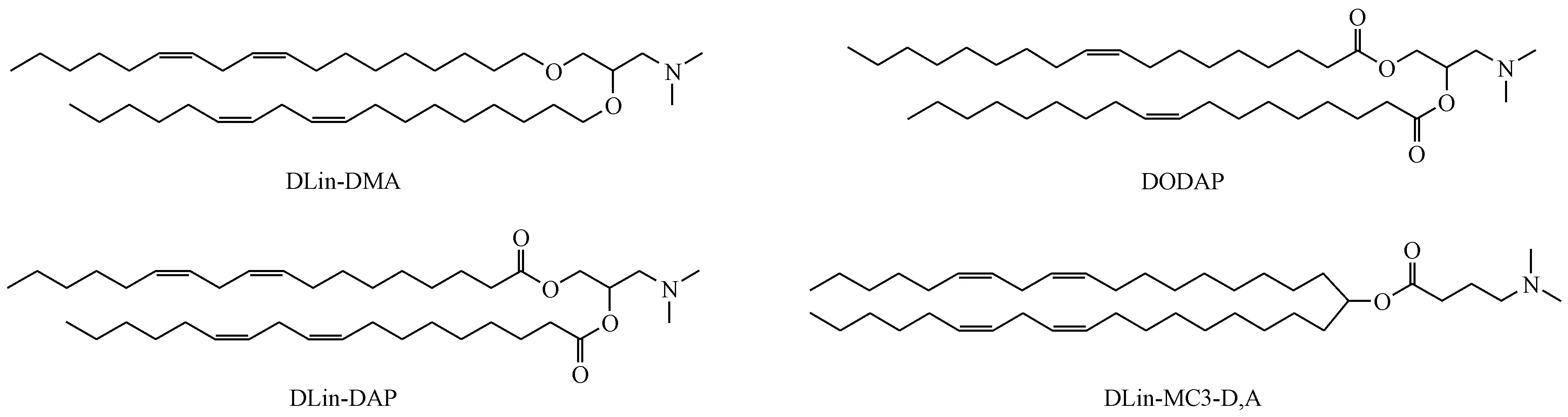
图3 可电离阳离子脂质的结构
2 已上市脂质体注射剂的制剂学分析
表1列举了国内外获批上市的脂质体注射剂,目前大多仍是传统脂质体,长循环脂质体和阳离子脂质体仅占少数。脂质体注射剂主要应用于抗肿瘤、抗真菌和镇痛等领域,每一款产品都根据药物不同的性质并通过独特的手段改善了药物的治疗效果。
2.1 载化学药物的脂质体
2.1.1 亲水性化学药物脂质体 盐酸阿霉素脂质体Doxil®是最经典的水溶性抗肿瘤化药脂质体,脂质组成为高相变温度的HSPC、胆固醇和DSPEPEG,物质的量比为56.4∶38.3∶5.3,由于HSPC 和胆固醇的最佳比例,在小于等于37 ℃时脂质体可以形成柔性双层以保留更多的药物,DSPE 掺入脂质体双层中,亲水性PEG 长链用于延长脂质体的体内循环时间。制备时使用硫酸铵梯度法实现主动载药,阿霉素在亲水内核中与硫酸根离子结合形成晶状硫酸盐沉淀,包封率可达97%左右,并且药物不易泄漏[16]。阿霉素隐形脂质体的成功开发有效地降低了游离阿霉素的心脏毒性,多款仿制产品相继上市,但临床应用情况表明PEG 化脂质体较长的循环时间导致阿霉素的皮肤毒性蓄积,患者用药后发生手足综合征(HFS)的概率大幅增加,于是改良的非PEG 化的阿霉素柠檬酸盐脂质体Myocet®面世,与环磷酰胺联合用于成年女性转移性乳腺癌的一线治疗。该产品由阿霉素冻干粉、空白脂质体分散液和缓冲液组成,使用时需现配现用,通过pH 梯度法主动载药,包封率可达99%左右,粒径(150~250 nm)较大,进入体内后迅速被单核吞噬细胞系统(MPS)识别与捕获,随后形成储库缓慢释药,半衰期为2~3 h,不具有被动靶向肿瘤的能力[16]。
另一个蒽环类药物是柔红霉素柠檬酸盐脂质体DaunoXome®,也通过梯度法载药,处方中的DSPC 与胆固醇赋予其结构较强的物理刚性,改善了柔红霉素易代谢的不稳定性并将其与血清蛋白的结合最小化,较小的粒径(45 nm)降低RES 对它的摄取,使药物的半衰期从0.77 h 延长至4~5.6 h,AUC变为传统柔红霉素制剂的11~12倍[17]。
阿糖胞苷脂质体DepoCyt®通过DepoFoamTM技术将药物封装在多囊脂质体中,运用该技术的要求是制剂处方中需要包含甘油三酯成分并利用二次乳化法制备,形成了由多个无同心内部水室组成的蜂窝状球形脂质体结构,每个水室由双层膜隔开使其从外向里逐层缓慢释药,给药间隔从2日1 次延长至2 周1 次。此外,应用于镇痛领域的硫酸吗啡脂质体DepoDur®和布比卡因脂质体Exparel®也通过DepoFoamTM技术分别延长其镇痛效果至48 和72 h[18],减少了注射次数,极大地改善了患者的顺应性。
阿糖胞苷和柔红霉素的复方脂质体Vyxeos®通过梯度载药法以5∶1 的物质的量比共囊化这两种药物,粒径约为100 nm。这种复方脂质体是肿瘤化疗领域中的一大突破,在急性髓系白血病(AML)的治疗中可实现最大程度的协同作用,成为首款针对特定高风险的AML患者群体获批的药物,接受此复方脂质体治疗的患者中位总生存期为9.56个月,而对照组(接受阿糖胞苷和柔红霉素普通制剂的直接治疗)为5.95个月[19]。
长春新碱是细胞周期阶段特异性化疗药物,长时间在肿瘤部位暴露有效浓度阈值以上对于其治疗效果至关重要。长春新碱脂质体Marqibo®使用了特制空白脂质体OptisomeTM,它由鞘磷脂和胆固醇(物质的量比,58∶42)构成,粒径约为100 nm,该制剂改善了游离长春新碱治疗窗窄、血浆清除率快的问题,实现了将药物安全剂量提高至2倍并渗漏至肿瘤部位缓慢释放的功能[20]。
伊立替康是天然生物碱喜树碱的水溶性半合成类似物,其化学结构在酸性条件下为具有抗肿瘤活性的内酯形式,而在生理条件下为无活性的羧酸盐形式。伊立替康脂质体Onivyde®利用蔗糖八硫酸盐使药物在水相中呈胶凝状态或沉淀状态而被稳定包载,药脂比高达800 g 药物每物质的量磷脂,半衰期长达56.8 h[6]。Onivyde®联合氟尿嘧啶与甲酰四氢叶酸已被FDA 批准用于治疗吉西他滨疗效不佳的转移性胰腺癌患者。
2.1.2 疏水性化学药物脂质体 力扑素(紫杉醇脂质体注射液)是国内外第1个上市的紫杉醇脂质体产品,通过薄膜分散法和冷冻技术制备,使用脂质体载药而避免使用聚氧乙烯蓖麻油和无水乙醇复合溶媒,成功解决了紫杉醇溶解度低、毒性大以及溶质引起超敏反应这三大问题[21]。此外,有2款临床阶段的紫杉醇脂质体注射液也备受瞩目,临床Ⅲ期的紫杉醇脂质体EndoTAG-1 中含有阳离子脂质DOTAP 和中性脂质DOPC,该阳离子脂质体与肿瘤生长所需的带负电荷的新生血管内皮细胞相互作用而不影响正常组织,临床研究显示它与吉西他滨联用可提高胰腺癌患者的存活率[6]。临床Ⅱ期的紫杉醇脂质体LEP-ETU 中含有关键成分心磷脂,它能与亲脂性的紫杉醇剧烈作用,将其稳定地嵌在脂质体磷脂膜中,从而提高载药效率和稳定性。
注射用两性霉素B 脂质体冻干粉Ambisome®是全球首款脂质体药物,利用负电磷脂DSPG 与药物结构中带正电的海藻糖胺结合将其稳定装载于双分子膜上,使其在体内缓慢释放,有效降低药物的肾毒性[22]。两性霉素B 脂质体Amphotec®是由胆固醇的天然代谢产物胆固醇硫酸钠与两性霉素B形成的热力学稳定的胶体复合物,两者物质的量比为1∶1,脂质体粒径小于100 nm,两性霉素B 与胆固醇硫酸钠强烈的相互作用减少了循环中游离的两性霉素B从而显著降低了肾毒性,国内上市的锋克松(注射用两性霉素B 脂质体冻干粉)为Amphotec®的仿制产品,对真菌感染的应答率比普通制剂更高。
2.2 载生物药物的脂质体
2.2.1 核酸脂质体 随着全基因组测序的进步以及完整核苷酸序列数据库的建立,核酸药物的研发愈发受人们关注,有希望通过抑制起始基因的表达对抗当前无法治愈的疾病,但核酸所涉及的沉默效率、脱靶、稳定性和递送载体方面仍是技术难题,尤其是较大的相对分子质量(约13.5 kD)和高负电荷性质导致常用的递送技术无法适用,Onpattro®(Patisiran 阳离子脂质体注射液)的成功上市彰显了脂质体递送核酸药物的巨大潜力。通常,带负电的核酸容易与永久带正电的脂质形成静电复合物而封装进脂质体,但是这种带正电的系统因免疫活化和细胞毒性作用在体内诱导出明显的毒性,因此Alnylam 公司开发了胺基阳离子脂质DLin-DMA,通过其pH 敏感的可电离特性降低毒性。处方进一步的优化过程中发现siRNA 基因沉默效率与阳离子脂质的pKa及其对ApoE 的吸附能力密切相关,其最佳pKa约为6.4,最终开发出阳离子脂质MC3,制成的脂质体基因沉默效率比用DLinDMA 的高两个数量级以上[12]。此外,PEG 化脂质的类型会影响脂质体的大小及其与靶细胞膜的相互作用,因此选用具有相对短的C14酰基链的PEG 化脂质以达到最佳的转染效果,同时加入中性脂质DSPC 与胆固醇提高脂质体的结构稳定性,于是Onpattro 的最终脂质组成为MC3、DSPC、PEG2000-C-DMG 和 胆 固 醇,质 量 比 为13∶3.3∶1.6∶6.2[23]。
2.2.2 多肽脂质体 首个治疗非转移性骨肉瘤的药物Mepact®(米伐木肽脂质体冻干粉)是粒径小于100 nm 的多层脂质体,米伐木肽由胞壁酰三肽(MTP)与二棕榈酰磷脂酰乙醇胺(DPPE)复合而成,磷脂的加入提高了MTP 的亲脂性并有助于将其掺入脂质体,疗效优于胞壁酰二肽(MDP)脂质体,这是多肽药物二次开发的成功案例。
2.2.3 疫苗脂质体 在疫苗领域,Epaxal®(甲肝疫苗脂质体)是第1 个上市的脂质体疫苗,基于病毒体技术平台Virosome 将甲肝病毒糖蛋白嵌插在磷脂双分子层上,疫苗株RG-SB 结合在脂质体表面,粒径约150 nm,处方中不含有铝盐和硫柳汞作为佐剂,因此耐受性较高、注射部位疼痛感及不良反应较小,免疫效果长达20 年[6]。Inflexal V®(流感疫苗脂质体)也使用了Virosome 技术将流感病毒A和B的血凝素表面分子装载于磷脂双分子上,临床上显示出优越的免疫原性和耐受性。
3 脂质体注射剂开发的新趋势
目前脂质体注射剂的临床应用面临许多挑战,首先EPR 效应的临床异质性导致脂质体在肿瘤中的蓄积产生较大的可变性,其次肿瘤细胞外基质产生的物理屏障限制了脂质体载体从肿瘤血管周围空间的渗透,此外尽管脂质体药物在肿瘤中的蓄积明显增加,但能从载体中释放出的药物量较少,疗效受到了限制。因此为了更有效地调控脂质体药物在病灶部位的富集与释放,许多新型的脂质体被开发出来。
3.1 配体靶向型脂质体
在脂质体表面结合一些功能性配体如抗体、多肽、蛋白质和碳水化合物等,可以使脂质体被过量表达相应受体的细胞选择性地吸收,以此提高药物在病灶部位的蓄积并减少脱靶毒性从而改善治疗效果。例如许多肿瘤细胞中会过表达叶酸受体(FAR)和转铁蛋白受体(TfR),相应的配体可以与这些受体特异性结合以实现主动靶向功能。Gazzano 等[24]制备的用叶酸修饰的硝化阿霉素脂质体(LNDF)可以更有效地靶向Dox 耐药的FAR阳性/P-gp 阳性乳腺癌细胞,另外硝化阿霉素具有的线粒体定位功能使其在线粒体中蓄积,从而损害线粒体能量代谢并触发线粒体依赖性细胞凋亡。Zheng 等[25]制备了基于转铁蛋白和细胞穿透肽的双功能阿霉素脂质体(TTD),由于TfR 在血脑屏障(BBB)和神经胶质瘤细胞中过表达,在BBB模型中BCEC 细胞对TTD 的摄取量比普通阿霉素脂质体高11 倍,离体生物分布试验中TTD 在脑瘤大鼠大脑中的蓄积量显著提高,并且在肝和肾的浓度降低。
免疫脂质体(IL)是抗体或抗体片段偶联的脂质体,旨在选择性地靶向表达抗原的细胞,与抗体-药物偶联物(ADC)相比,IL 具有更大的载药量,另外它还可用于免疫测定、免疫治疗和成像。但由于不良的药代动力学和免疫原性,IL 的体内性能有限,新一代的免疫脂质体将抗体的靶标特异性与PEG 的空间稳定性相结合产生长循环的免疫脂质体[26],并且PEG 末端抗体的随机方向比脂质体双层上的抗体能更有效地促进抗原识别与结合[27]。Arabi 等[28]用抗CD44 单克隆抗体修饰长循环脂质体阿霉素(PLD),在小鼠C-26 结肠癌模型中其抑制肿瘤生长的作用明显高于普通PLD,并在心脏、肾脏等细胞中蓄积减少。MM-302 是Merrimack 公司开发的靶向HER2 阳性肿瘤细胞的脂质体药物,它将抗HER2单链抗体偶联到阿霉素脂质体的表面,MM-302 与曲妥珠单抗可以靶向HER2受体的不同结构域,在Ⅰ期临床试验中两者联用表现出在HER2 阳性乳腺癌晚期患者中的协同抗肿瘤活性,提高了患者的缓解率(12%)和无进展生存期(7.6 个月)[29],并且由于心肌细胞中HER2 的表达水平低,对阿霉素基本无摄取,临床试验中未观察到心脏毒性的不良事件[30-31]。
目前越来越多主动靶向的脂质体已被报道表现出一定的靶向性和增强的抗肿瘤活性,但临床转化过程中仍有许多问题待解决,包括疾病相关的解剖学和生理学障碍、靶标可及性、制剂稳定性和体内重复性等因素,不过不可否认的是,为了提高脂质体的应用效果主动靶向是脂质体注射剂未来发展的重要方向。
3.2 刺激响应型脂质体
大量研究报道使用特殊脂质成分或表面修饰物制备的脂质体通过外部刺激(如温度、超声、电磁和光)或内部刺激(如pH 和酶)可以控制药物在特定部位释放,实现更精准的治疗。
早期的热敏脂质体(TSL)释药完全依赖于脂质双层渗透性的增加,这是由于在加热至高于脂质混合物的平均相变温度时脂质双层可以从固体凝胶相转变为液晶相,但缺点是释药缓慢并且最多仅释放70%。Celsion 公司的ThermoDox(阿霉素热敏脂质体)是第1种可用于临床的热敏脂质体制剂,它由二棕榈酰磷脂酰胆碱(DPPC)、单硬脂酰磷脂酰胆碱(MSPC)和DSPE-PEG 组成,物质的量比为86∶10∶4,其中MSPC是溶血磷脂,在加热至相变温度时脂质双层上会形成孔隙通道而更有效地释药(如42 ℃时20 s 内可释药80%)[32]。ThermoDox与射频消融(RFA)结合用于治疗无法手术的肝细胞癌得到了较好的Ⅰ期临床数据,但在Ⅲ期HEAT试验中并未到达主要终点(PFS 改善小于33%),对试验进行失败总结和调整后目前重新进行Ⅲ期临床试验。Dicheva等[33]开发了一种载有阿霉素的阳离子热敏脂质体(CTSL)用于双重靶向肿瘤部位,结果表明CTSL 向肿瘤递送阿霉素的量是普通TSL递送的3 倍。另有许多研究在ThermoDox 的基础上通过改变溶血磷脂的成分与比例、改变加热方式以及利用共载药系统等更有效地提高了释药效率[34]。比如,程紫婷等[35]将紫杉醇热敏脂质体和siCOX-2 金纳米星(GNS)构建成共载药系统,利用GNS 的光热效应达到TSL 相变温度42.6 ℃后释药,并通过GNS 深入肿瘤内部的能力改善了肿瘤细胞对紫杉醇的耐药作用。
光作为触发条件的优点是可以方便地从外部修改各种参数(如曝光时间、波长、光束直径和激光强度)以适应不同的治疗需求。光敏脂质体(LSL)的触发机制有很多种,包括光聚合、光氧化、光裂解和光异构化,其中基于光氧化作用的LSL通常与光敏剂结合用于光动力疗法(PDT),通过用630~820 nm 的光照射光敏剂而产生的单线态氧可以促使缩醛磷脂乙烯基醚键进行光氧化,缩醛磷脂酰胆碱分解为脂肪醛和溶血脂质,诱导相转变从而促进膜融合和内容物释放[36-37]。Luo 等[38]制备了光敏长循环阿霉素脂质体Dox-PoP,其中不饱和磷脂二硬脂酰磷脂酰胆碱(DSPC)和光敏剂卟啉磷脂(PoP)的物质的量比为53∶2,用665 nm的近红外光照射裸鼠肿瘤组织15 min 后光照组肿瘤对Dox 的摄取量比未光照组的高6~7 倍。诺华公司开发的用于PDT 的Visudyne(维替泊芬脂质体)中含有一种合成卟啉光敏剂维替泊芬(VPF),光敏剂与磷脂混合物的物质的量比约为1∶8,注射后用692 nm 的非热性二极管激光照射可选择性地清除新生血管膜,对视网膜和脉络膜组织的损害最小化[6]。
pH 敏感性脂质体(PSL)在生理pH 7.4 时保持稳定,但在酸性环境(如肿瘤组织)中不稳定,可以将药物释放到远离跨膜外排泵的胞质溶胶中,通过防止溶酶体降解来提高药物的利用度,这种现象被称为“体内逃逸”[39],并且增加的细胞质药物浓度可能超过药物外排转运蛋白的能力,从而绕开了肿瘤中耐药性发展的主要机制[40]。PSL 通常使用pH 敏感的锥形脂质二油酰基磷脂酰乙醇胺(DOPE)和弱酸性两亲物琥珀酸胆固醇酯(CHEMS),CHEMS 可以在生理pH 条件下稳定DOPE,并在酸性pH 条件下促进膜融合。Zhao等[41]用肿瘤特异性pH 响应肽H7K(R2)2修饰的Dox-PSL可在pH 6.5时释放超过80%的Dox,在C6荷瘤裸鼠的体内抗肿瘤活性显著高于普通PLD。Chang等[42]用精氨酸-甘氨酸-天冬氨酸(RGD)肽修饰包载多西他赛的PSL,在相等时间内RGD-PSL在pH 7.4 中释药53.3%,但在pH 5.0 中释药超过80%。然而目前要解决的问题是低pH触发的药物释放可能不是肿瘤特异的,因为免疫细胞的内体和溶酶体腔也呈酸性[2]。
与光敏性脂质体类似,超声敏感性脂质体所装载的声敏剂可以在超声的作用下产生与脂质体膜反应的活性氧,破坏膜结构而释放药物。不加声敏剂时,超声作用可以在脂质双层的疏水区域形成气泡核,核变大至破坏膜结构而形成一个暂时的小孔释药。磁敏感性脂质体是将磁性纳米粒包载在脂质体的水核中,通过外部磁场将脂质体引导至目标组织或器官中。氧化还原敏感性脂质体中含有二硫键,而肿瘤细胞内生物还原剂谷胱甘肽的浓度比正常细胞高4倍多,该脂质体可以优先在肿瘤细胞内裂解二硫键释放药物。另外,肿瘤细胞中会高表达基质金属蛋白酶(MMP),酶敏感性脂质体中的MMP底物肽在肿瘤细胞中被酶解后可释放药物。此外,随着研究的深入,脂质体递药系统倾向于将配体靶向功能与刺激响应相结合以实现更高效的靶向与控释功能。Chi 等[43]设计了一种具有透明质酸(HA)亲水壳的氧化还原敏感性阳离子长循环脂质体阿霉素,其中二硫键可在肿瘤的谷胱甘肽环境中裂解而脱去PEG,HA 用于靶向CD44 过表达的骨肉瘤细胞,结果显示可以增加阿霉素在肿瘤模型内的蓄积量以及增强肿瘤抑制效果。为了满足治疗的需求,新型脂质体的种类日益增多,促进未来的脂质体递送系统趋向于智能化和个性化的精准治疗。
4 脂质体注射剂的监管现状
1990 年,全球首个脂质体注射剂Ambisome®获批上市,FDA 和EMA 开始发布关于脂质体产品NDA 和ANDA 申报要求的指导文件草案。2002 年FDA 发布了《脂质体药物工业指南》,随后于2010年发布了针对PEG 化脂质体阿霉素注射剂的产品指南,2015 年又发布了更全面的指南修订草案《脂质体药物CMC、人体药动学和生物等效性研究以及标签管理》,该指南于2018 年进一步更新与定稿。目前,FDA 已发布了针对4 种脂质体药品(两性霉素B、盐酸阿霉素、柠檬酸柔红霉素和维替泊芬)的具体产品指南,其他脂质体药品的申请可以使用2018年发布的最终指南。目前已被批准的基本上是传统脂质体或长循环脂质体制剂,但随着脂质体系统复杂性的增加,产品渗透性和靶向性机制的不同,脂质体注射剂的监管面临挑战,因此监管机构亟需根据学术与市场的引导而跟上脂质体递送系统快速发展的步伐。
我国目前还没有针对脂质体注射剂的指导文件,脂质体注射剂被归类于特殊注射剂,2019年10月,NMPA 发布了《注射剂一致性评价技术要求的征求意见稿》,里面涉及特殊注射剂的评价,随后,2019 年11 月又发布了《特殊注射剂一致性评价的征求意见稿》,可以看出国内对特殊注射剂的关注度正在不断提高。另外,随着带量采购的进行,注射用紫杉醇(白蛋白结合型)已纳入集中采购,或将会进一步带动特殊注射剂包括脂质体注射剂的迅速发展。同时,医药企业也开始将产品研发管线锚向高端制剂,促进了学术界与产业界之间的协作,有望加快注射用脂质体产品的开发速度。
5 结 语
目前已有许多注射用脂质体制剂进入市场,一定程度上改善了化疗药物的毒性以及患者的依从性。但由于脂质体技术壁垒高、质量控制难、优质原辅料欠缺、产业化设备缺乏等问题,脂质体制剂从实验室到工业化生产的转移速度仍然比较缓慢。新型的配体靶向型脂质体和刺激响应型脂质体在实验室阶段有了一定的研究进展,但肿瘤异质性问题使其临床转化率仍较低,脂质体的复杂性也给生产和监管带来了进一步的挑战。随着质量源于设计(QbD)理念、微流控技术和过程分析技术在制剂制造、放大和评估中的应用[31],脂质体的产品转化率也在不断提高,通过学术界、工业界和监管机构的努力与合作,有望将脂质体开发为安全、有效、可控以及可用于精准治疗的纳米制剂。

