扩张型心肌病患者两种治疗方法前后microRNA-126和microRNA-30a水平表达的研究
周 红,娜日罕,荣 钰,董 莉(内蒙古医科大学附属医院检验科,呼和浩特 010050)
扩张型心肌病(dilated cardiomyopathy, DCM)是以左心室或者双心室扩大伴收缩功能障碍为特征的心肌病。目前,DCM 的诊断缺乏特异度和灵敏度,易造成误诊、漏诊。因此,早期诊断、及时治疗对本病尤为重要。新发现的一种微小RNA(miRNA),可控制各种细胞的功能,如心肌细胞、内皮细胞、平滑肌细胞和成纤维细胞,调控多种心脏疾病的病理过程[1]。研究发现miRNAs 可稳定存在于血液循环中。目前研究较多的是miRNA-126 和miRNA-30a。其中,miRNA-126(也称为内皮特异性miRNA-126)在血管生成中起着重要作用,被认为是血管损伤和内皮功能障碍的预后生物标志物[2]。可以通过抑制炎症期间的血管细胞黏附分子-1 蛋白水平来防止动脉粥样硬化的发生[3]。miRNA-30的过度表达降低了胱硫醚-C-裂合酶(CSE)的表达和硫化氢(H2S)的产生,进而加重了缺氧诱导的体外心肌细胞损伤[4]。但是对于miRNA-126,miRNA-30 与DCM 的相关研究报道尚少,我们通过测定40 例患者不同治疗方法前后miRNA-126 和miRNA-30a 含量的变化,分析其与其它临床资料的相关性,探讨其是否可作为DCM的诊断、疗效指标。
1 材料与方法
1.1 研究对象 随机收集2014.2 ~ 2019.3 就诊于我院心内科首诊为DCM(根据2007年《心肌病诊断与治疗建议》)且心功能IV 级(根据NYHA 分级)的患者,男性23 例,女性17 例,年龄55±13岁。收集同期来我院体检中心的健康体检者20 例为对照组,男性10 例,女性10 例,年龄53±10 岁。所有入组对象均签署知情同意书。本实验已获得医院伦理委员会批准。对40 例患者均进行β-受体阻剂、利尿剂、醛固酮受体拮抗剂,血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)等常规一般治疗[5]。随后按患者在常规一般治疗的基础上是否自愿接受自体骨髓单个核细胞移植治疗(由内蒙古医科大学附属医院心内科医生完成操作),分为一般治疗组20 例,手术治疗组20 例。进行历时1年的规律治疗,1年后收集两组患者血清。
1.2 仪器及试剂 miRcute 血清miRNA 提取分离试剂盒,PCR 试剂盒均采用天根生化科技(北京)有限公司产品。引物序列为miRNA-126:CAUUAUUACUUUUGGUACGCG;miRNA-30a:UGUAAACAUCCUCGACUGGAAG。
1.3 实验方法
1.3.1 标本采集:患者组和对照组均采集空腹血3ml,在4h 内进行离心(3 000r/min,10min),取血清置于-80℃冰箱冷藏备用。
1.3.2 miRNA 表达量检测:采用qRT-PCR 法检测血清中miRNA-126,miRNA-30a 的相对含量,使用 2-△△Ct值来表示基因表达的相对量。△Ct =Ct目的基因-Ct内参基因。
1.4 统计学分析 所有数据使用SPSS22.0 软件进行统计分析,计量资料采用均数(标准差)或中位数(四分位间距)表示。各组间比较使用ann-Whitney U 秩和检验。偏态分布数据相关性采用Spearman 相关性分析,P <0.05 为差异有统计学意义。
2 结果
由于各种原因导致随访病人失访,最终一般治疗组14 例、手术治疗组12 例完成1年随访工作。对研究对象的年龄、性别、家族史、高血压、糖尿病等一般基本情况进行分析,差异均无统计学意义;射血分数、NT-proBNP 及心胸比等差异有统计学意义。
2.1 循 环miRNA-126,miRNA-30a 在DCM 患 者两种方法治疗后疗效的判断 见表1,表2。手术组治疗前后两种miRNA 差异均有统计学意义(均Z = -3.059,P=0.002),一般治疗前后差异无统计学意义(Z = -1.538,P=0.124;Z = -1.726,P=0.084)。说明自体细胞移植加一般治疗疗效较单纯一般治疗影响较大。

表1 两种方法治疗前后miRNA 表达量的比较
2.2 相关性分析 循环miRNA-126 与NT-proBNP呈负相关(r = - 0.355,P=0.013)。循环miRNA-30a与NT-proBNP 呈正相关(r = 0.306,P =0.034),与射血分数呈负相关(r = - 0.333 ,P =0.019)。
2.3 DCM 患者miRNA12 个月预后 COX 回归分析 见表3。对DCM 患者12 个月预后进行生存分析,发现miRNA-126 的12 个月相对危险度为 0.768(95% CI 0.431~1.37,P =0.372),差异无统计学意义; miRNA-30a 的12 个月生存分析其相对危险度 为1.141(95% CI 0.775~1.678 ,P =0.504),差异无统计学意义。
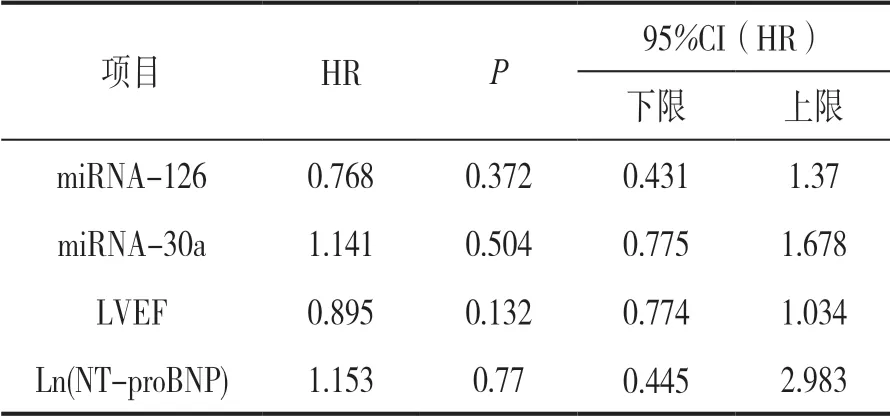
表3 患者miRNA 12 个月预后 COX 回归分析
3 讨论
DCM 病因多样,可能因感染、中毒、内分泌紊乱、遗传等因素。其中,RNA 家族中的小核糖核酸病毒直接侵袭和由此引发的慢性炎症和免疫反应是造成心肌损害的机制;有研究证明DCM 患者具有内皮功能障碍,其特征是内皮祖细胞集落形成单位减少(EPC-CFUS)并降低了血流介导的血管舒张(FMD)[6]。而骨髓来源的人骨髓间充质干细胞(MSCS)具有抗纤维化、促进血管生成和免疫调节的特性,可促进受损组织的修复。就此,我们通过骨髓间充质干细胞移植,研究是否可以增加内皮祖细胞集落形成单位,从而达到在源头上改变内皮功能,最终修复心肌损伤。这也是本实验的依据。
首先,miRNA-126 是抗凋亡内皮细胞的关键调控基因:①血管内皮生长因子(VEGF)可以调节内皮细胞中BCL-2 的表达,而miRNA-126 可以在多种组织中调节VEGF 的表达。因此,miRNA-126可能是调节内皮细胞BCL-2 和VEGF 表达的合适候选分子,过表达miRNA-126 可能通过下调BCL-2 和VEGF 来降低抗凋亡的内皮细胞[7]。②miRNA-126 抑制调节单位,通过RAS/ERK 和PI3K/AKT 途径调节(VEGFR-2)相关信号转导,在血管生成中起重要作用:具体为通过调节上述途径的信号来增强VEGFR-2 下游的血管生成信号[8]。③miRNA-126 在基因水平调节内皮细胞增殖与新生血管的形成过程中,还会通过激活PI3K / Akt /eNOS 信号通路增强了间充质干细胞外泌体(MSCEX)对缺氧/复氧(H/R)损伤的内皮细胞(EC)增殖,迁移和血管形成的有益作用,并且更有效地抑制了H/R 诱导的与下调caspase-3 相关的EC 凋亡。④miRNA-126 进一步促进了MSC-EXs 在提高受H/ R 损伤的EC 中细胞生长因子(FGF,bFGF)和血管生成因子(PDGF,VEGF)水平方面的作用[9]。
miRNA-30a 来源于miRNA-30 家族,其家族调控一种与纤维化有关的关键分子-结缔组织生长因子(CTGF)[10]。在体外实验中,设计过表达或抑制这些小RNA 可以通过直接与CTGF mRNA 的3′UTR 区相互作用有效抑制CTGF 的表达,从而参与调节心肌纤维化。①miRNA-30a 与心脏关系密切(已有研究表明)[11],可能有利于鉴定AMI。②根据YUAN 等人[12]的研究结果,miRNA-30a 抑制心肌成纤维细胞中snail 1 的表达,进而通过一些未知的机制导致骨膜蛋白表达下调。③miRNA-30a 的过度表达导致snail 1 蛋白表达下调,这是由于miRNA -30a 增强了snail1 蛋白的翻译抑制作用,从而使snail1 蛋白表达水平的降低导致骨膜蛋白的去除和纤维化的发生。④miRNA-30a 具有抗凋亡作用,其在细胞自噬中发挥作用,自噬在缺血时保护心肌细胞,而在再灌注过程中是有害的。Beclin-1 蛋白是细胞自噬的重要标志。HUANG等[13]人的研究结果表明miRNA-30a 在血管紧张素II(Ang Ⅱ)损伤过程中通过调节Beclin-1 蛋白发挥重要作用,因此通过调节miRNA-30a 的表达将自噬控制在一个有益的阈值以下成为可能,以保护心肌细胞免受Ang Ⅱ的损伤。由此,我们联合检测miRNA-30a 与miRNA-126,通过对不同方法治疗前后的变化情况分析其对疾病治疗的意义。
DCM 的治疗大多使用内科一般药物治疗方法,这些一般都试图降低心肌损伤的发生率,但是缺乏再生潜能。自体细胞移植可以有效地从根本上改变心肌损伤。①骨髓来源的人骨髓间充质干细胞(MSCS)具有抗纤维化、促进血管生成和免疫调节的特性,可促进受损组织的修复。②MSCS 改善DCM 患者心功能的机制包括内皮功能的恢复,内皮功能可促进冠脉循环[6,14]。③可能通过分泌心脏保护因子发挥旁分泌作用。这些分泌因子可能刺激血管生长和重塑,减弱纤维化,调节炎症,调节细胞分化和存活,并招募常驻干细胞或祖细胞[15]。从而产生新的细胞,具有再生能力,从根本上治疗DCM。通过两种治疗方法后miRNA-30a 和miRNA-126 表达量的分析,发现自体细胞移植组较单纯内科一般药物治疗组治疗DCM 患者影响更大,与文献报道一致。但因入组的人数较少,样本量小,缺乏普遍性,有待于继续扩大病例量。
DCM 患 者miRNA-126 和miRNA-30a 与正常对照组比较无显著性差异,不能作为DCM(NYHA分级IV 级)的诊断指标。可能与文献报道[16]DCM与BAG3(B 细胞淋巴瘤2 相关的致癌基因3)中的错义变体有关。是否由于DCM 病因的多样性与基因的错义变体相关,导致miRNA 生成受到影响,从而无法准确测量其真实表达量,我们尚且不能得出结论。但就目标基因与DCM 乃至于心衰诊断指标的相关性方面,我们发现,miRNA-126 与NT-proBNP 呈 负相关,miRNA-30a 与NT-proBNP呈正相关,miRNA-30a 与LVEF 呈负相关。其中,miRNA-126 与NT-proBNP 呈负相关的结果与WEI等[3]人做的实验结果相同,因此可以尝试联合诊断。
我们分析了miRNA-126 和miRNA-30a 是否与DCM(心功能IV 期)患者预后相关,在评估预后的方面是否有着一定的临床价值。对DCM 患者12个月预后进行生存分析,未发现统计学意义。由此可知miRNA-126 和miRNA-30a 并非DCM(心功能IV 期)患者1年内发生主要不良心脏事件的独立危险因子。
综上所述,miRNA-30a 和miRNA-126 检测可用于DCM 病人疗效观察,并可能为其提供有效的基因学依据。

