急性缺血性脑卒中动脉通畅性恶化的相关因素及预后
付胜奇,张淑玲,张杰文,宋良,李浩然,张洪涛
急性缺血性脑卒中(AIS)患者的症状性动脉闭塞患病率为22%~46%,且与预后不良有关[1-2]。血管闭塞是一个动态过程,狭窄或闭塞血管可以再通,包括自发再通[3]、静脉溶栓(IVT)[4]和血管内治疗(EVT)[5]。无论是自发还是治疗后再通患者,其血栓增加或新的闭塞均可导致动脉张力变化[6],因此急性期治疗后部分或完全再通的患者可再次出现新的闭塞或狭窄,发生率为2%~41%[7]。动脉通畅性恶化(APD)指与基线血管情况比较,出现了新的颅内或颅外动脉闭塞和狭窄。目前尚无研究单独描述APD的相关因素、预后及与血运重建治疗的关系,因此本研究评估AIS患者入院24 h APD的发生率、相关因素及对预后的影响,以期帮助临床医生制定更有针对性的预防策略。
1 对象与方法
1.1 对象 系2010年1月至2019年3月入住郑州人民医院神经内科卒中单元或神经重症监护室的AIS患者778例,男454例,女324例;中位年龄73岁;病程均≤24 h。纳入标准:(1)发病24 h内行头颅MRI检查;(2)入院48 h内进行第2次MRA,用以评估血管通畅情况。排除标准:(1)年龄≥80岁;(2)发病前mRS≥3分;(3)合并严重全身疾病。
1.2 方法
1.2.1 一般资料收集 于入院后登记入组者的一般情况,包括人口统计学、病史、心脑血管系统高危因素、当前服药情况、临床症状和体征、院前和门诊到院治疗时间、入院时和24 h的NIHSS评分、生命体征、血液检验结果、急性期治疗情况以及3个月、12个月的mRS评分。所有患者于入院时根据医院标准进行急性血运重建治疗(IVT或EVT),并采用TOAST病因分型将患者分为大动脉粥样硬化型(LAA)、心源性栓塞型(CE)、小血管闭塞型(SVO)、其他明确病因型卒中(SOE)、不明病因型卒中(SUE)。
1.2.2 影像学检查 于入院及入院24 h行头颅MRI检查评价患者血管狭窄/闭塞及再通情况,血管检查包括MRA及增强MRA(CEMRA)。存在MRI检查禁忌证或其他原因未能行MRI检查者行头颅CT及CTA检查。血管闭塞定义为初次血管成像检查时动脉段信号缺失和远端血流信号缺失。颅外动脉显著狭窄定义为颈动脉内径狭窄≥70%,椎动脉内径狭窄≥50%[8];颅内动脉显著狭窄定义为动脉内径狭窄≥50%[9]。APD定义为与入院时比较,入院24 h时任何颅内或颅外动脉出现新的闭塞和狭窄。入院时同一动脉狭窄程度由低到高的进展不被认为是APD;基线检查时同一动脉已经存在的狭窄或闭塞延伸至新动脉段或在血管内治疗过程中医源性栓塞至先前正常区域也不考虑为APD。根据检查情况将患者分为APD组及非APD组。在DWI序列下采用Alberta卒中项目早期CT(ASPECT)评分评估大脑中动脉(MCA)区域卒中患者缺血性改变,采用后循环ASPECT评分评估后循环卒中患者。采用血栓负荷评分(CBS)评价前循环卒中患者的血栓程度和范围[10]。临床症状恶化者复查头颅MRI。影像学评估由两名以上经验丰富的神经放射学医师进行。研究中对存在颈内动脉、MCA M1段或M2段近端狭窄或闭塞且行CTA检查患者的侧支循环采用基于CTA的Tan侧支循环评分进行评估:0分,无侧支代偿;1分,软脑膜动脉侧支填充≤50%;2分,侧支填充>50%;3分,侧支填充达100%。0~1分为侧支循环较差,2分为侧支循环中等,3分为侧支循环良好[10]。此外,本研究对进行侧支循环评估患者的一般人口学资料及血管病危险因素进行比较分析,即一致性检验证实两组患者具有可比性。
1.2.3 结局指标评价 于入院时和入院24 h采用NIHSS评分评估患者神经功能,早期神经功能恶化定义为入院24 h较入院时NIHSS评分增加≥4分。采用WHO制定的复发性卒中标准记录患者入院48 h的早期缺血性卒中复发率。采用卒中门诊或电话进行随访,于3个月和12个月采用mRS评分评估患者预后,≤2分为预后良好,>2分为预后不良,6分为死亡,并记录第7 d、3个月、12个月患者的死亡率。

2 结 果
2.1 APD组及非APD组临床资料的比较 见表1、表2、表3。根据MRI检查结果将患者分为APD组26例及非APD组752例。与非APD组比较,APD组年龄、3个月mRS评分及高血压病史、入院前使用降压药、入院前使用降脂药、脑白质疏松的比率显著降低,入院及24 h NIHSS评分、12个月mRS评分及意识水平下降、颅内动脉狭窄、颅外动脉狭窄和侧支循环状态良好的比率显著升高(均P<0.05)。两组间TOAST分型的SOE及SUE差异有统计学意义(P=0.000,P=0.028)。
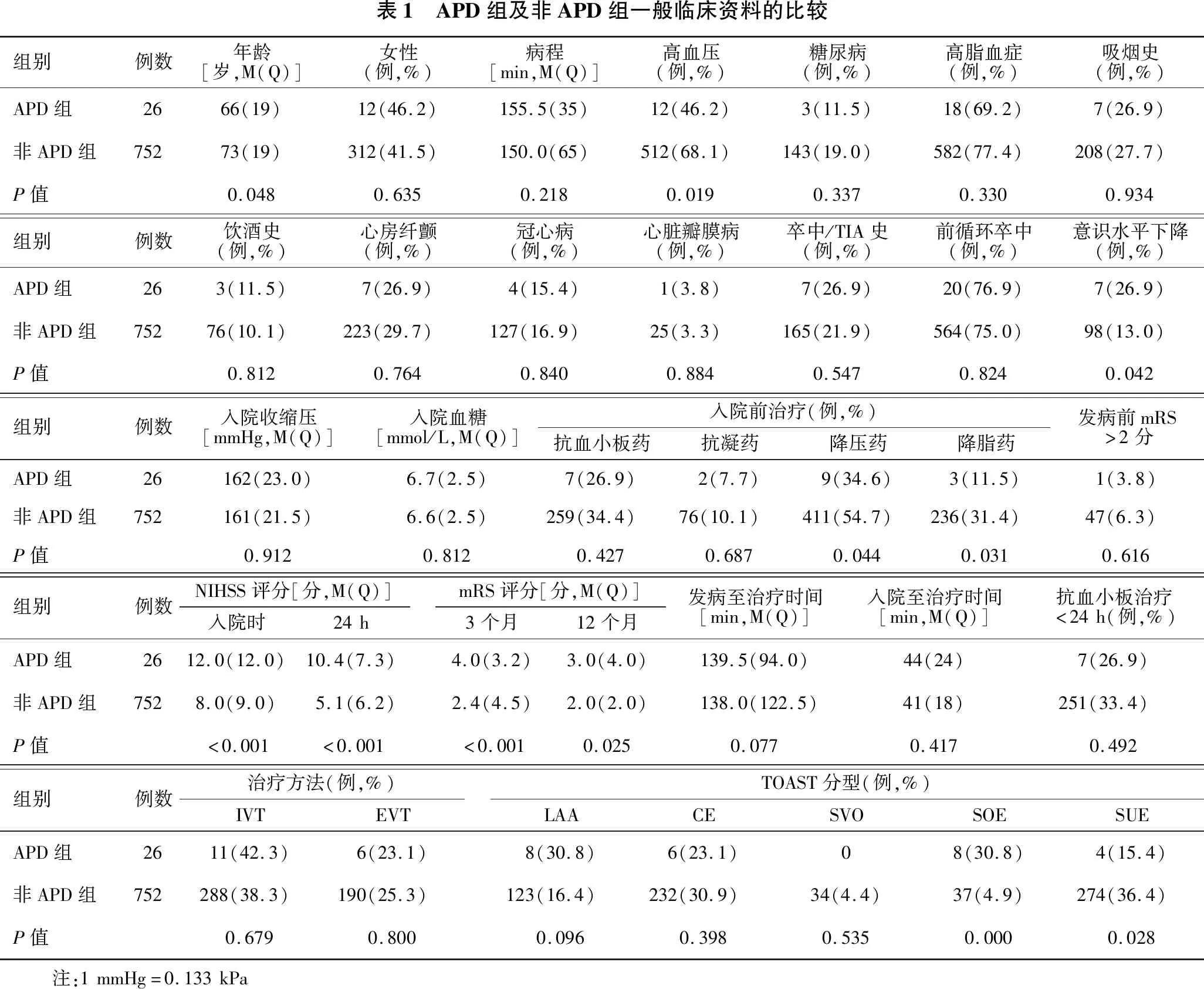
表1 APD组及非APD组一般临床资料的比较组别例数年龄[岁,M(Q)]女性(例,%)病程[min,M(Q)]高血压(例,%)糖尿病(例,%)高脂血症(例,%)吸烟史(例,%)APD组2666(19)12(46.2)155.5(35)12(46.2)3(11.5)18(69.2)7(26.9)非APD组75273(19)312(41.5)150.0(65)512(68.1)143(19.0)582(77.4)208(27.7)P值0.0480.6350.2180.0190.3370.3300.934组别例数饮酒史(例,%)心房纤颤(例,%)冠心病(例,%)心脏瓣膜病(例,%)卒中/TIA史(例,%)前循环卒中(例,%)意识水平下降(例,%)APD组263(11.5)7(26.9)4(15.4)1(3.8)7(26.9)20(76.9)7(26.9)非APD组75276(10.1)223(29.7)127(16.9)25(3.3)165(21.9)564(75.0)98(13.0)P值0.8120.7640.8400.8840.5470.8240.042组别例数入院收缩压[mmHg,M(Q)]入院血糖[mmol/L,M(Q)]入院前治疗(例,%)抗血小板药抗凝药降压药降脂药发病前mRS>2分APD组26162(23.0)6.7(2.5)7(26.9)2(7.7)9(34.6)3(11.5)1(3.8)非APD组752161(21.5)6.6(2.5)259(34.4)76(10.1)411(54.7)236(31.4)47(6.3)P值0.9120.8120.4270.6870.0440.0310.616组别例数NIHSS评分[分,M(Q)]入院时24hmRS评分[分,M(Q)]3个月12个月发病至治疗时间[min,M(Q)]入院至治疗时间[min,M(Q)]抗血小板治疗<24h(例,%)APD组2612.0(12.0)10.4(7.3)4.0(3.2)3.0(4.0)139.5(94.0)44(24)7(26.9)非APD组7528.0(9.0)5.1(6.2)2.4(4.5)2.0(2.0)138.0(122.5)41(18)251(33.4)P值<0.001<0.001<0.0010.0250.0770.4170.492组别例数治疗方法(例,%)IVTEVTTOAST分型(例,%)LAACESVOSOESUEAPD组2611(42.3)6(23.1)8(30.8)6(23.1)08(30.8)4(15.4)非APD组752288(38.3)190(25.3)123(16.4)232(30.9)34(4.4)37(4.9)274(36.4)P值0.6790.8000.0960.3980.5350.0000.028 注:1mmHg=0.133kPa

表2 APD组及非APD组影像学资料的比较组别例数脑白质疏松(例,%)慢性卒中病变(例,%)基线ASPECTS评分[分,M(Q)]CBS评分[分,M(Q)]颅内动脉闭塞(例,%)颅内动脉狭窄(例,%)APD组263(11.5)6(23.1)8.5(8.5)8(1)16(61.5)5(19.2)非APD组752242(32.2)209(27.8)10.0(9.5)8(2)458(60.9)39(5.2)P值0.0260.5970.2120.4620.9480.002组别例数颅外动脉闭塞(例,%)颅外动脉狭窄(例,%)侧支循环状态(例,%)较差中等良好未评估APD组266(23.1)7(26.9)5(19.2)3(11.5)7(26.9)11(42.3)非APD组752115(15.3)77(10.2)158(21.0)147(19.5)59(7.8)388(51.6)P值0.2820.0070.8260.3090.0010.352

表3 APD组及非APD组实验室检查的比较[M(Q)]组别例数肌酐(μmol/L)总胆固醇(mmol/L)C反应蛋白(mg/L)白细胞计数(109/L)血红蛋白(g/L)血小板(×109/L)APD组2683.5(23.2)5.1(0.6)2.9(3.8)8.9(3.3)139.5(17.4)226.2(33.6)非APD组75284.1(23.2)5.1(1.0)3.0(4.1)8.0(5.5)140.2(27.0)229.9(45.3)P值0.6580.5010.2020.5220.6010.592
2.2 APD相关因素的多因素分析 以APD为因变量,将单因素分析比较时P<0.05的变量作为自变量进行Logistic回归分析。结果显示,高血压病史(OR=0.46,95%CI:0.30~0.85,P=0.002)、入院NIHSS评分(OR=1.06,95%CI:1.03~1.11,P<0.001)、颅内动脉狭窄(OR=4.87,95%CI:3.02~15.21,P<0.001)、颅外动脉狭窄(OR=3.61,95%CI:1.59~6.37,P=0.011)和侧支循环状态良好(OR=3.17,95%CI:1.45~9.85,P=0.002)是APD的独立相关因素。
2.3 APD组及非APD组预后的相关性分析 见表4。与非APD组比较,APD组早期神经功能恶化、早期卒中复发比率显著升高(均P<0.001),第7 d、3个月、12个月的死亡率及3个月、12个月的预后不良率显著升高(均P<0.05)。
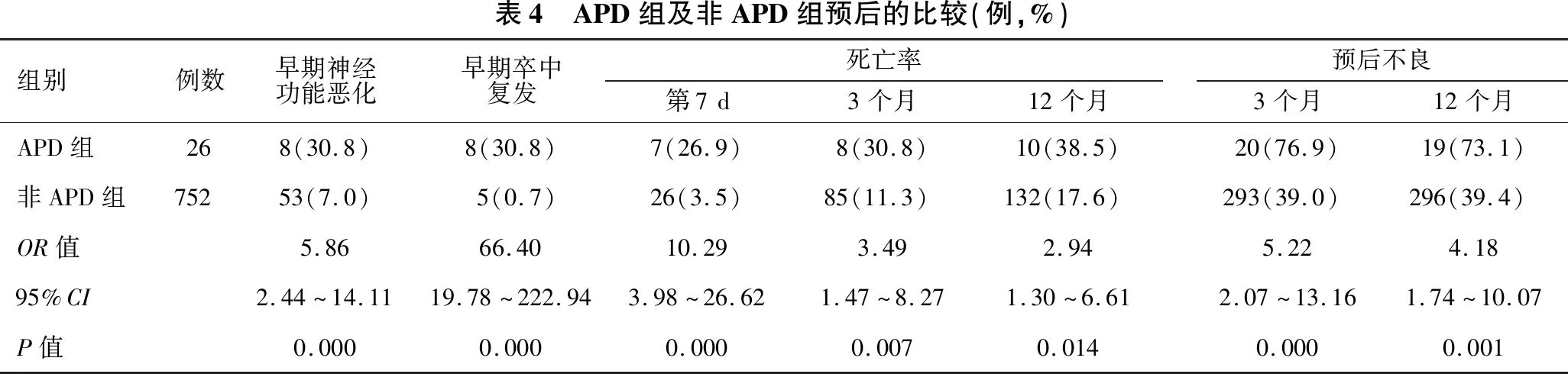
表4 APD组及非APD组预后的比较(例,%)组别例数早期神经功能恶化早期卒中复发死亡率第7d3个月12个月预后不良3个月12个月APD组268(30.8)8(30.8)7(26.9)8(30.8)10(38.5)20(76.9)19(73.1)非APD组75253(7.0)5(0.7)26(3.5)85(11.3)132(17.6)293(39.0)296(39.4)OR值5.8666.4010.293.492.945.224.1895%CI2.44~14.1119.78~222.943.98~26.621.47~8.271.30~6.612.07~13.161.74~10.07P值0.0000.0000.0000.0070.0140.0000.001
3 讨 论
AIS患者的早期动脉再通与预后良好密切相关,是其重要的决定因素。根据干预手段不同,血管再通率也不同[3]。然而无论是自发患者还是治疗后再通患者均可能由于原位血栓延长或新栓塞再次出现血管闭塞或APD[6-7]。再闭塞可以是原闭塞部位发生再次闭塞[11],也可以是远端血管的再闭塞,而远端栓塞被定义为下游血管出现血栓[12-13]。由于既往相关研究仅针对接受了急性血运重建治疗后的患者,或仅关注发生在原闭塞部位的再闭塞,未考虑治疗方式或闭塞部位,并且发病24 h内入院对3个月的预后有很强的预测作用[14-15],因此多数卒中中心选择血运重建术后24 h作为评估血管情况的标准时间点。本研究亦选择起病24 h作为评估APD的时间点。本研究通过评估接受血运重建和未接受血运重建治疗的AIS患者入院24 h APD的相关因素及对预后的影响,以期帮助临床医生早期识别容易发生APD的患者,更好地对患者采取个体化的干预措施。
既往研究证实,再灌注治疗后有相当比例的患者会发生血管再闭塞,发生率甚至高于备受关注的症状性颅内出血[16]。Marto等[7]研究发现,6.6%的血管内治疗成功再通患者在24 h内出现了血管再闭塞。荟萃分析显示,AIS再灌注治疗后血管再闭塞的发生率为2%~54%[17]。发生率差异较大的原因主要是不同研究间的研究对象、研究设计、血管再闭塞定义、影像学检查时间/手段不同。本研究3.3%的患者发生了APD,略低于上述研究,但与近期一项国外研究中3%的发生率相一致[18]。原因可能是本研究中APD仅指入院24 h时出现的新的闭塞和狭窄,排除了入院时同一动脉狭窄程度由低到高的进展及基线检查时同一动脉已经存在的狭窄或闭塞延伸至新动脉段,且排除了在血管内治疗过程中医源性栓塞至先前正常区域发生的血管闭塞或狭窄。
高血压是卒中复发的主要危险因素[19]。本研究结果显示,高血压与APD呈负相关,这可能因为慢性高血压是小血管性卒中的主要危险因素,而小血管性卒中或小血管闭塞后发生APD或血管再闭塞风险较低。小血管性卒中病变血管发生的是脂质透明样变性,不易出现血管壁损伤,诱发血栓再形成[20],因此本研究中APD组高血压病比率较低,多因素分析显示其具有保护作用。慢性高血压在其他卒中发病机制(如大动脉疾病和心房纤颤)中也具有重要作用,而LAA、CE或SOE则可能是血管再闭塞的危险因素[7,21]。周志国等[22]进行研究发现,病变部位血管粥样硬化、血管缺血再灌注损伤是机械取栓术后血管再闭塞的危险因素。因此,高血压病也可能是血管再闭塞或APD的危险因素。但目前多数研究并未发现血管再闭塞与高血压相关,因此高血压在血管再闭塞或APD中的作用需要将来大样本的研究进一步明确。
入院NIHSS评分较高是卒中预后不良的预测因素[23-24]。既往研究显示,IVT治疗患者入院NIHSS评分与血管再闭塞有关[11]。本研究结果显示,入院NIHSS评分与APD独立相关。有研究显示,入院NIHSS评分可作为近端血管闭塞和血栓负荷的替代指标,这意味着高NIHSS评分患者不完全血栓溶解率更高[25-26]。残留血栓可以作为原位血栓形成的病灶或作为动脉-动脉栓塞的来源,因此APD风险增加[11]。但本研究显示,APD与血管闭塞及血栓负荷评分无关,与Marto等[18]研究一致。血管再闭塞的核心是血小板激活、黏附及血栓形成或新发栓塞[27]。Baik等[28]认为,有未导致血管闭塞血栓的患者是血管再闭塞高危者,而血管闭塞患者可能不易反复血栓形成或发生动脉栓塞。一般来说,CBS分值越低,表明未显影血管部位越低,血栓负荷越大[29]。已有多项研究表明,血栓负荷与卒中患者的再通率及预后显著相关[26,30]。本研究评估的患者入院时的血栓负荷状态与APD无关,可能与CBS使用经验少,且在MRA环境下进行CBS评分对临床医生还存在一定挑战有关。
动脉狭窄可以导致原位血栓形成、动脉到动脉栓塞和远端低灌注[11,14],从而使APD风险升高。既往研究显示,症状性脑动脉狭窄与高复发率[31]、远端栓塞[32]和再闭塞有关[11]。本研究发现,颅内和颅外动脉狭窄是APD的独立危险因素。APD患者梗死最常见的病因为动脉粥样硬化,此外也可由其他病因或心源性栓塞引起。Marto等[7]研究发现,动脉粥样硬化是血管再闭塞的独立危险因素,另外还发现入院前服用他汀治疗、闭塞血管位置及再通后残留血栓或狭窄也是血管再闭塞的独立危险因素。作者认为,颅内动脉粥样硬化病变的不稳定性导致再闭塞风险较高,而颅外动脉病变可导致脑灌注压降低,血液瘀滞使再闭塞风险升高,因此要密切观察LAA患者的病情变化,警惕其发生APD或血管再闭塞。与Marto等[7]的研究不同,Mosimann等[21]发现TOAST分型中的SOE及SUE与成功再通后血管早期再闭塞有关,711例患者16例发生了早期血管再闭塞,其中8例为SUE,5例为SOE,3例为CE,这与本研究结果中SOE在APD中并不少见相一致。总之,LAA和SOE患者可能是APD或血管再闭塞高危人群,需密切观察。
本研究结果显示,侧支循环状态良好也与APD有关。众所周知,良好的侧支循环是AIS预后良好的预测因素[33]。良好的侧支循环与血管再狭窄[34]、新的远端血管闭塞[35]及卒中复发[36]有关。这可能因为较高的侧支血流可与顺行血流竞争灌注而造成病变部位的血流减慢,导致局部血栓形成增加。而且良好的侧支循环可能导致闭塞血管的远端血流增加,更容易将闭塞处的不稳定斑块移出,导致新的远端闭塞。
本研究结果显示,与非APD组比较,APD组早期神经功能恶化、早期卒中复发比率显著升高,第7 d、3个月、12个月的死亡率及3个月、12个月的预后不良率显著升高。3个月时的mRS评分与APD显著相关。这提示24 h APD可能影响短期及长期预后。Rubiera等[11]研究也发现,IVT治疗后发生血管再闭塞患者3个月时的转归良好率显著低于血管稳定再通者,而病死率显著高于后者。同样的,与本研究一致,Qureshi等[37]研究发现血管内治疗后再闭塞与24 h神经功能恶化相关。Saqqur等[38]指出,血管再闭塞对临床恶化和转归不良均具有高度预测价值。有研究发现,远端再闭塞不会造成患者远期的不良预后,反而预示了血管原闭塞部位的成功再通[12],但此结论目前尚无大样本数据支持。因此,鉴于APD的临床影响,快速识别其临床表现并积极预防其发生非常必要。
综上,本研究发现,入院NIHSS评分、颅内和颅外动脉狭窄及良好的侧支循环与入院24 h APD独立相关,高血压病史具有保护作用,及时发现相关因素可能有助于预防APD。但本研究是单中心研究,样本量偏小,未来本研究小组还将进一步扩大样本,进行多中心队列研究。

