乳腺癌病人静脉血栓栓塞症风险预测模型的构建
李 静,强万敏*,张方圆,李笑阳,任佳蕾
(1.天津医科大学肿瘤医院,天津300060;2.大连大学;3.天津中医药大学)
静脉血栓栓塞症(venous thromboembolism,VTE)包括深静脉血栓形成(deep vein thrombosis,DVT)和肺血栓栓塞症(pulmonary thromboembolism,PTE)两种类型,在癌症人群中的发病率为4%~20%,是非癌症人群的6~7 倍[1]。相对于胰腺、胃和肺部的恶性肿瘤,乳腺癌病人VTE 的风险较低,为0.16%~0.30%,但乳腺癌作为全球女性发病率最高的癌症,VTE 病人的绝对值和由此产生的医疗消耗是庞大的[2-3]。研究发现,发生VTE 的乳腺癌病人死亡风险增加1 倍以上,其中13%的病人会出现血栓后综合征,表现为长期疼痛、水肿和溃疡症状[4]。美国国家综合癌症网络的癌症相关性静脉血栓栓塞性疾病指南和我国预防和治疗肿瘤相关静脉血栓栓塞专家指南均认为,应用高质量的血栓风险评估工具识别高危病人,并据此采取分层预防措施可有效降低血栓的发生。目前,国际上存在多种癌症病人VTE 风险的评估模型,如通用的Caprini评分、Wells 量表和基于癌症人群开发的Khorana 模型(Khorana Score,KS)及其后来的多个修订版(CATS、PROTECHT 和CONKO 模型)。然而,目前KS 已被证实并不适用于住院乳腺癌病人[5],尚未发现其他模型在独立的乳腺癌队列进行验证的研究,因此其预测价值仍有待探讨。本研究通过系统地回顾文献和Meta 分析,筛选出乳腺癌病人VTE 形成的危险因素并计算其综合危险度,构建乳腺癌专科VTE 风险预测模型,以期指导临床更好地预防VTE 发生。
1 资料和方法
1.1 文献检索 计算机检索英文数据库:PubMed、EMbase、Web of Science、CINAHL、Cochrane Library,检索词为“thrombosis/deep vein thrombo*/venous thrombo*/thrombus/embolism/blood clot/phlebothrombosis”“breast neoplasm/breast cancer/breast tumor*/mammary cancer/breast malignant neoplasm*”“factor*/risk factor/influence factor/relevant factor”;中文数据库:中国知网、万方数据库、中国生物医学文献数据库、维普数据库,检索词为“乳腺癌/乳腺肿瘤”“静脉血栓/VTE”“危险因素/影响因素/相关因素/发病因素/原因”。同时,采用滚雪球法对纳入文献的参考文献进行追踪检索。检索时限均为从建库至2019 年5 月31 日。
1.2 文献纳入与排除标准 纳入标准:①研究对象为年龄18 岁以上经病理诊断为乳腺癌病人;②观察终点包括客观诊断的VTE 事件;③研究类型为队列研究或病例对照研究;④可直接或者通过数据转换能够获取影响因素的风险值(risk ratio,RR)及95% 置信区间(confidence interval,CI);⑤暴露组(病例组)和非暴露组(对照组)基线具有可比性;⑥各研究假设及研究方法类似,均衡性一致。排除标准:①研究对象除纳入乳腺癌人群外,另有其他类型的癌症人群;②涉及因素仅限医学检测的生物因子或基因层面研究;③试验设计不严谨,混杂偏倚多的病例对照研究;④不同的数据库交叉或者重复发表的研究,仅纳入最新的报道;⑤统计描述不全面或违反统计分析原则的研究。
1.3 资料提取与质量评价 对纳入的文献进行资料提取,主要包括两方面资料。①纳入研究的基本资料:作者、发表年份、研究设计类型、调查地点与时间、年龄、样本量、随访时间、血栓事件和确诊检查等;②VTE 发生的危险因素、对应RR 及95%CI。使用纽卡斯-渥太华量表(Newcastle-Ottawa Scale,NOS)对纳入文献进行质量评价。量表包括研究人群的选择(4分)、组间可比性(2 分)、结局的测量(4 分)3 部分,共10分。以上工作均由2 名研究者独立完成后交叉核对结果,若有分歧由小组成员共同协商解决。
1.4 统计学分析
1.4.1 Meta 分析 使用RevMan 5.3 进行Meta 分析。纳入研究结果间的异质性的大小采用χ2检验和I2定量判断;当I2≤50%,使用固定效应模型进行Meta 分析;当I2≥50%,且有明显的临床异质性,进行亚组分析或敏感性分析。如不能发现明显的临床异质性,则使用随机效应模型。使用Stata15.0 软件,采用Begg's 秩相关检验法和Egger's 回归分析法对纳入大于10 篇以上研究的危险因素评价发表偏倚。检验水准均为0.05。
1.4.2 风险预测模型的建立
1.4.2.1 Logistic 回归预测模型
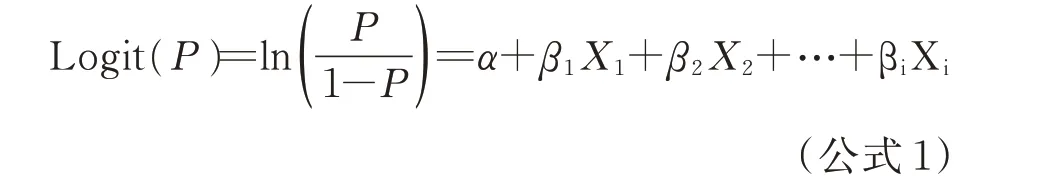
其中,P表示个体发病概率,X1、X2…Xi分别是1,2,…,i 个危险因素;α是常数项,β1、β2...βi是偏回归系数,计算公式如下:
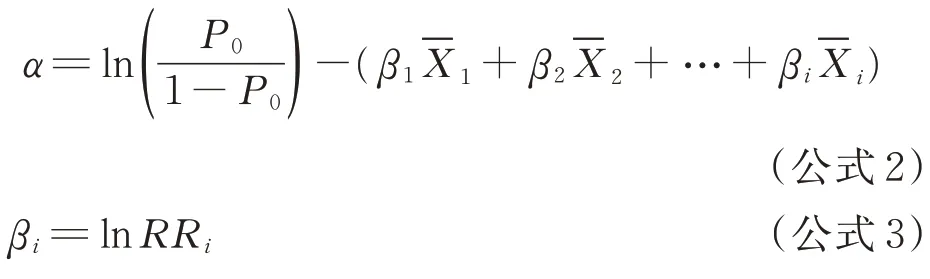
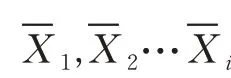
1.4.2.2 风险评分系统的具体步骤 公式1 中各回归系数βi值同时除以最小回归系数βm;将新的系数按四舍五入法取整数,即各自变量对应的危险分数为Si,总危险分数为Sc为各危险分数的和,得出仅有1 个自变量的新的评分预测模型,即:
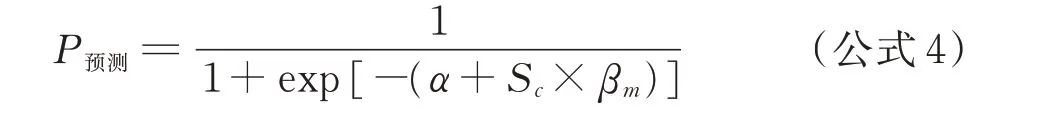
根据估算的平均暴露率和VTE 发病率(2.3%),使用R 软件模拟10 000 例病例,绘制概率分布曲线并划分危险等级。
2 结果
2.1 文献检索及筛选 初检获得文献2 854 篇,通过追踪参考文献获取8 篇文献。经EndNote 去重520 篇,获得2 342 篇文献;阅读题目和摘要进行初筛,剔除2 284 篇;纳入58 篇,阅读全文进行复筛,排除12 篇无法找到全文的研究、3 篇数据有交叉的研究、21 篇无法提供有效数据的研究,最终纳入22 篇文献。
2.2 纳入分析文献的一般状况与质量评价结果 本研究共纳入22 篇文献,包括13 篇回顾性队列研究[6-18]、6 篇病例对照研究[5,19-23],2 篇前瞻性队列研究[24-25]和1篇巢式病例对照研究[26],研究时间范围1998 年1 月1日至2018 年12 月31 日。回顾性研究共纳入526 205例乳腺癌病人,其中有22 456 例发生VTE;前瞻性研究共纳入864 例,其中有222 例发生VTE;有7篇[5,19-23,26]研究采用了配对的方法来消除部分重要的混杂因素。采用NOS 量表对纳入的文献研究进行质量评价,其中10 篇评分≥7 分,12 篇评分为4~6 分。
2.3 Meta 分析结果 本研究纳入的22 篇研究中共涉及研究因素104 个,其中研究次数4 次以上的影响因素共15 个,分别是年龄、体质指数(body mass index,BMI)、吸烟、高血压、糖尿病、冠心病、既往血栓史、远处转移、浸润性导管癌、“三阴型”癌、乳腺手术、化疗、内分泌治疗、服用他莫昔芬和中心静脉置管(central vena catheterization,CVC)。其中高血压、冠心病、远处转移和内分泌治疗合并的数据有较大异质性,进行了亚组分析或敏感性分析;Meta 分析结果及异质性分析详见表1。其他因素异质性均低于60%,说明各因素研究间的RR 值趋于一致。对研究数量在10 个以上的危险因素(高血压和糖尿病),进行Begg's 秩相关法和Egger's 直线回归法检验,结果显示均无发表偏倚。
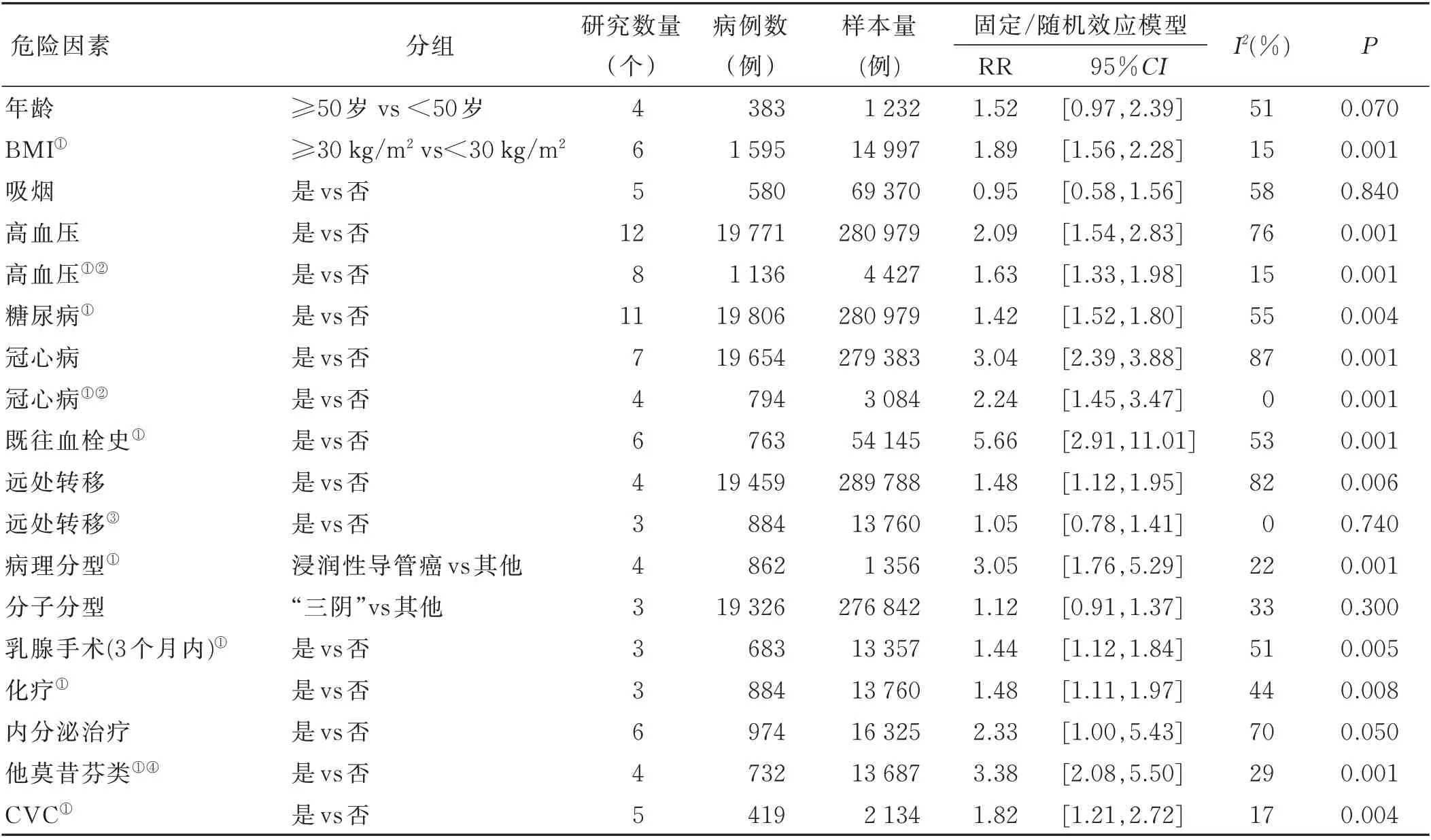
表1 Meta 分析结果及异质性分析
2.4 风险预测模型的构建及分层
2.4.1 风险预测模型的构建 将Meta 分析合并效应量差异有统计学意义的10 个因素作为预测因子纳入模型。
Logistic 回归模型如下:
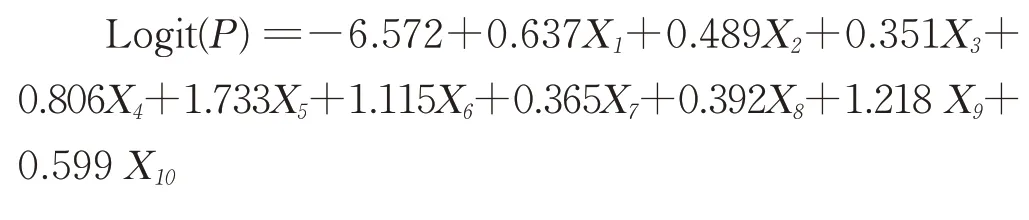
其中,X1、X2…X10分别代表BMI、高血压、糖尿病、冠心病、既往血栓史、浸润性导管癌、乳腺手术(3 个月内)、化疗、他莫昔芬类药物和CVC。根据建立的Logistic 回归模型,糖尿病的βm=0.351 为最小回归系数,建立危险评分模型,得出:
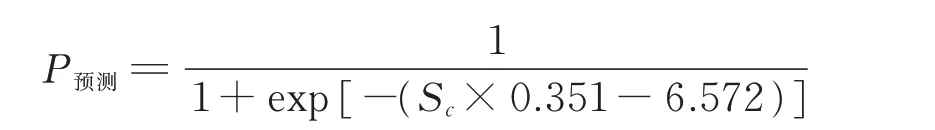
模型各预测因子的危险分值,最低为1 分,最高为5 分,总分为0~21 分。见表2。
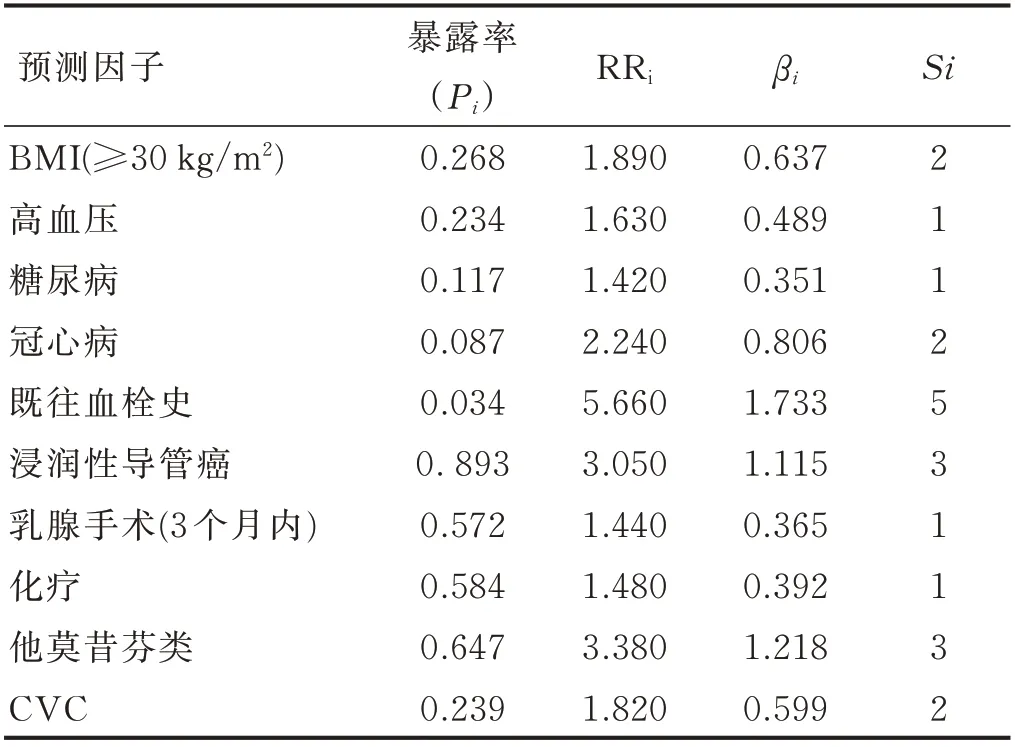
表2 风险预测模型各预测因子参数及转换分值
2.4.2 风险评分系统的等级划分 根据乳腺癌病人VTE 的10 个危险因素的暴露率,使用R 软件以rbinom(n,size,prob)为基础R 语言编写代码,模拟10 000 例病例并绘制概率分布曲线。最终将乳腺癌病人VTE的发生率2.3%的1.5 倍即3.45%对应点的发病危险作为发生VTE 的中危与高危的分界,即第9 655 位的A 点,对应发病概率是0.095 7,分值是13 分;2.3%的8倍即18.4%对应点的发病危险作为VTE 的低危与中危划分界限,即第7 800 位为B 点,对应发病概率是0.018 0,分值是9 分。危险等级的划分节点详见图1。因此,该模型的危险分层是低于9 分为低危,9~<13分为中危,≥13 分为高危。
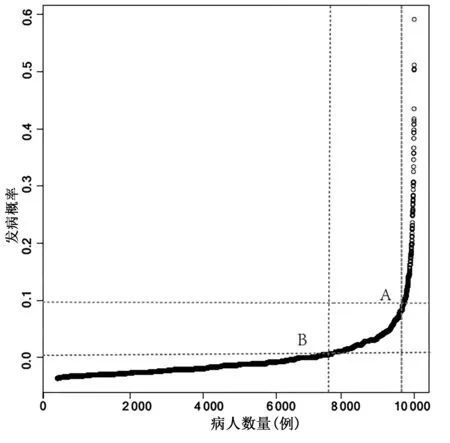
图1 预测模型危险等级划分节点图
3 讨论
本研究构建的风险预测模型包括病人特征、疾病诊断和治疗相关因素在内的10 个预测因子。KS 及其修订版CATS、PROTECHT 评分模型均将BMI≥35 kg/m2作为VTE 的预测因子之一,但欧美人群BMI 整体水平偏高,考虑到亚洲人种的差异,将分层界值为30 kg/m2的亚组纳入模型。最新发布的COMPASS-CAT评估模型基于1 023 例门诊癌症病人构建,其中乳腺癌占61%,对预测乳腺癌病人VTE 的风险具有重要的参考价值[27],它将心血管类疾病数量作为重要的预测因子评为6 分,总分28 分。而本研究将高血压、糖尿病、冠心病分别作为独立的预测因子,总分为4 分。与其他多个广泛应用的模型如Caprini 评分、Wells 量表一致,此模型中既往血栓史作为最重要预测因子,评分为5 分;浸润性导管癌次之,评分为3 分。多项研究表明,手术是发生VTE 的独立危险因素,且术后3 个月内发生率最高,这一时期确诊的VTE 事件占所有事件的70%左右[14,28];乳腺癌病人常用的化疗药物有环磷酰胺、5-氟尿嘧啶、蒽环类和紫杉醇类等,这些药物均可直接或间接抑制血管内皮生长因子的活性,损伤血管壁,促进血栓形成[29-30];COMPASS-CAT 模型将含蒽环类药物的化疗作为预测因子之一[RR=2.33,95%CI(1.02~5.33)]。服用他莫昔芬可增加静脉血栓的风险,且与化疗药物联用时发病风险会更高[31]。但目前,他莫昔芬类药物增加血栓发生的机制仍未明了。
通过评估乳腺癌病人是否存在以上10 个危险因素,来估算个体VTE 的发病概率、危险评分和分级。例如:1 例65 岁乳腺癌术后2 个月的住院病人,即将使用CVC 行第6 周期的化疗,BMI 为30.5 kg/m2,高血压病史10 年,冠心病史3 年,无糖尿病和既往血栓史,病理诊断是浸润性导管癌,未服用他莫昔芬类进行内分泌治疗。试预测该病人化疗期间发生静脉血栓的风险有多少?将危险因素BMI(2 分)、高血压(1 分)、冠心病(2 分)、浸润性导管癌(3 分)、乳腺手术(1 分)、化疗(1 分)和CVC(2 分)的评分相加,为12 分,血栓发生风险为中危;计算发生概率P预测=8.63%,该病人发生VTE 概率是一般人群(2.3%)的4 倍。因此,可以考虑对该病人采取机械性物理措施,强化血栓预防的健康教育并增加下肢的评估频率。在实际应用中需要注意的是,该模型构建使用的常数项和10 000 例模拟病例均是根据文献报道的VTE 平均发病率和文献中各危险因素的对照组暴露率进行估算的,如目标医院或地区以上两方面数据与本研究差距过大,可能使得估算的个体发病概率(P预测)和危险分层出现偏差。因此,尽管本研究在综合分析已有数据的基础上建立了乳腺癌病人VTE 形成风险预测模型,但仍有待临床实践对其稳定性和适用性进行外部验证。
本研究系统地检索和回顾了乳腺癌VTE 相关的危险因素,通过Meta 分析的方法,结合Logistic 回归模型构建了乳腺癌病人VTE 的个体化风险预测模型。这种大样本的累积不仅克服了因乳腺癌人群VTE 发病率低、病例收集难的问题,同时避免了单中心研究样本缺乏代表性的问题,保障了各危险因素综合危险度的可靠性;通过逻辑评分法将复杂的公式转化成评分,增加了预测模型临床的可操作性,而且这种评分转换方法在其他风险评估模型构建中已广泛应用,其科学性和可靠性已得到了验证[29-31];通过计算机模拟数据集划分了3 个危险等级,以期指导临床有针对性地采取物理或药物预防,以达到最佳风险/获益比。此外,该模型除了对乳腺癌病人VTE 形成有预防的现实意义外,还可为下一步建立其他疾病发病的风险预测模型提供新的思路。但由于Meta 分析本身是基于原始研究的二次分析,致使本研究存在不可规避的不足。例如提取数据时虽优先采用多因素校正后的RR 值,但仍有部分仅提供单因素分析的结果,这有可能使合并效应量掺有混杂因素的效应;由于与癌症病人VTE发生相关的生物标志物,如D-二聚体、血细胞参数等多是连续性数据并未纳入Meta 分析,直接导致了预测因子的不全面性,使构建的风险预测模型存在一定缺陷;除高血压和糖尿病这2 个危险因素外,其他13 个危险因素研究文献数量不足10 个,未检测发表偏倚,无法明确这些因素的合并效应量是否受发表偏倚的影响。另外,模型的验证是检验模型区分度、一致度和分类度的重要手段。由于本研究是基于原始研究的定量综合,数据集并不是来自单一的研究队列,所以也无法使用重抽样法、交叉验证等方法进行内部验证。目前,该模型被用于我科室预测乳腺癌术后病人的VTE 风险,详细结果将会继续报道。

