双重抗血小板治疗对动脉瘤性蛛网膜下腔出血患者的脑室外引流出血并发症的影响
曾坚锋 李钢 刘仲海 刘珍
(三亚中心医院 海南省第三人民医院神经外科,海南 三亚 572000)
动脉瘤性蛛网膜下腔出血(ASAH)是由动脉瘤破裂引起的自发性蛛网膜下腔出血,具有发病率、病死率和致残率高的特点〔1〕。对于大部分ASAH患者而言,尽早进行血管内治疗和开颅手术是降低再出血风险的重要手段。有文献报道,70岁以上的ASAH患者应优先考虑血管内治疗〔2〕。急性期ASAH患者在支架辅助弹簧圈栓塞或血流导向装置治疗过程中需进行双重抗血小板治疗预防支架内血栓形成等缺血性并发症,但术后患者导管相关性颅内出血风险会大大增加〔3〕。脑室外引流(EVD)是经颅骨钻孔行脑室穿刺后或开颅手术中将带有数个侧孔的引流管前端置于脑室内引出脑脊液的技术〔4〕。目前,国内外对双重抗血小板治疗与ASAH患者EVD后出血并发症的相关性研究尚少。本研究探讨双重抗血小板治疗是否与ASAH患者EVD后出血并发症相关。
1 资料与方法
1.1临床资料 选择2016年3月至2019年3月三亚中心医院93例接受EVD治疗的ASAH患者作为研究对象。纳入标准:①符合ASAH诊断标准〔5〕;②世界神经外科医师联盟(WFNS)分级为Ⅳ或Ⅴ级;③Hunt-Hess分级为Ⅰ~Ⅳ级;④发病24 h内。排除标准:①合并严重心脏及呼吸系统疾病、多器官衰竭、严重高血压性疾病者;②凝血功能异常者;③烟雾病、脑血管畸形及外伤性假性动脉瘤破裂者。根据治疗方案不同将患者分为研究组和对照组,研究组采用双重抗血小板+支架辅助弹簧圈栓塞+EVD治疗方案,对照组采用非支架辅助弹簧圈栓塞+EVD治疗方案。研究组40例,男16例,女24例,年龄51~72〔平均(63.36±3.21)〕岁;对照组53例,男22例,女31例,年龄54~78〔平均(64.15±3.16)〕岁。两组性别、年龄等一般资料差异无统计学意义(P>0.05),见表1。研究对象签署知情同意书,本研究经医院伦理委员会批准。
1.2方法 两组入院后统一进行补液、控制颅内压、抗脑血管痉挛等常规治疗及镇静、镇痛、止咳、通便等对症处理,病情允许情况下行数字减影血管造影(DSA)检查明确动脉瘤大小、形状、位置、指向,术后即刻行DSA检查观察动脉瘤栓塞情况。研究组采用支架辅助弹簧圈栓塞+双重抗血小板治疗+EVD治疗方案,对照组采用非支架辅助弹簧圈栓塞+EVD治疗方案。所有患者进行为期6个月的DSA随访,观察复发情况。
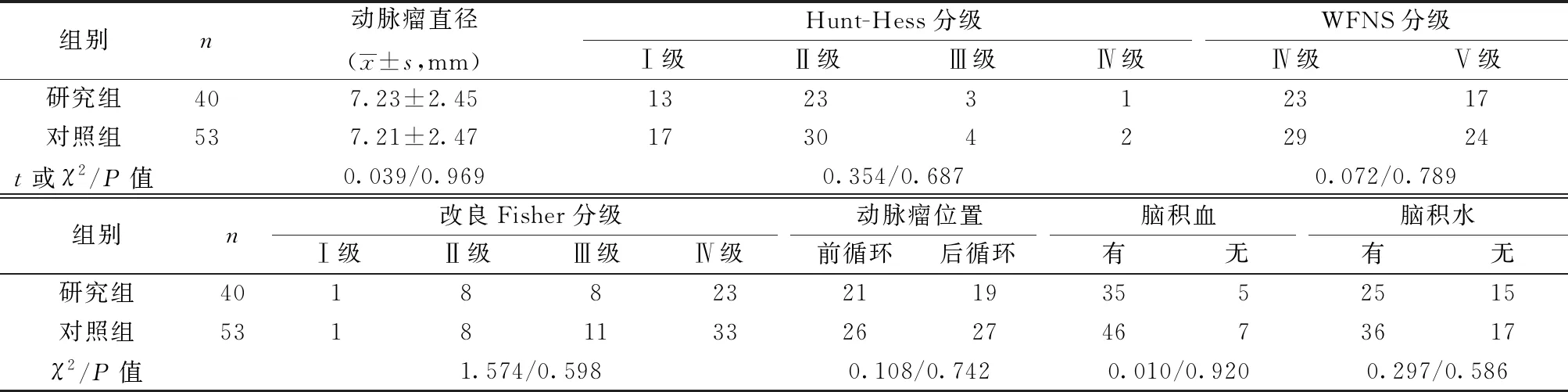
表1 两组术前一般资料比较(n)
1.2.1支架辅助弹簧圈栓塞术 术前3 d予以75 mg硫酸氢氯吡格雷片(乐普药业股份有限公司,国药准字H20123116,规格75 mg×7片)和300 mg阿司匹林肠溶片(拜耳医药保健有限公司,国药准字J20130078,规格100 mg×30片)口服;患者取仰卧位,全麻后消毒双侧腹股沟区铺无菌巾;于右腹股沟韧带下0.5 cm股动脉波动最强处做一个0.5 cm左右切口,采用Seldinger法穿刺右侧股动脉,成功后置入导管鞘(6F);以0.75 mg/kg静脉注射肝素钠注射液(天津生物化学制药有限公司,国药准字H12020505),1 h后追加半量,2 h后追加1/4量,后每隔1 h追加前次剂量的半量,剂量减至10 mg时每隔1 h给予10 mg,保持患者治疗过程中全身肝素化;通过导丝将造影导管(5F)分别送至双侧颈内动脉和椎动脉利用DSA X线机(荷兰PHILIPS公司生产,型号FD20)对血管行正位和侧位投照,载瘤动脉行多角度投照,对载瘤动脉瘤大小、瘤颈宽度及动脉直径进行测量,选择尺寸适宜的弹簧圈及支架;操作中利用高压肝素生理盐水持续冲洗管腔防止导管内血栓形成;路径图引导下沿导丝将栓塞导管送入动脉瘤瘤腔内,采用Seldinger法穿刺左侧股动脉置入导管鞘,通过导丝将支架导管送至载瘤动脉指定位置;根据实际情况填充弹簧圈并释放支架,立即以0.15 μg/(kg·min)静脉内注射盐酸替罗非班注射液(Iroko Cardio Australia Pty Ltd,国药准字H20090786)2 h;观察载瘤动脉栓塞情况达到满意效果后再次进行DSA检查确定支架位置稳定性及动脉瘤栓塞完毕后撤出器械,穿刺部位压迫止血并加压包扎;于EVD术后24 h内遵医嘱进行双重抗血小板治疗(75 mg/d硫酸氢氯吡格雷片和100 mg/d阿司匹林肠溶片口服,需在静脉输注药物6 h后服用,氯吡格雷疗程为6 w,阿司匹林为终身服用)。
1.2.2非支架辅助弹簧圈栓塞术 患者取仰卧位,全麻后消毒双侧腹股沟区铺无菌巾;于右腹股沟韧带下0.5 cm股动脉波动最强处做一个0.5 cm左右切口,采用Seldinger法穿刺右侧股动脉,成功后置入导管鞘(6F);通过导丝将造影导管(5F)分别送至双侧颈内动脉和椎动脉利用DSA X线机对血管行正位和侧位投照,载瘤动脉行多角度投照,对载瘤动脉瘤大小、瘤颈宽度及动脉直径进行测量,选择尺寸适宜的弹簧圈;路径图引导下沿导丝将栓塞导管送入动脉瘤瘤腔内,观察载瘤动脉栓塞情况达到满意效果后再次进行DSA检查确定支架位置稳定性及动脉瘤栓塞完毕后撤出器械,穿刺部位压迫止血并加压包扎。
1.2.3EVD术 用亚甲蓝液在头皮上划出正中矢状线,以选定的穿刺点为中点划出头皮切口线,常规消毒铺巾后0.5%普鲁卡因局麻;全层切开头皮及骨膜,用骨膜剥离器向两侧分离后用乳突牵开器牵开,电灼硬脑膜后“十”字形切开;以带芯引流管经电凝过的皮质按预定方向穿刺入侧脑室;引流管穿过脑室壁过程中,当阻力突然减小时拔出针芯观察引流管内是否有脑脊液流出,中号丝线将引流管结扎固定于头皮上,间断缝合帽状腱膜和皮肤切口;将引流管无菌接于脑室引流瓶,切口及引流管各连接处以消毒纱布妥善包扎防止污染。
1.3观察指标 比较两组术后即刻栓塞结果、术后EDV相关出血情况、引流管留置时间、住院时间、手术费用、治疗前后格拉斯哥昏迷量表(GCS)评分、Barthel指数(BI)及美国国立卫生研究院脑卒中量表(NIHSS)、EDV相关放射学出血单因素和多因素分析,两组复发情况。
1.4判定标准 GCS评分:通过睁眼反应、言语反应和运动反应评估,总分为3~15分。15分提示正常;13~14分提示轻度昏迷;9~12分提示中度昏迷;3~8分提示重度昏迷。WFNS分级〔6〕:GCS评分为15分,无神经功能障碍、偏瘫和(或)失语提示Ⅰ级;GCS评分为13~14分,无神经功能障碍、偏瘫和(或)失语提示Ⅱ级;GCS评分为9~12分,有(或)无神经功能障碍、偏瘫和(或)失语提示Ⅲ级;有(或)无神经功能障碍、偏瘫和(或)失语提示Ⅳ级。栓塞结果:根据动脉瘤栓塞Raymond分级〔7〕标准制定。造影剂在瘤颈和瘤腔中均不显影提示完全栓塞;造影剂在瘤体中不显影而瘤颈中部分显影提示次全栓塞;造影剂在瘤腔中滞留提示不全栓塞。BI评分:通过10个项目对患者日常活动能力进行评估,总分为0~100分。100分提示无需依赖;61~99分提示轻度依赖;41~60分提示中度依赖;≤40分提示重度依赖。NIHSS评分:通过11个项目对患者神经系统功能进行评估,总分为0~42分,分数越高提示神经功能受损越严重。Hunt-Hess分级:0级提示未破裂动脉瘤;Ⅰ级提示无症状或轻微头痛;Ⅱ级提示中或重度头痛、脑膜刺激征阳性、颅神经麻痹;Ⅲ级提示嗜睡、轻度局灶性功能缺损;Ⅳ级提示昏迷或中或重度偏瘫、早期去大脑强直;Ⅴ级提示深昏迷、去大脑强直、濒死状态。改良Fisher分级:0级提示CT未见出血或仅脑室内出血或脑实质内出血;Ⅰ级提示CT仅见基底池出血;Ⅱ级提示CT仅见周边脑池或侧裂池出血;Ⅲ级提示CT见广泛蛛网膜下腔出血伴脑实质内血肿;Ⅳ级提示CT见基底池和周边脑池、侧裂池较厚积血。
1.5统计学处理 采用SPSS20.0软件进行t检验、χ2检验、Pearson分析。
2 结 果
2.1两组术后即刻栓塞结果比较 两组术后即刻动脉瘤完全栓塞率及次全栓塞率比较差异均无统计学意义(均P>0.05);研究组术后即刻不全栓塞率明显低于对照组,差异有统计学意义(P<0.05)。见表2。
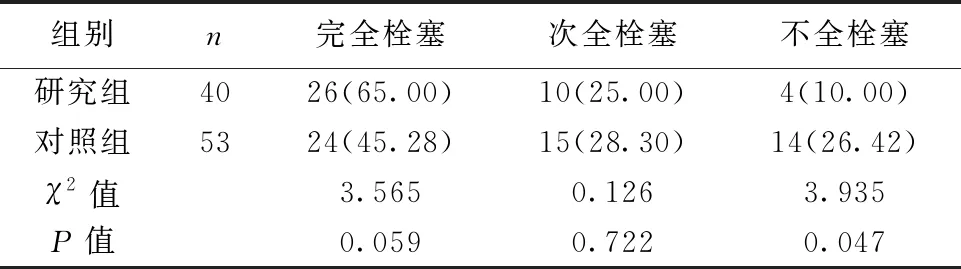
表2 两组术后即刻栓塞结果比较〔n(%)〕
2.2两组治疗前后GCS、BI及NIHSS评分比较 两组治疗前GCS、BI及NIHSS评分比较差异均无统计学意义(均P>0.05);治疗后,两组GCS和BI评分均较治疗前明显升高,且研究组明显高于对照组,差异均有统计学意义(P<0.05);两组NIHSS评分均较治疗前明显降低,且研究组明显低于对照组,差异均有统计学意义(P<0.05)。见表3。
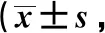
表3 两组治疗前后GCS、BI及NIHSS评分比较分)
2.3两组术后EDV相关出血情况比较 研究组14例(35.00%)新发颅内出血,仅有4例(10.00%)为EDV相关症状性出血,症状性出血中有1例(2.50%)患者进行脑室外引流翻修,3例(7.50%)患者出现无法遵循左上肢和下肢指令、四肢无力、头痛、意识模糊和嗜睡的症状。对照组3例(5.66%)新发颅内出血,仅有2例(3.77%)为EDV相关症状性出血,症状性出血中有1例(1.89%)患者出现左侧旋前肌移位和混乱,1例(1.89%)患者出现左侧局灶性缺损。两组术后EDV相关症状性出血发生率及血肿直径比较差异均无统计学意义(均P>0.05);研究组术后放射学出血发生率明显高于对照组,差异有统计学意义(P<0.05);双联抗血小板治疗与EDV相关症状性出血数量增加无显著相关性(r=3.678,P=0.479)。见表4。
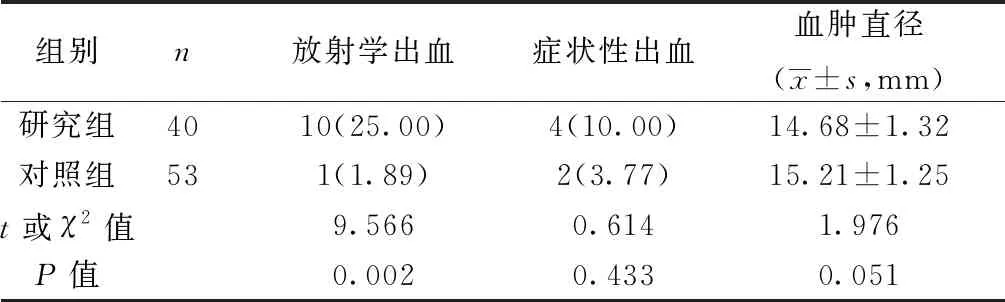
表4 两组术后EDV相关出血情况比较〔n(%)〕
2.4两组住院情况比较 两组引流管留置时间、住院时间及手术费用比较差异均无统计学意义(均P>0.05)。见表5。

表5 两组住院情况比较
2.5EDV相关放射学出血单因素和多因素分析 单因素分析得出,EDV相关放射学出血发生率在双重抗血小板治疗、Hunt-Hess分级和改良Fisher分级上具有显著差异(P<0.05);多因素分析得出,双重抗血小板治疗、改良Fisher分级(3~4级)为EDV相关放射学出血危险因素(P<0.05)。见表6。
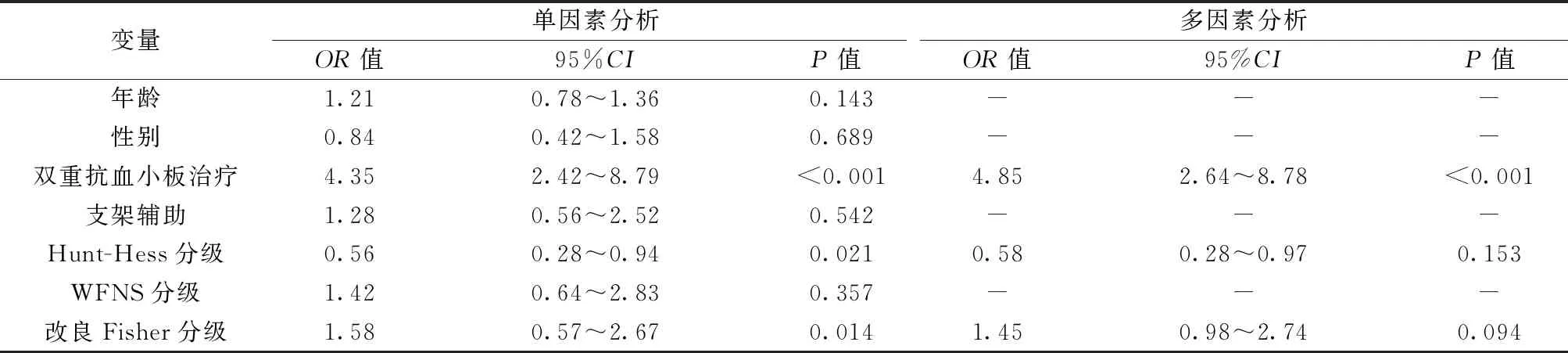
表6 EDV相关放射学出血单因素和多因素分析
2.6两组复发情况比较 所有患者进行为期6个月的DSA随访,平均随访时间为(6.38±1.12)个月。研究组2例(5.00%)发生动脉瘤复发,对照组12例(22.64%)发生动脉瘤复发,研究组动脉瘤复发率明显低于对照组,差异有统计学意义(P<0.05)。
3 讨 论
颅内动脉瘤为脑动脉内腔局限性异常扩大形成的血管性包块,破裂后可造成致死或致残〔8〕。有研究表明,年龄<50岁、高血压、后交通和后循环动脉瘤、形态不规则动脉瘤为颅内动脉瘤破裂的危险因素〔9〕。颅内动脉瘤破裂为自发性蛛网膜下腔出血主要病因,患者可因大量血液进入蛛网膜下腔导致脑水肿、颅内高压或急性脑积水〔10〕。弹簧圈栓塞具有操作简便、创伤小、恢复快的优势,有研究表明,弹簧圈瘤腔内栓塞相对动脉瘤颈夹闭术而言在治疗高分级ASAH中疗效更佳且安全性更高,同时对患者免疫功能影响较小并能有效提高术后自理能力〔11〕。随着支架技术的进展,支架辅助弹簧圈血管内栓塞已逐渐应用于临床。单纯弹簧圈栓塞可由于弹簧圈物理性质导致无法对宽颈动脉瘤进行致密填塞患者,柯勋昌等〔12〕发现,单纯弹簧圈栓塞较支架辅助弹簧圈栓塞颅内大型/巨大型动脉瘤复发率大。支架辅助弹簧圈栓塞可增加弹簧圈填塞致密性,有研究表明,支架辅助弹簧圈栓塞已证实在一些结构形态复杂或瘤颈较宽的动脉瘤治疗中取得满意的治疗效果〔13〕。需指出的是,接受支架辅助弹簧圈栓塞治疗的ASAH患者围术期需接受双重抗血小板治疗,有可能增加出血性并发症风险。有文献报道,急性期宽颈动脉瘤中接受支架辅助弹簧圈栓塞治疗患者围术期出血性并发症发生率高于单纯弹簧圈栓塞患者,但差异不具有统计学意义,两种治疗方式均具有较高的围术期安全性〔14〕。ASAH治疗复杂血管内介入栓塞治疗后常需进行进一步有创操作以缓解颅内高压。EDV是临床缓解ASAH患者颅内高压症状的常用手段,但EDV为有创操作穿刺过程中可因损伤血管导致脑室内、硬脑膜下或硬脑膜外出血〔15〕。EDV治疗前进行支架辅助弹簧圈栓塞与双重抗血小板治疗是否增加EVD相关出血性并发症发生率尚未明确。
本研究结果提示研究组治疗方案栓塞效果更佳,可能与支架改变载瘤动脉与动脉瘤间血流动力学方向降低血流冲击或支架减轻了动脉瘤瘤颈处血液涡流运动从而利于动脉瘤内血栓形成有关。本研究结果提示双重抗血小板治疗可增加EDV相关放射性出血风险但并未明显增加症状性出血发生率,具有一定安全性。研究组治疗方案更能有效改善患者神经功能损伤并提高其术后生活质量。急性期ASAH患者治疗方案应根据实际情况进行选择,双重抗血小板治疗虽可增加EDV相关放射学出血风险,但有研究表明术后监测血小板活化功能指导抗血小板治疗可有效防止颅内动脉瘤支架辅助弹簧圈栓塞术后血栓形成和出血事件的发生〔16〕。

