河南大蒜韭葱黄条病毒的分子鉴定及其系统进化分析
高丹娜, 吴淑华, 涂丽琴, 干射香, 程兆榜, 姚秋菊, 魏利辉, 周益军,朱月林, 季英华
(1.南京农业大学园艺学院,江苏 南京 210095; 2.江苏省农业科学院植物保护研究所,江苏 南京 210014; 3.河南省农业科学院园艺研究所,河南 郑州 450000)
大蒜(Allimu.sativumL.)是一种重要的特色蔬菜,在中国已有两千多年的栽培历史[1]。由于大蒜适应性广,经济价值高,种植广泛,目前中国大蒜种植总面积达8.1×105hm2,已成为世界上最大的大蒜生产和消费国[2-3]。随着大蒜种植规模的扩大,大蒜上病毒病的危害也不断出现,成为影响产业健康发展的重要因素。大蒜上病毒病的发生常会造成植株叶片出现花叶、褪绿、植株扭曲等症状,严重时会导致蒜头瓣少或不分瓣,产量下降,品质变劣[4]。由于生产上大蒜主要通过鳞茎以无性繁殖方式进行扩繁,病毒会通过蒜头(蒜种)直接传播至下一茬,因此病毒病对于大蒜的危害往往是相对长期的,且具有累加效应,这种累加效应不仅影响在大蒜的产量和品质上,也会影响蒜种质量,造成蒜种的退化,加剧对大蒜的危害,困扰大蒜产业发展。目前有报道可以侵染危害大蒜的植物病毒有多种,主要分布在3个属:马铃薯Y病毒属(Potyvirus)、麝香石竹潜隐病毒属(Carlavirus)和葱属X病毒属(Allexivirus),其他如番茄斑萎病毒属、斐济病毒属等也有部分成员可以侵染危害大蒜[5]。
韭葱黄条病毒(Leek yellow stripe virus,LYSV)是一种蚜传植物病毒[6],其侵染危害对象包括大蒜、韭葱等多种葱属(Allium)植物[7],导致寄主植物叶片出现黄色条纹,鳞茎质量显著减小,影响作物产量,有报道显示其侵染危害大蒜造成减产可高达54%[8-9]。LYSV最早于1978年由Bos等发现并命名[10],之后该病毒不断扩散蔓延,在墨西哥[11]、土耳其[12]、厄瓜多尔[13]、印度[14]、塞尔维亚[15]、克罗地亚[16]、美国[17-19]、日本[20]、捷克[21]、阿根廷[22]、法国[8]等多个国家和地区发生危害,成为一种在世界范围发生危害的主要病毒。中国早在2001年就有LYSV的发生危害报道,目前LYSV在浙江[23]、厦门[24]、黑龙江[25]、湖南[26]等地都有发生危害的报道,威胁当地作物安全生产。
LYSV是一种正义单链 RNA 病毒,分类上属于马铃薯Y病毒属,病毒粒子为线状,无包膜,长度为815~820 nm,基因组全长10 142 bp,5′端具有病毒基因组结合蛋白VPg,3′端具有Poly(A),含1个开放阅读框(ORF),翻译产生1个多聚蛋白质,多聚蛋白质再通过酶解形成包括外壳蛋白(CP)在内的10个有功能的成熟蛋白[23],其中 CP 是病毒的重要结构蛋白,也是该属病毒种间分类的重要参考指标[27-28]。
河南是中国大蒜第二大产区,常年栽培面积达1.3×105hm2[2],近年来当地大蒜上病毒病呈多发态势,2019年本研究在对河南大蒜上病毒病进行调查时,对当地大蒜病毒病样品进行了田间采集,经过室内分子检测及序列分析,结果发现当地大蒜上存在LYSV的感染。
1 材料与方法
1.1 供试病样
病样为2019年采自河南开封疑似感染病毒病的大蒜样本,样本采集后用液氮冷冻存放于-80 ℃冰箱中,用于后续试验。
1.2 主要试剂
RNAiso Plus、反转录试剂盒Prime ScriptTMRT Master Mix、ExTaq酶和克隆载体PMD 18-T购自宝生物工程(大连)有限公司(TaKaRa),2×TaqMaster Mix购自Vazyme公司,大肠杆菌菌株TOP 10感受态细胞购自北京庄盟国际生物基因科技有限公司,琼脂糖凝胶DNA回收试剂盒及质粒提取试剂盒购自美国Axygen公司。其他试剂均为国产分析纯,引物委托Invitrogen(上海)贸易有限公司合成。
1.3 病样总RNA提取
取保存于-80 ℃冰箱中的大蒜病样,将其置于液氮中用研钵磨成粉末,采取Trizol法[29]提取总RNA,提取后放在-80 ℃冰箱备用。
1.4 LYSV的RT-PCR检测
以病样总RNA为模板,进行反转录,合成cDNA。反应体系(10.0 μl)为:模板RNA 0.5 μl,5×Prime Script RT Master Mix 2.0 μl,RNase-Free H2O 7.5 μl。反应程序:37 ℃保温 15 min,85 ℃变性 5 s,4 ℃保存。以反转录获得的cDNA为模板,利用韭葱黄条病毒特异性检测引物LYSV1和LYSV2(表1)进行PCR扩增。PCR反应体系:2×TaqMaster Mix 10 μl,ddH2O 7 μl,LYSV1和LYSV2各1 μl,cDNA 1 μl,总体系20 μl;反应程序:94 ℃ 变性5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 30 s,34个循环;72 ℃ 延伸10 min,4 ℃保存。在0.5×TAE电泳缓冲液中,经1 % 琼脂糖凝胶电泳分离PCR产物,并检测拍照。

表1 本研究用到的引物
1.5 LYSV CP 基因克隆
根据韭葱黄条病毒外壳蛋白氨基酸序列设计引物LYSVCP_F和LYSVCP_R(表1),以检测结果为阳性的病样总RNA反转录产物为模板进行RT-PCR扩增。CP基因扩增体系: 10×ExTaqBuffer 2.5 μl,dNTP 0.5 μl,上下游引物各 1.0 μl,cDNA 1.5 μl,ExTaqDNA聚合酶 0.5 μl,ddH2O 18.0 μl,总体积 25.0 μl。扩增程序:94 ℃ 5 min;94 ℃ 45 s,47 ℃ 45 s,72 ℃ 55 s,循环 34 次;72 ℃ 10 min,4 ℃ 保存。PCR反应产物于0.5×TAE电泳缓冲液中经1 % 琼脂糖凝胶电泳检测,检测后得到的目的片段参照胶回收试剂盒说明书进行回收纯化后将目的片段与PMD-18T载体在16 ℃下过夜连接,连接产物经热激法转化大肠杆菌TOP10感受态细胞,并涂布到含有氨苄青霉素的LB平板上,在37 ℃ 条件下倒置过夜培养,挑取平板上的克隆进行菌落PCR和酶切鉴定,鉴定无误后将菌液送通用生物系统(安徽)有限公司进行序列测定。
1.6 序列分析
序列测定完成后根据扩增引物去除两端的冗余序列,序列多重比对、同源性分析使用ClustalX、BioEdit、DNAstar等软件及NCBI网站上的BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)完成,聚类分析及进化树构建采用MEGA6软件(MEGA、美国)的邻近法(Neighbor-joining)完成,进化树的可信度使用1 000次自导复制(Bootstrap)验证。
2 结果与分析
2.1 病害田间症状
本研究2019年对河南大蒜上病毒病进行调查时发现当地大蒜存在疑似病毒感染的病株,发病大蒜植株叶片上出现明显的黄色褪绿斑块,有些呈点状,有些呈条状,病株偶有矮化现象。在田间调查过程中,我们发现该病在河南多个蒜区均有发生,田块间发病程度差异比较大,重发田块的发病率达30%,但零星发生田块居多,未见整个田块全发生或毁田的情况。
2.2 韭葱黄条病毒的检测
为明确病样感染的病毒种类,田间样品采集后,我们对采集的样品提取了总RNA并进行RT-PCR检测。结果发现在利用引物LYSV1和LYSV2进行检测时,采集的38份疑似病样中,有33份扩增到了约为300 bp大小的条带,与目的条带(304 bp)大小相近(图1),而健康的对照样品中没有扩增到相应大小的条带。这些结果初步说明在河南采集的大蒜病样中可能存在韭葱黄条病毒的感染。
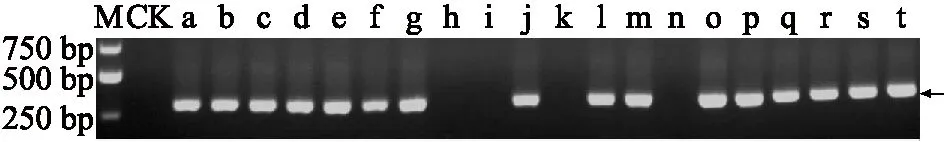
M:DL 5 000 marker;CK:健康植株;a:19HNGD1-1;b:19HNGD1-2;c:19HNGD1-3;d:19HNGD1-4;e:19HNGD1-5;f:19HNGD1-6;g:19HNGD1-7*;h:19HNGD1-8;i:19HNGD1-9;j:19HNGD1-10;k:19HNGD1-11;l:19HNGD1-12;m:19HNGD2-1;n:19HNGD2-2;o:19HNGD2-3*;p:19HNGD2-4;q:19HNGD2-5;r:19HNGD2-6;s:19HNGD2-7;t:19HNGD2-8。标星号样品为抽选CP基因克隆样品。图1 病样中韭葱黄条病毒(LYSV)的RT-PCR检测Fig.1 RT-PCR detection of leek yellow stripe virus(LYSV) in diseased garlic plants
2.3 韭葱黄条病毒CP基因克隆
为进一步确定检测到的病毒是LYSV,我们针对LYSV的CP基因设计了1对引物:LYSVCP-F和LYSVCP-R(表1),RT-PCR结果(图2)显示33份阳性样品均能扩增到大小约为860 bp左右的条带,与预期目的条带大小(864 bp)吻合,说明该条带就是本研究要扩增的CP基因目的条带。
随机抽选3个样品(19HNGD1-7,19HNGD2-3,19HNGD2-10),对扩增到的目的条带(图2)进行回收,回收产物连接PMD18-T载体,转化大肠杆菌(TOP10)感受态细胞后通过菌落PCR方法筛选阳性克隆,阳性克隆经酶切验证(图2)后送通用生物系统(安徽)有限公司进行序列测定(每个样品随机抽选2个阳性克隆)。

左:LYSV CP基因RT-PCR扩增;右:PMD18T-CP 酶切验证(BamH I) 。左图,M:DL 5 000 marker;a:19HNGD1-7;b:19HNGD2-3;c:19HNGD2-10;19HNGD1-7、19HNGD2-3、19HNGD2-10为用于LYSV CP基因克隆的样品编号。右图,M:DL 5 000 marker;1、2、3:筛选到的CP阳性克隆编号。图2 CP基因的RT-PCR扩增(左)及阳性克隆酶切验证(右)Fig.2 RT-PCR amplification of CP gene (left) and identification of positive clone by enzyme digestion (right)
2.4 韭葱黄条病毒CP基因序列分析
对送测后获得的序列信息进行分析,结果发现本研究获得的6个CP基因序列全长均为864 bp,编码1个由289个氨基酸组成的相对分子质量约32 300的蛋白质,序列之间的同源性超过98.6%,BLAST分析结果显示,其与LYSV(HQ258895)同源性最高,暗示了其属于LYSV的1个分离物。
为进一步分析其分类地位,我们使用ClustalX软件将本研究测定的LYSVCP基因序列及已公开的其他LYSV分离物CP基因序列进行了比对(表2),并利用MEGA6软件,使用临近法(Neighbor-Joining,NJ)、Kimura 2-parameter模型重建了系统进化树(图3)。
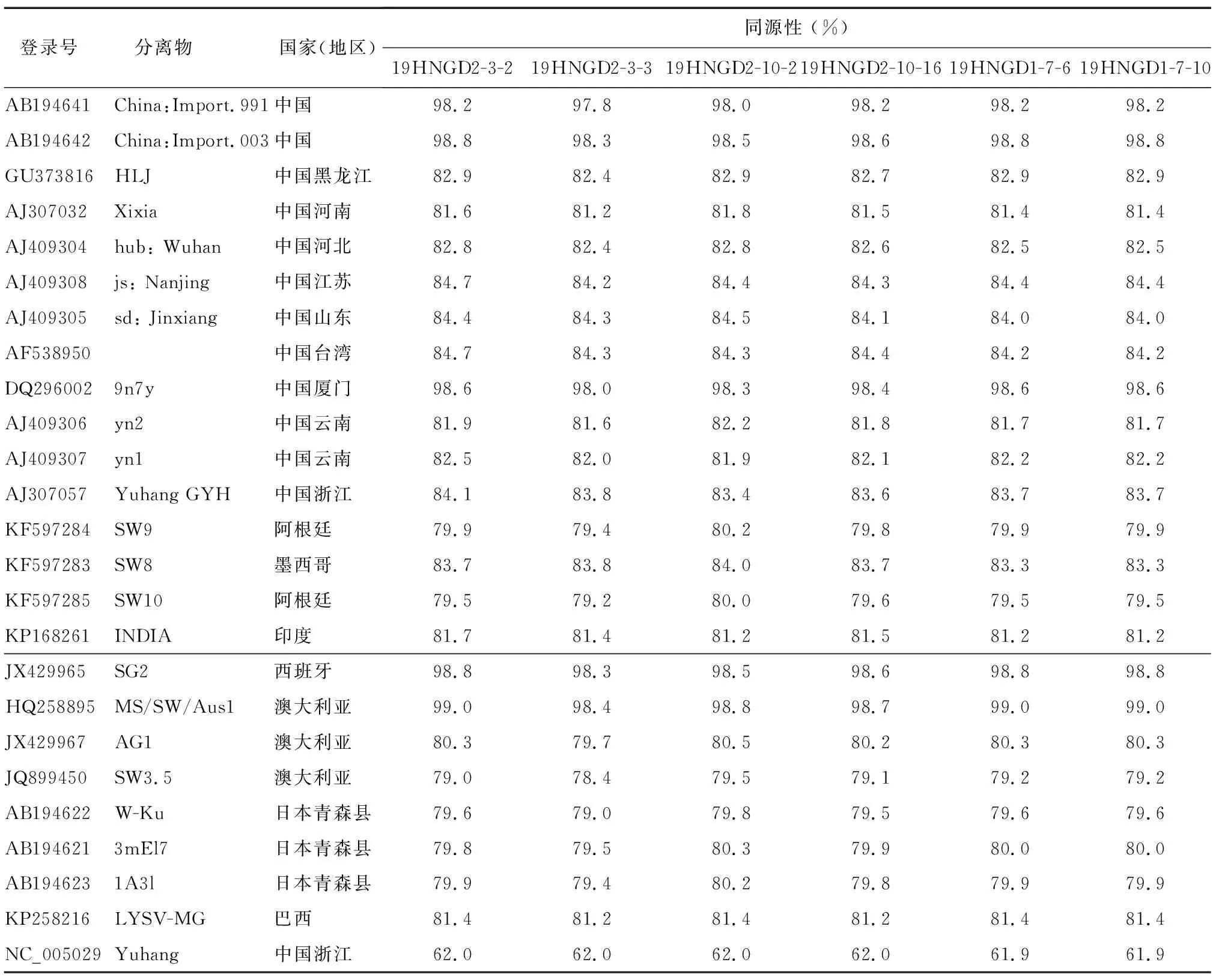
表2 6个样品CP基因序列与已公布LYSV CP基因序列的同源性

各支上的数字是1 000次Bootstrap自导复制的置信度。●:本研究测定的LYSV河南分离物;○:之前报道的LYSV河南分离物。图3 根据LYSV CP基因核苷酸序列一致性构建的系统进化树Fig.3 Phylogenetic tree based on nucleotide sequence consistency of CP gene of LYSV
由CP基因核苷酸序列构建的系统进化树(图3)可以看出,本研究获得的6个LYSV河南分离物全部聚类到LYSV分支中,说明本研究从河南分离到的病毒为LYSV。对进化树分析可以得出LYSV分为2个大组,LYSV病毒中国分离物、西班牙分离物、墨西哥分离物、印度分离物及巴西的1个分离物和澳大利亚的1个分离物共同聚类到第1组(Group I),而LYSV病毒阿根廷分离物、澳大利亚2个分离物、日本分离物及巴西的1个分离物聚类到第2组(Group II)。针对聚类到第1组的LYSV病毒中国分离物,他们也分布于不同的小分支中,其中本研究报道的河南分离物与中国厦门等地的2个分离物共同聚类到1个小分支中,他们相对近缘。而与其他LYSV分离物(如浙江分离物、云南分离物、台湾分离物、黑龙江分离物、湖北分离物、山东分离物等)聚类到不同的小分支,相对远缘(同源性低于85%),其中与之前报道的LYSV河南分离物之间的同源性仅为81%(图3、表2),暗示了本研究报道的LYSV与之前报道的存在较大的差异,可能属于不同类型或不同株系。
3 讨 论
大蒜是一种重要的蔬菜作物,除作为调味品外,在医学研究和应用上也占有重要地位[30],因此其经济价值相对较高,种植面积比较广泛。随着种植区域的扩大,大蒜上病毒病的种类也异常复杂,目前有报道可以侵染危害大蒜的病毒种类至少有20种[5],这些病毒以单独侵染或复合侵染的方式危害大蒜,影响大蒜产量[31]。加之大蒜多采用无性繁殖的方式生产,病毒会通过鳞茎直接传播,不断加剧对大蒜的危害,造成产量损失、品质下降、品种退化等[8,32]。
河南省大蒜栽培面积达1.3×105hm2,面积、产量均居全国第2位[3],在中国大蒜生产、供给中起着重要作用。本研究对2019年采自河南表现花叶症状的大蒜样品进行检测时发现LYSV的感染,进一步的基因克隆及序列分析结果显示,其属于LYSV的1个分离物。早在2002年Chen等[23]就曾报道河南大蒜上存在LYSV,因此本研究并不是LYSV在河南发生危害的首次报道,但是CP基因序列分析结果显示,本研究获得的LYSV分离物与2002年报道的河南LYSV分离物之间的同源性仅为81%(而与中国厦门等地的LYSV分离物同源性超过98%),二者在系统进化树上也未聚类到同一小分支,相对远缘。在马铃薯Y病毒属中,CP基因核苷酸序列同源性76%~77%是病毒种的分类阈值[27-28],因此本研究报道的河南分离物属于LYSV,但是该分离物与之前报道的LYSV河南分离物存在较大的差异,这种差异可能不仅仅体现在基因序列的同源性上,二者在致病性及危害损失上也可能存在差异,暗示河南大蒜上可能出现了新的LYSV类型或株系。由于大蒜多通过无性繁殖进行生产,同时各地大蒜品种也存在频繁的调运,因此很难判断河南新的LYSV类型出现的原因是当地病毒通过变异演化产生还是通过种苗等方式从外地传入,但生产上应对这类病毒的危害密切关注,防止该病毒扩散蔓延造成更大的危害。
鉴于目前有报道可以侵染危害大蒜的病毒种类有多种,因此在调查过程中,除LYSV外,本研究也对采集样品中的其他病毒如洋葱黄矮病毒(Onion yellow dwarf virus,OYDV)、大蒜A病毒(Garlic virus A,GarV-A)、大蒜B病毒(Garlic virus B,GarV-B)、大蒜X病毒(Garlic virus X,GarV-X)、青葱潜隐病毒(Shallot latent virus,SLV)等进行了检测,结果在样品中也检测到了OYDV、SLV等病毒,且普遍存在复合侵染的现象,这些结果说明河南大蒜上病毒病种类比较复杂,因此要明确当地病毒种类及群体变化特征还需要更广泛的样品采集及更系统的种类调查。

