miR-17-5p在乳腺癌组织中的表达及与预后的相关性研究
郑丽华 王昕仪 赵亚恒 齐一睿 刘运江 刘鹏 徐曌
无论在发达国家还是在发展中国家,乳腺癌是最常见威胁女性生存的癌症之一,乳腺癌与多种信号通路,基因,表观遗传,分子学的改变息息相关。随着诊断,手术和内科治疗的发展,乳腺癌患者预后已经得到改善。乳腺癌预后标志物缺乏,乳腺癌治疗的不合适是造成治疗效果差和转移的重要原因,因此我仍需要一些新的能够预示预后、诊断和治疗效果的标志物[1,2]。MicroRNA(miRNA)是由20~24个核苷酸组成的非编码小RNA, 是多种生物的主要调控分子,能够调控细胞增殖、分化、凋亡等功能[3-6]。很多证据都已表明,miRNA可以充当癌基因或抑癌基因,并且在癌症的发生和发展中起关键作用,例如癌症耐药性,癌细胞增殖和癌细胞转移。癌症中一个通常上调miRNA簇是 miR-17-92 簇,miR-17-92 簇的主要效应miRNA是 miR-17-5p (也称为 miR-17),多种实体癌中表达上升。miR-17-5p 也是该簇中与癌症相关的研究最多的 miRNA 之一。许多证据表明,miR-17-92 簇可作为乳腺癌的一类新型癌基因或抑癌基因,在乳腺癌的肿瘤发生、转移中起作用。与正常组织相比,已在多种癌症中发现了miR-17-5p表达更高,例如大肠癌,胃癌,肝细胞癌,神经胶质瘤,基底细胞癌,胰腺癌,乳腺癌,骨肉瘤等[7-14]。miRNA具有稳定性,在可以在血清,血浆,尿液中检测到,稳定表达和易于获得的性质为其作为无创性标记物提供了可能。我们研究miR-17-5p在正常乳腺组织几乳腺癌中的表达情况,并对乳腺癌患者进行随访。
1 资料与方法
1.1 一般资料 选取2009年1月至2019年1月就诊于河北医科大第四医院乳腺中心576例浸润性乳腺癌患者,所有患者经病理证实。收集患者的病理资料及临床资料。对576例乳腺癌患者进行术后分期:Ⅰ期142例,Ⅱ期352例,Ⅲ期63例,Ⅳ期19例。
1.2 qRT-PCR RNA的提取 将取出的新鲜组织保存在液氮中,提取总RNA,逆转录:使用RNA模板与RT引物,加入逆转录酶,逆转录RNA,根据试剂盒说明测定miR-17-5p,并计算其相对表达量。
1.3 随访情况 采用门诊,电话和病历查阅方式对576例患者进行随访,以病例确诊时间开始计算生存时间,随访至2019年8月终止事件为患者死亡。随访时间为3~127个月,中位随访时间为70个月。
1.4 统计学分析 计数资料采用χ2检验和Fisher’s确切概率法,生存分析采用Kaplan-Meier生存曲线,通过Log-Rank法行生存率差别检验,并采用 Cox比例回归风险模型进行多因素生存分析。运用易侕软件建立患者生存率模型,P<0.05为差异有统计学意义。
2 结果
2.1 将miR-17-5p分为2组后患者人群分析 用X-tile软件将miRNA-17分为≥1 021与<1 021组。当当miR-17-5p高表达时,存活时间为(60.4±7.8)月,当miR-17-5p低表达时,存活时间为(75.2±7.0)月,差异有统计学意义(P=0.019)。说明的当miR-17-5p降低时,存活时间升高。见表1。

表1 将miR-17-5p分为2组后患者人群分析 例(%)
2.2 乳腺癌患者单因素分析 单因素分析,根据单因素分析可知,年龄,HER-2状态,是否绝经与miR-17-5p是均与预后相关(P<0.05)。见表2。
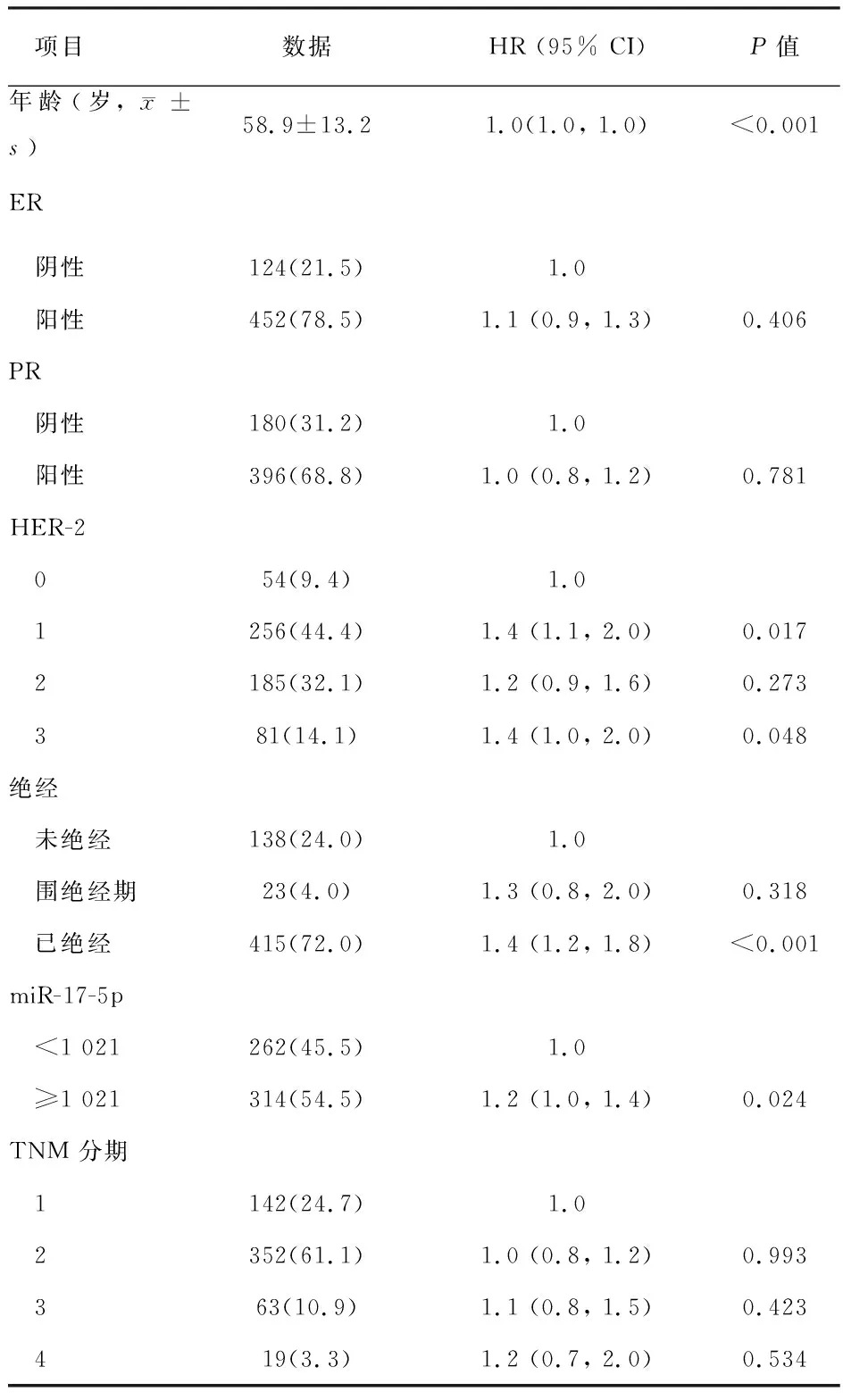
表2 乳腺癌患者单因素分析 例(%)
2.3 乳腺癌患者的多因素分析 多个回归方程分析可得,miR-17-5p是影响OS的独立预后因素(P<0.05)。见表3。
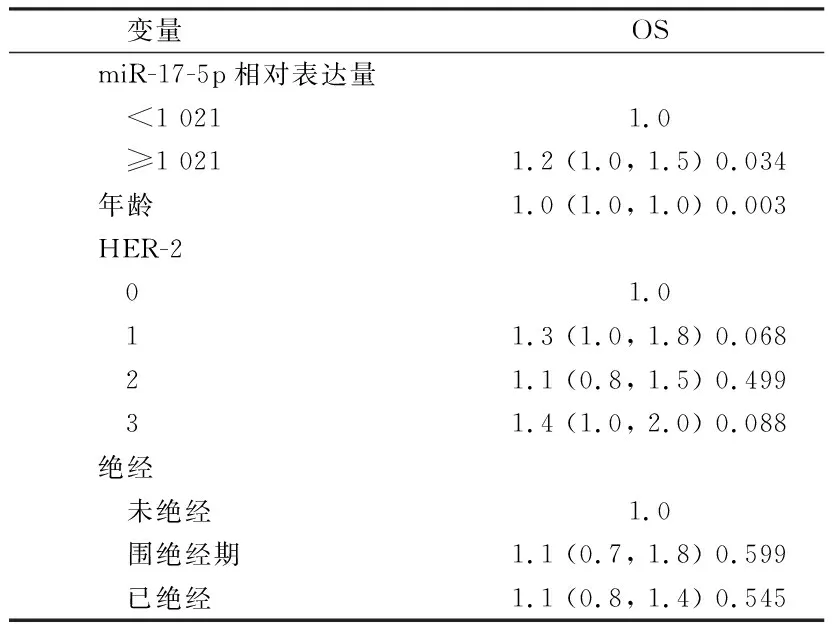
表3 乳腺癌患者的多因素分析
2.4 乳腺癌组织与良性乳腺组织miR-17-5p比较 乳腺癌组织和正常组织的中miR-17-5p的表达,可见乳腺癌组织miR-17-5p的相对表达量高于其在正常组织中的相对表达量(P=0.012)。见表4。

表4 乳腺癌组织与良性乳腺组织miR-17-5p比较
2.5 生存分析示 K-M曲线显示,相较于癌组织中miR-17≥1 021组,癌组织中miR-17<1 021组的患者生存率更高。见图1。

图1 miR-17-5p高表达与低表达的生存曲线
3 讨论
乳腺癌是国内外女性最常见肿瘤之一,近年来随着诊疗技术的进步乳腺癌患者预后得到改善,但仍有部分乳腺癌患者预后差,所以选择合适的指标来预示预后、诊断和治疗效果的标志物具有重要意义。在过去的十年中,已证实 miRNA 可以调节正常细胞中的多个关键细胞过程,包括细胞生长,细胞分化,细胞周期和细胞死亡。在癌症中miRNA 可以作为癌基因或抑癌基因来调节多种癌症,例如癌症耐药性,癌
细胞增殖和癌细胞转移。所有miRNA的成熟过程均始于细胞核[15,16]。在细胞核中,RNA聚合酶Ⅱ或RNA聚合酶Ⅲ转录基因形成初级miRNA,该初级产物部分碱基互补配对,不能配对部分形成环状结构,然后,Drosha及其辅助因子DGCR8作用下形成次级转录产物发夹pre-miRNA[17]。pre-miRNA通过输出蛋白5转运复合物的作用下输出到细胞质,被Dicer切开茎环的一段形成双链miRNA。双链miRNA的引导链在其5’端显示弱氢键,有利于其与RNA诱导沉默复合物 (RISC)中的Ago2结合,该引导链被认为是具有活性的成熟miRNA。与之相对的是过客链,过客链被认为是没有活性的,从而发生解离的和退化[18]。成熟miRNA通过Watson-Crick碱基配对特异性识别mRNA的靶区域,配对一般发生在成熟miRNA种子区域(miRNA引导链5’端的2至8位核苷酸)和靶mRNA的3’-非翻译区(3’UTR)。成熟miRNA与相关蛋白结合形成miRISC沉默复合物来发挥作用[19]。在RISC介导下,成熟miRNA与mRNA的3’UTR之间的完美互补,从而导致mRNA翻译抑制或降解[20,21]。此过程通常在细胞质中进行[22]。平均每个miRNA可以靶向识别数百种mRNA[23]。因此针对某一种miRNA寡核苷酸疗法可能会影响其他的基因。miRNA具有稳定性,在可以在血清,血浆,尿液中检测到,稳定表达和易于获得的性质为其作为无创性标记物提供了可能。
除转录调节剂外,miRNA也被认为是转移的关键调节剂。完整的表达相关性分析和预测的miRNA-mRNA相互作用确定了3个miRNA家族成员(miR-17,miR-200和miR-96)作为基底样肿瘤中前转移基因的阻遏物。与已报道抑制EMT的miR-200和miR-96家族成员不同,据报道,由MIR17HG编码的miRNA在乳腺癌转移进展中的作用令人争议,在癌症中广泛观察到异常表达的miRNAs,表明其致癌或抑制作用[15]。
miR17-5p,也称为miR-17和miR-17-92簇复合物的主要效应子,已被接受为固体癌miRNA的生物标志物。最近的数据表明,miR-230 17-5p通过PI3K/Akt/mTOR途径的231调控参与肿瘤的增殖。在三阴性乳腺癌中也观察到miR-17-5p的过表达。 miRNA可能在抑制抑癌基因的核糖体翻译中发挥作用。先前在高侵袭性MDA-MB-231乳腺癌细胞进行的研究表明,miR-17-5p通过 HBP1/Wnt/b-catenin途径参与乳腺癌的侵袭和迁移。miR-17-5p可能通过抑制E2F1的增殖活性来作为肿瘤抑制因子,它同时具有癌基因和抑癌作用。另外,通过BIM,p21和PTEN,miR-17-5p也被认为是关键的致癌性fac-分子。有研究表明ETV1是miR-17-5p的直接靶点[21]。鉴于观察到与ETV1相反,在TNBC细胞系和临床肿瘤组织中miR-17-5p被下调,推测miR-17-5p的上调将通过靶向靶向抑制三阴性乳腺癌细胞的致癌活性。ETV1和miR-17-5p异常可能与TNBC患者的预后有关。ETV1通过激活MMP,COX-2和VEGF表达来促进肿瘤发生活性,研究表明,ETV1在TNBC中起癌基因的作用,并且可能是患者的独立,不良预后指标[17]。高表达的miR-17通过抑制ETV1蛋白的翻译增强黑色素瘤细胞的运动性和迁移,这可能支持转移的发展。但是,GIST中的miR-水平明显较低。 GIST细胞系中miR-17的上调通过降解ETV1 mRNA抑制细胞增殖,这可能抑制肿瘤的进展。这些结果表明,即使一个miRNA靶向相同的基因,它也可能以依赖细胞类型和环境的方式起癌基因或抑癌基因的作用。研究检测到miR-17-5p和ETV1在TNBC细胞系和肿瘤组织中的反向表达模式。增强miR-17-5p在TNBC细胞系中的表达,不仅显着降低ETV1的表达,而且抑制细胞增殖,迁移和侵袭,这可能会抑制TNBC的发育。此外,在存在miR-17-5p的情况下挽救ETV1表达可显着恢复细胞表型。这些结果表明,miR-17-5p可能通过调节ETV1表达来影响TNBC的行为。使用成熟的斑马鱼转移模型的体内试验进一步支持了这一点。结果表明,可能存在一个信号通路,即c-Myc/p53-miR-17-5p-ETV1-MMP,COX-2和VEGF,在TNBC发展中发挥作用。此外,COP1的过表达可显着降低ETV1的水平,并改变TNBC细胞表型。MYC是MIR17HG的主要转录激活因子。这与MIR17HG和MYC的表达水平在乳腺肿瘤中紧密相关的发现一致。由于MYC普遍增强了给定细胞中所有活性基因的转录,因此MYC下调的基因可能是MYC激活的转录阻遏物或miRNA的靶标。有趣的是,有研究发现MYC的表达与含有MIR17HG-miRNA靶位点的促转移基因的表达呈负相关。有研究提出MIR17HG-miRNA通过靶向参与EMT的基因/途径在维持MYC驱动的增殖状态中发挥作用,该过程可以通过TGFB激活被多种压力激活,并与MYC失活和细胞生长相关。这与MYC抑制细胞侵袭性迁移和肿瘤转移的先前观察一致。
在本研究表明癌组织miR-17-5p相对表达量高于正常乳腺组织的表达量,在乳腺癌患者中生存分析显示当miR-17-5p降低时,OS升高,多因素分析显示miR-17-5p是影响患者预后的独立危险因素,本研究结果符合多数研究。Lee等[24]的研究表明,miR-17-5p促进转移性癌细胞的迁移和侵袭,靶向抑制化生长因子-β(TGF-β)信号通路促进乳腺导管原位癌向乳腺浸润性导管癌的转化。值得一提的是TGF-β在乳腺癌的肿瘤发生中具有悖论,它在良性乳腺上皮中起到抑癌作用,但在乳腺组织中转化为恶性组织时却起到促进肿瘤转化的功能[24],可能正是TGF-β信号通路的这种复杂性,造成某些靶向抑制TGF-β信号通路,却得到相反结果。Li等[25]的研究表明miR-17-5p在高侵袭性MDA-MB-231乳腺癌细胞中高表达,而在低侵袭性MCF-7乳腺癌细胞中不高。miR-17-5p 在 MCF-7细胞中的过表达使它们具有侵袭和迁移能力,miR-17-5p 的下调抑制了MDA-MB-231细胞的迁移和侵袭。这一过程可能通过靶向 HBP1/β-catenin 途径,miR-17-5p通过抑制HBP1而导致Wnt/β-catenin 活化,BP1通过抑制LEF/TCF转录因子来抑制Wnt/β-catenin信号传导。Wnt信号传导中的基本事件是 β-catenin稳定存在,由此产生β-catenin积累,从而增加了细胞核中β-catenin含量,于是β-catenin与转录因子TCF/LEF结合并激活某些基因,例如 Cyclin D1,c-Myc,SDF1 和 Twist,进一步促进肿瘤细胞的增殖、侵袭。 值得一提的是,HBP1的功能丧失已被证明与浸润性乳腺有关[26]。因此,HBP可能在乳腺癌进展中起重要作用,并且可能是预防和治疗乳腺癌的潜在靶点。除此之外,miR-17-5p还可以调节 p21,PTEN和BIM的表达,起关键的致癌因子的作用。Li等[25]的研究证明miR-17-5p抑制抑癌基因的mRNA,例如PDCD4(程序性细胞死亡4)和PTEN(磷酸酶和张力蛋白同源物),因此,miR-17-5p被认为是致癌的miRNA[27]。肿瘤抑制蛋白PDCD4和PTEN通常在TNBC中被抑制,与miRNA水平升高相关[28]。
除此之外,miR-17-5p可以广泛参与炎症、细胞脂化等进程。miR-17-5p 的异位表达可以通过抑制 PPAR-α 表达来促进脂肪肝的发展,诱导脂肪变性和肝硬化[29]。可以在很早的时候甚至在肝硬化阶段被用作 HCV 阳性 HCC 的新型非侵入性生物标志物[30]。子宫内膜异位症的女性血浆 miR-17-5p呈现下调趋势[31]。
总之,miR-17广泛参与细胞增殖,分化的过程,并且在肿瘤发生和发展中起到重要作用,本研究表明mir-17-5p相较于正常组织,在乳腺癌组织中高表达,且表达越高,生存时间越短,发挥促癌作用,但其表达促癌或抑癌作用根据其靶向的mRNA不同而发挥不同作用,至今Mir-17直接靶向的下游蛋白探索仍不够全面,需要我们进一步发掘。

