体表心电图房间阻滞在阵发性房颤患者中的临床意义
佘飘飘 张勇 王俊 汪祥海 王德国
房颤是临床最常见的心律失常,其主要危害是引起心房血栓的形成,继而诱发脑栓塞[1]。然而常规心电图检查房颤的效率并不高,长时程的心电监测(如Holter)房颤检出率成倍增高,这意味着人群中大量未被诊断的房颤患者具有潜在的血栓栓塞风险[2]。通过临床最易获得的体表心电图筛选房颤高危患者有很大价值,P波参数可提供心房心电信息,对阵发性房颤(paroxysmal atrial fibrillation,PAF)有预测价值[3]。最新研究发现,心房中Bachmann束功能受损可引起房间阻滞(interatrial block,IAB),且其与房颤发病密切相关[4]。IAB在体表心电图表现为P波增宽,其发生率在总人群中较高,尤其是老年人则更高[5]。一直以来IAB没有受到应有的重视,新近研究显示IAB可能与房性心律失常、房颤、心房心肌病等相关[4,6]。因此,本研究拟对比观察窦性节律下确诊的PAF患者与非PAF患者IAB的发生情况,以探讨IAB的临床价值和意义。
1 资料与方法
1.1 临床资料
收集2014年1月至2018年12月在我院就诊并确诊为PAF的患者287例为PAF组,年龄(55.5±11.1)岁;对照组为同期非房颤患者133例,年龄(57.9±12.3)岁。PAF入选标准:既往病史和心电图检查明确为心房颤动,当前为窦性心律。排除标准:① 持续性房颤和慢性房颤;② 伴随甲状腺功能异常者;③ 高钾血症;④ 植入心脏起搏器者;⑤ 预激综合征。详细询问患者病史和临床表现,临床资料详见表1。
1.2 心脏超声指标
所有入选者的心脏超声由专业的超声医师按标准测量,由心脏科医师分析相关参数[7]:左心房内径(left atrial diameter,LAD)、左室舒张末期内径(left ventricular end-diastolic dimension,LVDd) 、左室收缩末期内径(left ventricular end-systolic dimension,LVDs) 、左室缩短率(left ventricular fraction shortening,LVFS)、左心室射血分数(left ventricular ejection fraction, LVEF) 、左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)及室间隔厚度(interventricular septal thickness,IVS)。
1.3 心电图指标
由两位不了解患者疾病信息的心脏科医生测量并计算入选者标准12导联心电图参数。房颤心电图标准[3]:P波消失,代之以小而不规则的f波,频率约为350~600次/min,心室率绝对不规则。P波时限测量额面导联P波最早起点到最晚终点间距离为P波宽度。根据报道的方法对P波分类[8]。① 正常P波:P波时限<120 ms。② 不完全房间阻滞(partial IAB,p-IAB):P波时限≥120 ms,且下壁导联P波正立。③ 高度房间阻滞(advanced IAB,a-IAB):P波时限≥120 ms,且下壁导联P波双向。
1.4 统计学处理
2 结果
2.1 两组间临床基本资料的比较
本研究中入选患者的年龄及合并高血压、糖尿病情况差异无统计学意义;PAF患者中男性及合并冠心病者比例较高(P<0.05)。PAF组患者较非PAF组左心房内径增加[(38.3±5.5)mmvs. (32.6±4.9)mm,P<0.01];两组间IAB发生率有显著差异(p-IAB: 39.4%vs. 28.3%;a-IAB: 24.4%vs. 8.3%,P均<0.01)。见表1。

表1 患者一般临床资料Tab.1 General clinical data of patients
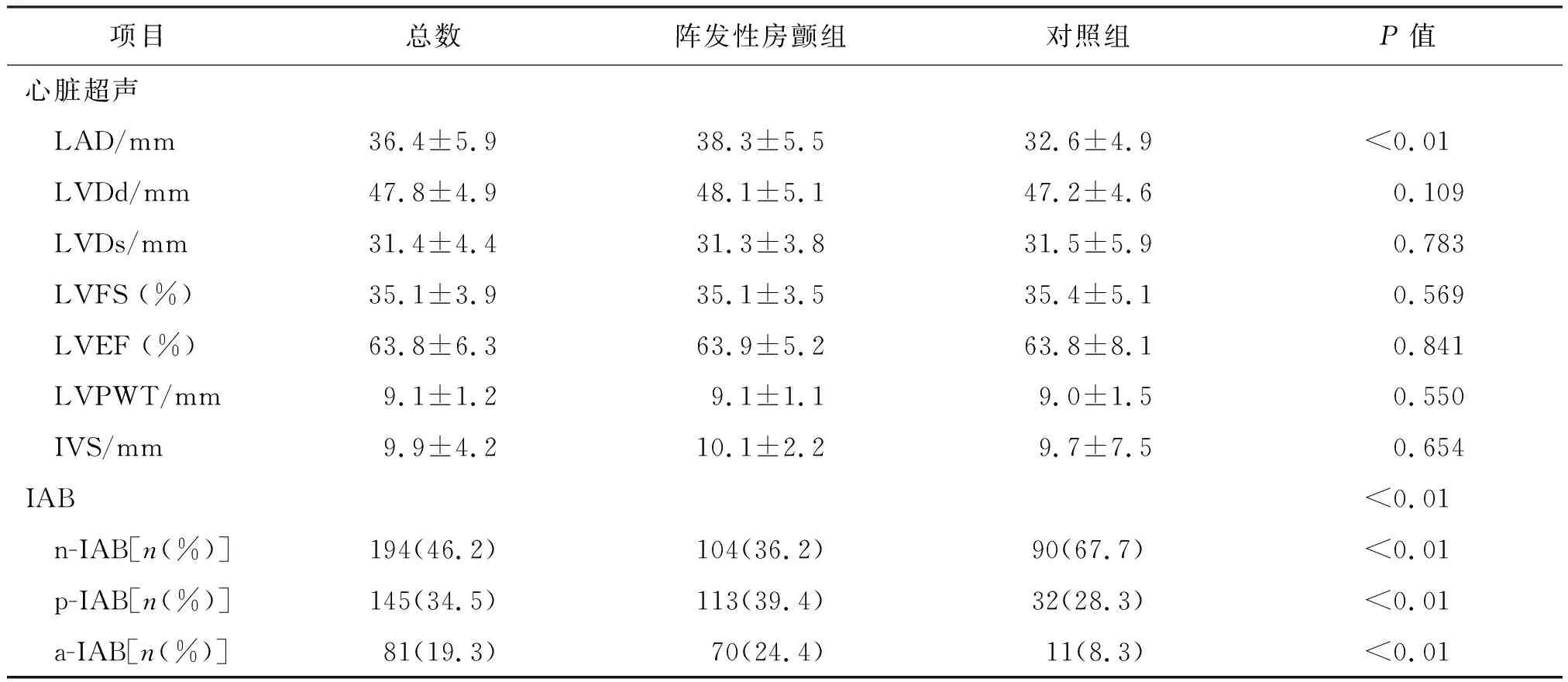
续表1
2.2 阵发性房颤与其他因素的相关性分析
如表2所示,相关性分析显示阵发性房颤与性别、年龄、冠心病、左心房内径、左心室后壁厚度、室间隔厚度以及房间阻滞显著呈正相关(P<0.05)。
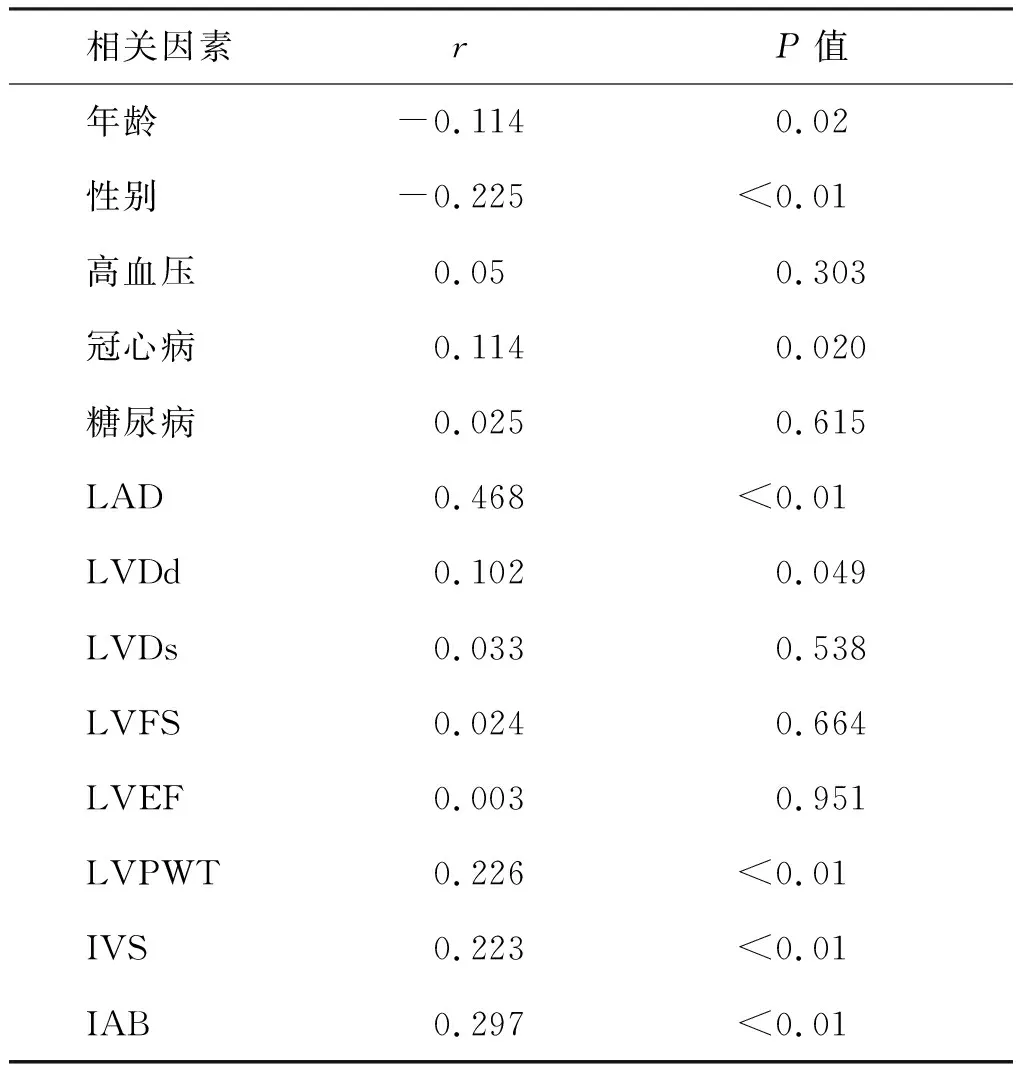
表2 阵发性房颤的相关因素分析Tab.2 Correlation analysis of paroxysmal atrial fibrillation
2.3 阵发性房颤相关因素多元回归分析
如表3所示,以阵发性房颤为因变量,将年龄、性别、高血压、冠心病、糖尿病、左心房内径、左心室射血分数、房间阻滞为协变量进行多因素Logistic回归分析,结果显示:性别(OR=0.468,95%CI为0.279~0.786,P=0.004)、左心房内径(OR=1.251,95%CI为1.182~1.325,P<0.01)、房间阻滞(OR=2.443,95%CI为1.659~3.596,P<0.01)是阵发性房颤的独立相关因素,提示男性、房间阻滞、左心房内径增大者发生阵发性房颤的风险更大。
3 讨论
房颤的主要危害在于引起血栓栓塞,而抗凝治疗是降低房颤相关卒中的关键。常规心电图检查是当前广泛使用的心脏疾病筛查方法,与Holter相比心电图对PAF的检出率不高[2]。本研究在既往研究基础上探讨IAB对PAF的预测价值。
IAB是心房电传导到左心房时发生延迟,其与室上性心动过速密切相关,对严重心衰、房颤复律以及房颤消融术后患者再发房颤有很重要的预测价值[9]。Bachmann束是左右心房间快速电传导通道,炎症、代谢异常、心血管疾病及其危险因素、肺疾病等均可损伤Bachmann束,导致心房纤维化和IAB[10]。Bachmann束轻度受损引起传导延缓,左心房电激动延迟而表现为P波增宽(P>120 ms),部分呈现典型的尖-圆顶样双峰P波改变(p-IAB)。当Bachmann束严重受损导致传导中断,右心房电活动只能经过房间隔延迟向左心房传导,心电图不但出现P波增宽(P>120 ms),也表现为下壁导联心电图P波双向,尤其是Ⅱ、aVF导联P波的终末部分呈现典型的负向波,即高度房间阻滞(a-IAB)[11]。
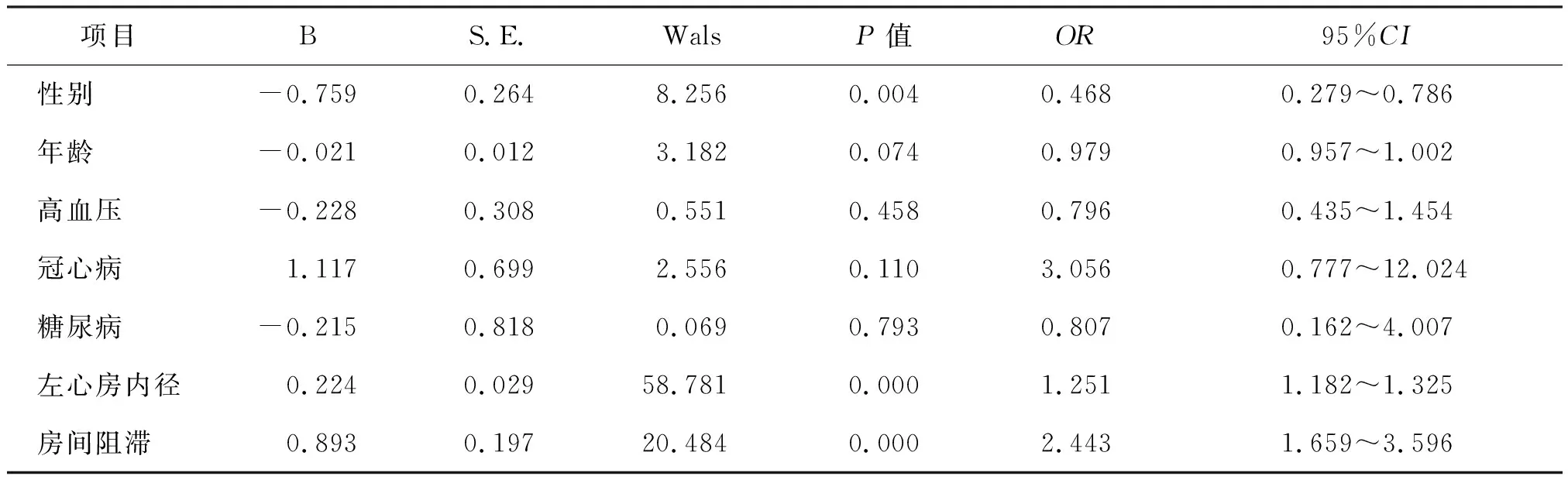
表3 阵发性房颤的多元Logistics回归分析Tab.3 Multivariant Logistics regression analysis of paroxysmal atrial fibrillation
IAB在人群中发病率不低,有报道指出IAB与心血管风险因子(如年龄、男性、高密度脂蛋白升高、高体质指数、高收缩压等)密切相关,可以预测患者后期发生房颤的风险[6]。影像学检查提示,IAB与心房纤维化及心房壁僵硬度增加密切相关,而这种心房异常改变也是房颤的危险因素[12]。在本研究中发现,PAF患者a-IAB(24.4%vs. 8.3%)与p-IAB(39.4%vs. 28.3%)发生率显著高于对照组。心脏超声检查也发现,PAF患者左心房内径显著大于对照组,提示导致心房结构损伤的因素可能也会引起Bachmann束损伤,从而造成左心房重构和IAB。
IAB很容易在常规心电图中判断出,如其对检出率不高的PAF有较好的判断作用,则对房颤相关卒中的预防有重要价值。研究表明,IAB可预测心衰患者房颤与缺血性卒中的发生[1],大型临床数据分析也表明总人口中a-IAB的年发生率高达1.3%,且a-IAB导致新发房颤的风险为3.09(95%CI为2.51~3.79)[6]。Meta分析表明,IAB(尤其是a-IAB)患者新发房颤风险增加2倍,是房颤的独立预测因素[13]。本研究将患者心脏超声、IAB以及PAF常规风险因素如年龄、性别、高血压、冠心病、糖尿病等纳入多因素回归分析,结果显示左心房扩大和IAB是PAF的独立危险因素,而女性则是PAF的保护因素。心电图比心脏超声更容易在社区和体检中心普及,更适合用于临床PAF的筛查,即对于常规心电图呈IAB患者,建议其进行更长时程的心电图监测。
房颤患者因抗凝治疗而临床获益,新近有研究发现在高龄人群中,在无房颤诊断的高CHA2DS2-VASc评分者并发IAB时出现高血栓栓塞及脑血管事件风险[14]。由于PAF的检出率较低,这些高CHA2DS2-VASc评分并发IAB者可能是未检测到的PAF患者,因此IAB患者也可能在抗凝治疗中获益。然而,迄今为止还没有关于IAB患者抗凝治疗的随机对照研究。临床检测IAB只需要借助简单的标准12导联心电图,在研究中容易实现。进一步探讨IAB与心脑血管疾病的关系将有助于IAB的早期干预,具有重要的临床意义。
综上所述,本研究显示PAF组患者IAB发生率显著高于非PAF对照组,IAB与PAF呈显著正相关,是PAF的独立危险因素。因实际临床医疗中常规心电图对房颤的检出率不高,而IAB容易分析获得,可作为PAF的初步筛查指标,对预防PAF相关心脑血管事件有重要临床价值。

