滇水金凤CHI基因的克隆及表达分析
李 洋,黄武略,林福永,罗 超,李新艺,刘应丽,朱佳鹏,冯志熙,黄美娟,黄海泉
(西南林业大学 园林园艺学院/园林园艺花卉研发中心/云南省功能性花卉资源及产业化技术工程研究中心,云南 昆明 650224)
【研究意义】花色是园林植物重要的观赏性状,一直是育种工作者追求的重要目标性状[1]。植物的花色素在花色生成过程中占据着重要的地位,按特点主要分为生物碱(alkaloid)、类胡萝卜素(carotenoid)和类黄酮(flavonoid)3种,其中类黄酮是存在于绝大多数植物中的一种酚类化合物,对花色形成的影响最为广泛[2]。花色苷(anthocyanin)是类黄酮化合物的重要组成部分,在植物的各个部位均有分布[3-4],与植物花、叶、果实的呈色息息相关[5-6],在植物的防御与进化进程中也发挥着重要作用。CHI基因是花色苷合成途径中关键的酶基因,主要编码查尔酮异构酶(chalcone isomerase,CHI),在类黄酮化合物的合成中起着关键作用[7-8]。滇水金凤(Impatiens uliginosa)是凤仙花科(Balsaminaceae)凤仙花属(Impatiens)的一年生草本植物,主要分布在我国西南地区,多生于湿地浅水中,花开茂盛,抗性强,繁殖速度快,花形奇特,颜色绚丽,在园林上有一定的应用价值。【前人研究进展】CHI基因先后从芸豆(Phaseolus vulgaris)、金鱼草(Antirrhinum majus)、矮牵牛(Petunia hybrida)等多种植物中分离出来用以研究其功能作用[9-15],且已有大量通过改变CHI基因的表达以改变植物花色的报道,如抑制CHI基因的表达会使康乃馨(Dianthus caryophyllus)[16]、仙客来(Cyclamen persicum)[17]、烟草(Nicotiana tabacum)花瓣中查尔酮的含量上升,花色变黄[18]。赵芮等[19]首次从滇水金凤中分离克隆出AGAMOUS基因研究其花型结构及发育。黄奇等[20]通过对不同颜色滇水金凤花瓣中金属元素的含量进行测定,探索了不同含量的金属元素是否对滇水金凤花色的形成具有影响[21-22]。【本研究切入点】当前对CHI基因的研究主要集中在查尔酮异构酶的催化作用、类黄酮物质水平的提高、花色代谢和园林植物的改良等[23-25]。迄今为止,国内外对滇水金凤花色变异的分子机理尚未见相关报道。【拟解决的关键问题】本研究在克隆得到滇水金凤CHI基因的基础上,对其进行序列分析和表达分析,为滇水金凤花色形成的机理提供了基础数据,为进一步研究凤仙花属植物的花色改良和新品种选育提供了理论依据。
1 材料与方法
1.1 试验材料
所用植物材料为红色和白色的野生滇水金凤,采集于昆明市捞鱼河湿地公园和阿子营。所用试剂材料主要有植物总RNA 提取试剂盒(百泰克)、胶回收试剂盒和逆转录试剂盒(全式金)、DH5α菌株(TIANGEN)、PMD18-TVector 连接载体(TAKARA)和荧光染料(翊圣)等。本试验引物由昆明硕擎生物科技有限公司和生工生物工程(上海)股份有限公司合成。
1.2 试验方法
1.2.1 总RNA的提取和CHI基因的克隆 根据转录组数据分别设计扩增全长的特异性引物(表1)。
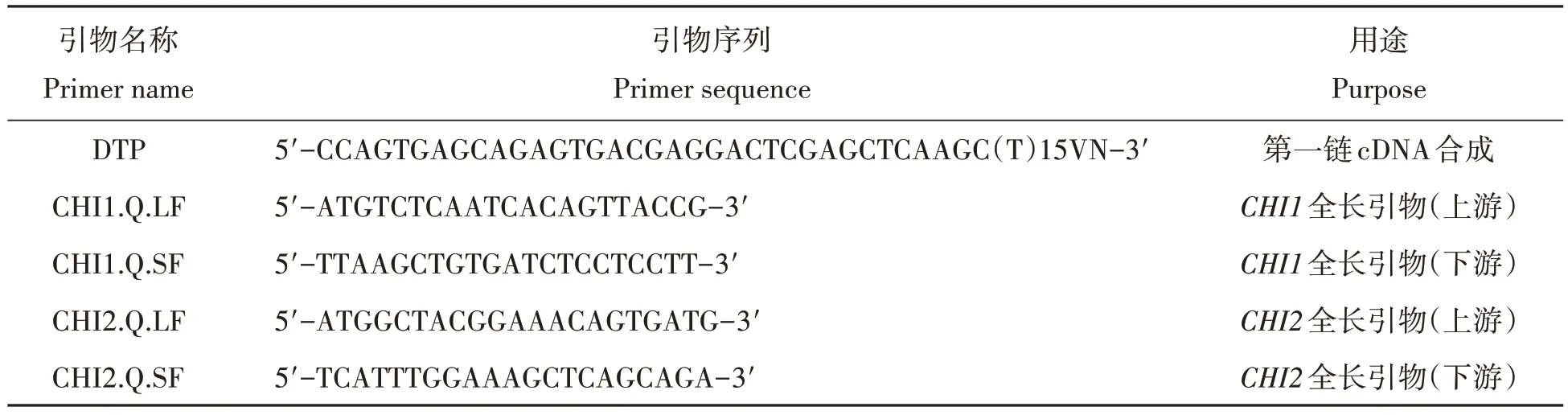
表1 滇水金凤CHI基因cDNA序列扩增引物Tab.1 Relevant primer sequences of CHI gene cDNA amplification in Iupatiens uliginosa
提取滇水金凤花瓣总RNA,以RNA 逆转录合成的cDNA 第一链作为模板进行CHI基因全长cDNA扩增。PCR 反应体系:10×Easy Taq Buffer 2 µL,High Pure dNTPs 1.6 µL,MgCl20.4 µL,模板1 µL,引 物 各1 µL,Easy Taq DNA Polymerase 0.2 µL,ddH2O 补足至20 µL。PCR 反应程序:95 ℃预变性5 min,95 ℃变性50 s,第一轮53 ℃退火30 s,第二轮58 ℃退火30 s,72 ℃延伸1 min,35 个循环,72 ℃总延伸10 min,4 ℃保存。
1.2.2CHI基因序列分析 利用NCBI 的BLAST 功能找出与滇水金凤CHI基因同源性高的各物种氨基酸序列,运用DNAMAN 软件进行序列同源性分析,使用MEGA-X软件构建系统发育树。
1.2.3CHI基因表达模式分析 分别取4 个花发育时期(花苞期、花苞开放期、盛花期和谢花期)(图1)的白色和红色滇水金凤的花器官提取其RNA,逆转录合成的cDNA第一链稀释10倍用作qRT-PCR模板。设计qRT-PCR的引物(表2),内参基因为IuActin。采用2 步法进行荧光定量PCR 检测,每个样品进行3 个重复,将花蕾期定义为1 个单位作为对照,以2 种花色及4个时期作为横坐标,各基因的表达量作为纵坐标建立坐标轴,对目的基因在各个花色、各个时期的表达量进行相对定量分析。
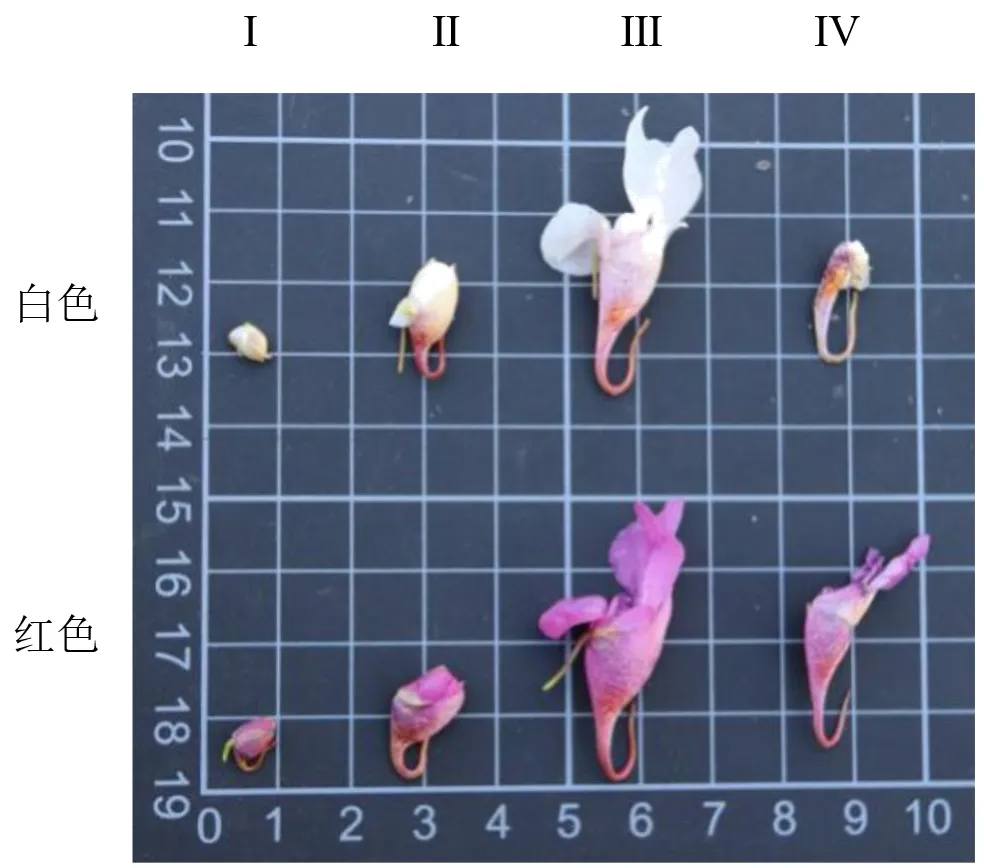
图1 滇水金凤白色花和红色花的4个时期Fig.1 Four stages of white and red flowers of Impatiens uliginosa
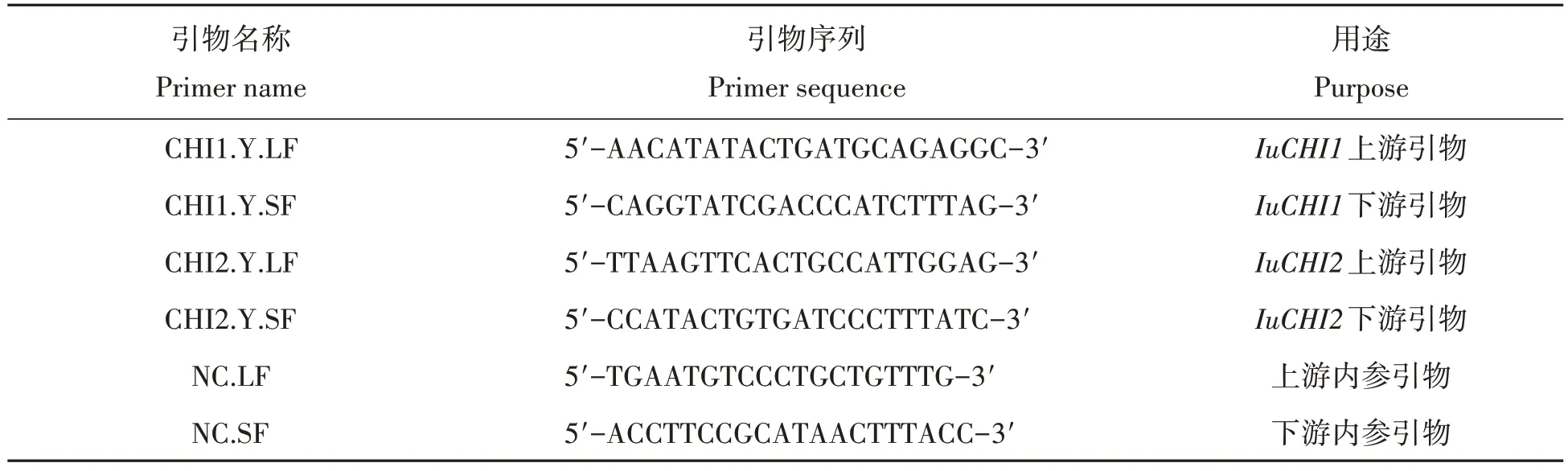
表2 滇水金凤CHI基因荧光定量特异引物Tab.2 Specific primer of Real-time PCR of CHI in Iupatiens uliginosa
2 结果与分析
2.1 滇水金凤CHI基因的克隆
经PCR扩增(图2),获得IuCHI1基因全长cDNA序列741 bp,IuCHI2基因全长cDNA序列636 bp(图3)。
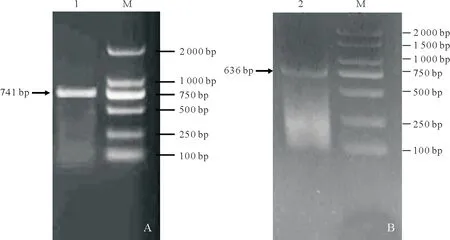
图2 CHI基因PCR扩增结果Fig.2 The PCR product of CHI genes

图3 IuCHI基因全长cDNA序列Fig.3 The full-length cDNA sequence of IuCHI genes
2.2 滇水金凤CHI基因的序列同源性分析及系统进化分析
通过protein BLAST 进行序列同源性比对,发现滇水金凤CHI基因氨基酸序列与茶(ASU87415.1)、橄榄(AEO36936.1)、甜樱桃(XP_021801593.1)、扁桃(VVA18533.1)等12 个物种CHI基因的氨基酸序列同源性较高,其平均同源性达到55.99%(图4)。通过构建系统进化树,发现滇水金凤CHI1和CHI2共同存在于一个大的分枝下,两个基因均是单独一个分枝,与滇水金凤CHI1亲缘关系最近的是橄榄,而与滇水金凤CHI2亲缘关系最近的是金花茶,推测二者为旁系亲缘关系(图5)。

图4 滇水金凤CHI基因氨基酸序列同源性对比Fig.4 Homologous amino acid sequence alignment of CHI genes of Impatiens uliginosa
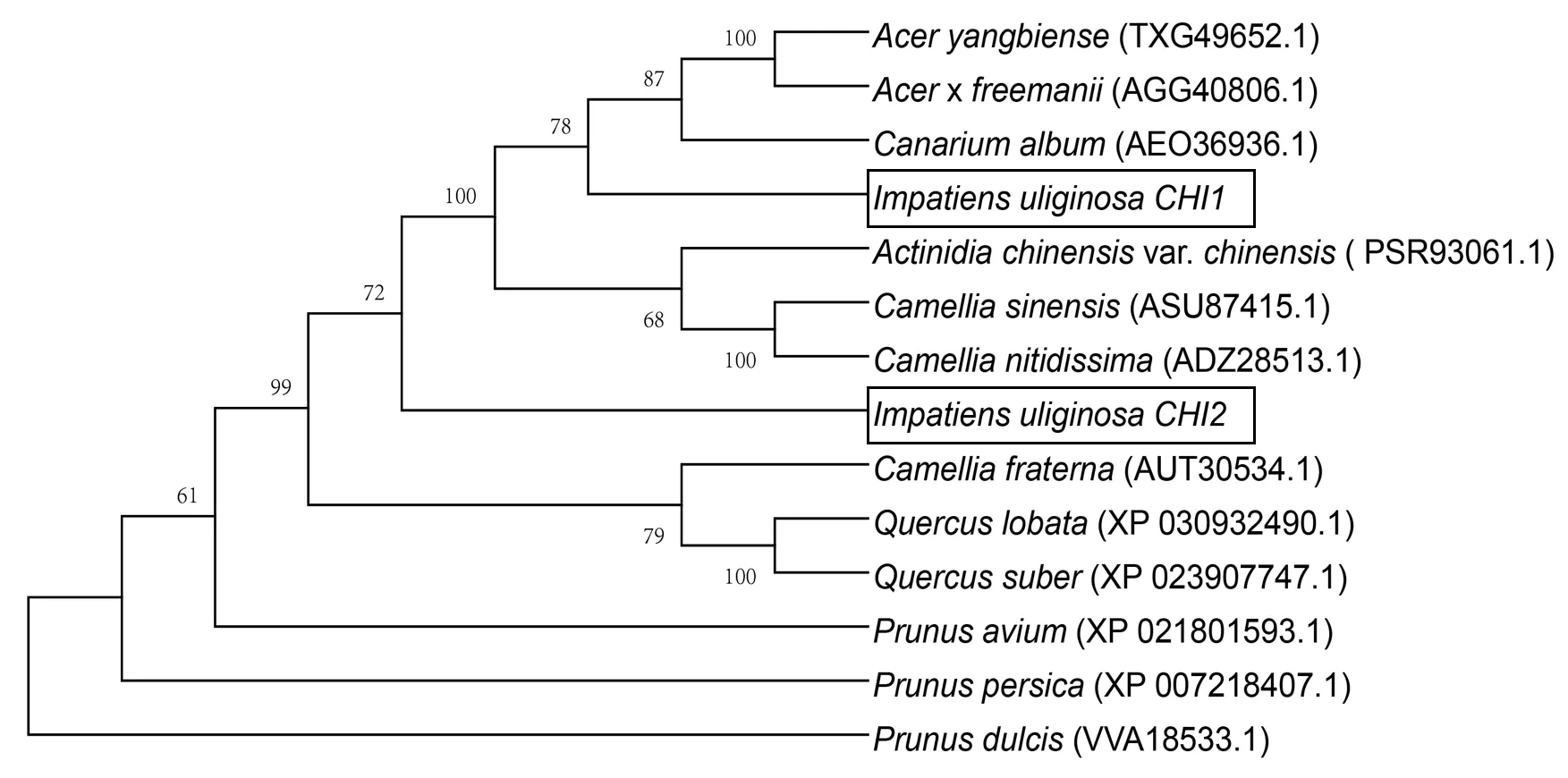
图5 基于IuCHI基因氨基酸序列构建系统进化树(NJ 法)Fig.5 Phylogenetic tree based on IuCHI gene amino acid sequences
2.3 滇水金凤CHI基因的表达分析
CHI基因在滇水金凤白色花和红色花的4 个花发育时期的表达情况如图6 所示。IuCHI1和IuCHI2的表达表现出一致性,均在红色花中呈现逐渐上升趋势,而在白色花中呈现出降低-升高-降低的趋势,且在红色花的谢花期和白色花的盛花期表达最高,分别为花苞开放期的22倍和18倍。
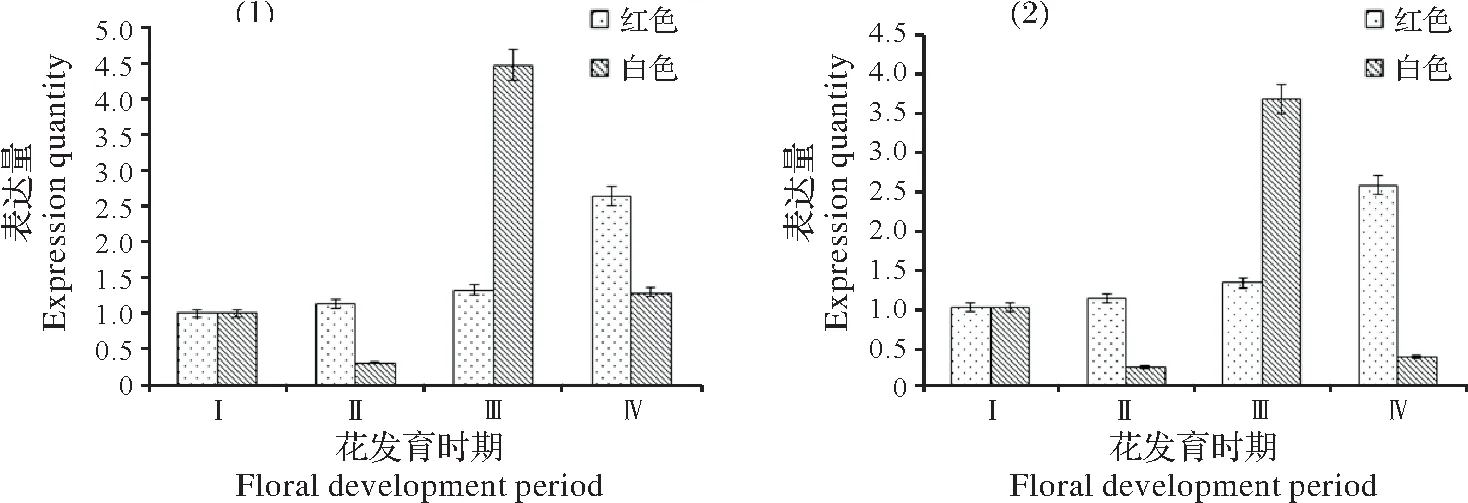
图6 滇水金凤CHI基因在白色和红色滇水金凤4个时期的相对表达Fig.6 The relative expression level of CHI genes in four stages of white and red I.uliginosa
3 结论与讨论
本研究克隆得到2个滇水金凤CHI基因,其cDNA 全长分别为741 bp和636 bp。IuCHI1和IuCHI2的氨基酸序列与茶、橄榄、甜樱桃、扁桃等12 个物种CHI基因的氨基酸序列的平均同源性达到55.99%,有报道表明CHI基因在结构上存在较大变化,其cDNA 序列的同源性一般为42%~65%[26],不同的CHI基因即使在同一物种内也会存在较大差异[7]。IuCHI1和IuCHI2在系统进化树中均为单独的一个分枝,且二者处于同一个大分枝之下,推测二者为旁系亲缘关系。CHI基因在有色花红色滇水金凤花瓣的4个发育时期表达量呈持续上升趋势,推测可能与红色花色苷的积累有关;而在无色花白色滇水金凤中,CHI基因在盛花期的表达量远大于其他3个时期,推测可能与黄酮类物质的积累有关。
CHI基因是花青素合成过程中处于上游的第2 个基因,会对下游基因的表达产生重要的影响,进而影响到花色素苷的积累和植物的颜色。研究表明,将甘蓝型油菜(Brassica napus)CHI基因的RNAi 载体导入甘蓝型油菜黑籽品种双10 号中,其花蕾期的花瓣颜色减弱[27]。将水母雪莲(Saussurea medusa)CHI基因的正义表达载体转入矮牵牛中,其花色由深红色变为浅粉红色,并带有网状纹路和白色斑块,柱头也由深绿色变为浅绿色[28];在新疆雪莲(Saussurea involucrata)中转水母雪莲CHI基因会使其发根中总黄酮含量提高了4倍[29];而转入水母雪莲CHI基因的烟草总黄酮含量提高了5倍[30]。本研究对滇水金凤CHI基因在不同花色、不同花发育时期的表达模式进行了探究和分析,为后续进行CHI基因的功能验证奠定了基础,以进一步探究CHI基因在滇水金凤呈色过程中的调控机制,为研究滇水金凤花器官的呈色及变异机理和凤仙花花色改良和分子育种提供了一定的理论依据。
致谢:云南省高校园林植物与观赏园艺科技创新团队对研究给予了帮助,谨致谢意!

