多囊卵巢综合征患者血清抗苗勒氏激素与代谢综合征的关系
姚守润,崔海斌,孔令丹
1.武警陕西省总队医院卫勤处,陕西 西安 710054;2.北京市第六医院妇产科,北京 100010
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是最为常见的育龄女性内分泌紊乱行疾病,全球范围内,该病发病率为5%~10%。此外,实验室检查可见患者雄激素水平增高、胰岛素水平增高以及胰岛素抵抗。研究多认为PCOS发病与糖代谢异常、遗传变异等因素有关[1]。抗苗勒氏管激素(anti-Mullerian hormone,AMH)水平在PCOS患者中相对更高,能够从一定程度上对PCOS患者的病情起到一个评价作用。代谢综合征(metabolic syndrome,MS)是一组以脂质代谢、糖代谢紊乱、血压增高、腹型肥胖为主的代谢紊乱症候群。该病病因并未明确,在临床上表现复杂多样,临床诊断标准也尚未统一。但由于代谢综合征的存在,患者心血管疾病发病率以及糖尿病发病率必将增高[2-3]。而从临床表现上不难看出,PCOS与MS存在诸多共同特征,且PCOS患者中,合并MS者不在少数,因此,对PCOS患者是否同时合并MS进行甄别,并提前对PCOS合并MS患者进行早期干预和治疗,对于疾病的管理将具有重要的意义[4]。本研究主要探讨PCOS患者血清AMH水平与MS异常代谢相关指标的关系,旨在分析AMH预测PCOS患者发生心血管疾病及脂质代谢紊乱的价值。
1 资料与方法
1.1 一般资料 回顾性分析2017年2月至2019年2月在武警陕西省总队医院就诊的110例PCOS患者的临床资料,根据是否合并MS将患者分为合并MS组57例和未合并MS组53例。患者年龄21~38岁,平均(28.2±2.8)岁。所有患者均符合PCOS的诊断标准,排除糖尿病及其他内分泌疾病者以及卵巢相关性的其他疾病者。
1.2 诊断标准
1.2.1 PCOS诊断标准[5]所有患者PCOS诊断参照2003年鹿特丹共识,符合以下3项中至少2项:①排卵稀发,或无排卵,每年月经少于8次,或月经周期超过35 d;②生化指标高雄激素血症,痤疮评分超过2分,或多毛mFG评分高于8分,总睾酮超过26 mmol/L,游离睾酮超过6.0 pg/mL,同时临床上表现为痤疮、多毛、脱发等;③超声检查中发现,卵巢多囊,在一侧卵巢内,直径为2~9 mm的卵泡在12个以上,或整个卵巢的体积在10 cm3以上。本研究中所有患者均行促甲状腺激素(TSH)、催乳素(PRL)、皮质醇、促肾上腺皮质激素(ACTH)、17-羟孕酮(17-OPH)等实验室指标的检测,用以除外甲状腺疾病、高泌乳素血症、分泌雄激素的肿瘤以及库欣综合征等可能导致雄激素增高或影响排卵的疾病。
1.2.2 MS诊断标准[6]根据国际糖尿病联盟(International Diabetes Federation,IDF)2005年MS诊断标准:腰围(WC)在80 cm以上并同时符合以下4项中至少2项:①空腹血糖(FBG)增高(>5.6 mmol/L),或者在这之前就已经诊断为糖尿病(DM);②血压增高[收缩压(SBP)>130 mmHg(1 mmHg=0.133 kPa)和/或舒张压(DBP)>85 mmHg],或者在这之前就已经诊断为高血压病;③高密度脂蛋白水平降低(<1.29 mmol/L);④甘油三酯(TG)增高(>1.7 mmol/L)。
1.3 观察指标与检测方法
1.3.1 人体测量学标准参数测定 年龄、身高、体质量、腰围、臀围、收缩压及舒张压等数据的测量均由同1名接受过正规培训的人员进行。相关指标的计算方法:①体质量指数(BMI)=体质量(kg)/身高2(m2);②腰臀围比(WHR)=腰围(cm)/臀围(cm)。
1.3.2 相关内分泌指标测定 ①采用化学发光法对雌二醇(E2)、雌激素(FSH)、睾酮(T)、卵泡黄体生成素(LH)、泌乳素(PRL)等性激素水平进行测定;②使用全自动生化分析仪对空腹血糖(FPG)、总胆固醇(TC)、高密度脂蛋白(HDL)、极低密度脂蛋白(VLDL)、低密度脂蛋白(LDL)、载脂蛋白a(Apo-a)、载脂蛋白b(Apo-b)进行检测;③采用电化学发光免疫分析法对胰岛素(INS)进行测定。
1.3.3 血清AMH水平检测 采用酶联免疫吸附实验法、德国贝克曼化学公司生产的试剂盒进行检测。
1.4 统计学方法 应用SPSS19.0统计软件进行数据分析,计量资料均经正态分布检验,且符合正态分布,以均数±标准差(±s)表示,组间比较采用t检验,相关性分析采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 合并MS组与未合并MS组患者的各项指标比较 两组患者的BMI、WHR、SBP、DBP、FBG、INS、HOMA-IR、TC、TG、HDL、LDL、AMH比较差异均具有统计学意义(P<0.05),而其他指标比较差异均无统计学意义(P>0.05),见表1。
表1 合并MS组与未合并MS组患者的各项指标比较(±s)
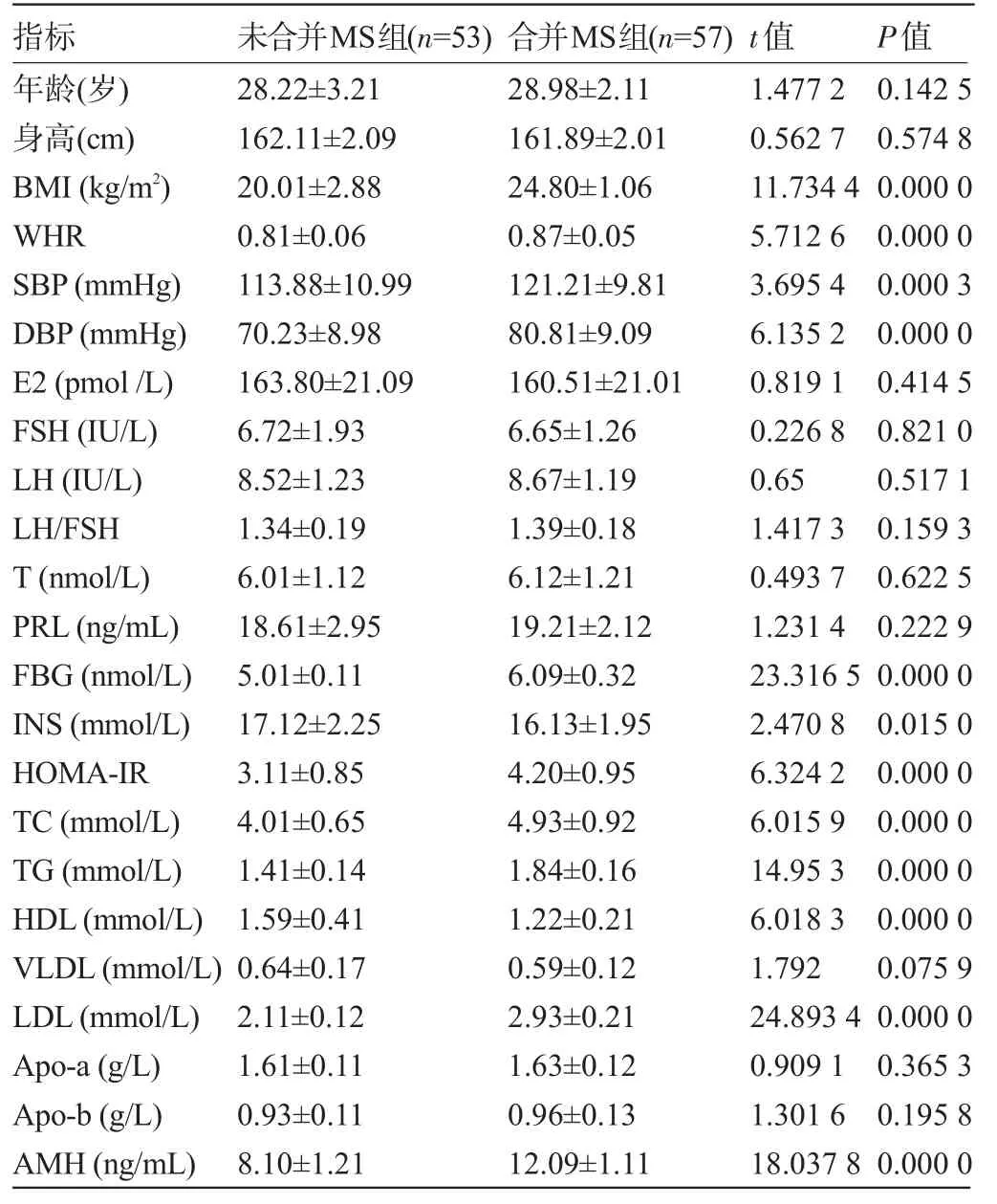
表1 合并MS组与未合并MS组患者的各项指标比较(±s)
年龄(岁)身高(cm)BMI(kg/m2)WHR SBP(mmHg)DBP(mmHg)E2(pmol/L)FSH(IU/L)LH(IU/L)LH/FSH T(nmol/L)PRL(ng/mL)FBG(nmol/L)INS(mmol/L)HOMA-IR TC(mmol/L)TG(mmol/L)HDL(mmol/L)VLDL(mmol/L)LDL(mmol/L)Apo-a(g/L)Apo-b(g/L)AMH(ng/mL)28.22±3.21 162.11±2.09 20.01±2.88 0.81±0.06 113.88±10.99 70.23±8.98 163.80±21.09 6.72±1.93 8.52±1.23 1.34±0.19 6.01±1.12 18.61±2.95 5.01±0.11 17.12±2.25 3.11±0.85 4.01±0.65 1.41±0.14 1.59±0.41 0.64±0.17 2.11±0.12 1.61±0.11 0.93±0.11 8.10±1.21 28.98±2.11 161.89±2.01 24.80±1.06 0.87±0.05 121.21±9.81 80.81±9.09 160.51±21.01 6.65±1.26 8.67±1.19 1.39±0.18 6.12±1.21 19.21±2.12 6.09±0.32 16.13±1.95 4.20±0.95 4.93±0.92 1.84±0.16 1.22±0.21 0.59±0.12 2.93±0.21 1.63±0.12 0.96±0.13 12.09±1.11 1.477 2 0.562 7 11.734 4 5.712 6 3.695 4 6.135 2 0.819 1 0.226 8 0.65 1.417 3 0.493 7 1.231 4 23.316 5 2.470 8 6.324 2 6.015 9 14.95 3 6.018 3 1.792 24.893 4 0.909 1 1.301 6 18.037 8 0.142 5 0.574 8 0.000 0 0.000 0 0.000 3 0.000 0 0.414 5 0.821 0 0.517 1 0.159 3 0.622 5 0.222 9 0.000 0 0.015 0 0.000 0 0.000 0 0.000 0 0.000 0 0.075 9 0.000 0 0.365 3 0.195 8 0.000 0
2.2 AMH水平与相关指标的相关性 Spearman相关分析结果显示,AMH水平与INS、HOMA-IR、TC、TG呈正相关(P<0.05);血清AMH水平与BMI、FBG、HDL、VLDL、LDL、Apo-a、Apo-b无相关性(P>0.05),见表2。
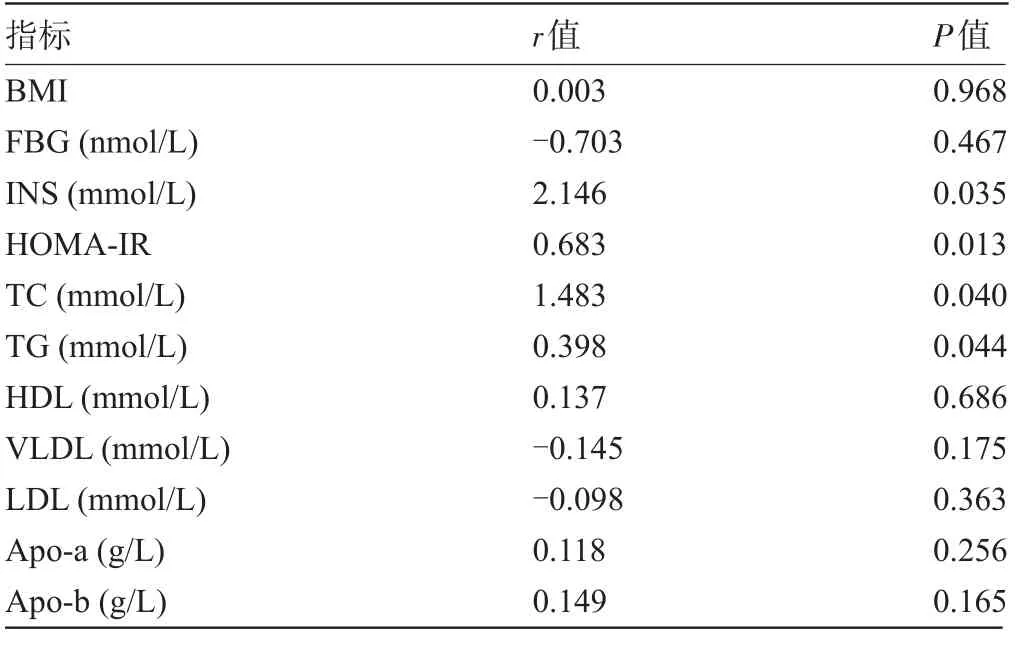
表2 PCOS患者血清AMH水平与相关指标的相关性
3 讨论
PCOS也称为Stein-Leventhal综合征,有5%~10%的女性罹患该病。由于该病临床表现多种多样,病因学研究及临床诊断和治疗相对较为复杂。现代研究多认为PCOS是下丘脑-垂体轴功能异常、胰岛素抵抗、卵巢酶缺陷的综合性疾病。PCOS在临床主要表现为月经紊乱、闭经、不孕、高雄激素、代谢综合征等。随着病情的进展,POCS发生2型糖尿病、糖耐量受损、动脉粥样硬化及心血管疾病风险明显增加[7]。关于该病的发病机制,目前多数学者认为,胰岛素抵抗、雄激素水平增高均为其发病的重要原因。相关研究指出,PCOS患者多数伴有脂代谢、糖代谢的异常以及肥胖[8]。
MS在临床上主要表现为脂代谢异常、体质量增加、尿酸增高、血压增高、血糖增高、糖耐量异常、胰岛素抵抗、血清胰岛素水平增高等。上述变化均为糖尿病及心脑血管疾病的重要发病基础和危险因素。上述临床表现及患者机体指标的改变,既是相互独立的多种疾病,同时多种疾病及表现之间又互为因果、互为危险因素。由此可见,该病的发病机制较为复杂,既协同共存又存在异质性。现代医学诊断MS的标准中以中心性肥胖为核心,合并血糖、血压、TG升高,和或HDL降低。PCOS与MS之间同样互为因果、互为危险因素。PCOS患者中,MS发生率较高,而MS女性则较常发生PCOS[9]。PCOS与MS常同时存在,两者即不是因果关系,也不是独立存在。PCOS与MS有着高度的重合性,同时也有着相同的病理生理基础,胰岛素抵抗参与了PCOS发生发展的复杂过程,而PCOS进一步发展,最终将导致代谢综合征的发生[10]。虽然PCOS患者易发生MS的确切机制并未明了,但可能与遗传易感性、胰岛素抵抗、脂代谢异常、血压增高等相互作用有着密切关系。
AMH为转化生子因子β超家族成员,近年来研究发现PCOS患者体内AMH水平明显高于正常健康同龄女性,是生殖健康领域备受关注的激素指标。AMH最初被发现和认识,是在男性分化方面所起的主要作用。胚胎第7周时,男性睾丸支持细胞即开始分泌AMH,从而抑制苗勒管发育,在睾丸分化过程中起到了一定作用,该作用一直稳定维持至青春期,再参与睾酮的合成。而女性在胚胎期由于缺少AMH对苗勒管的对抗作用,故苗勒管分化成为输卵管及卵巢和阴道的上段。最早可在妊娠36周的胎儿卵巢中方可出现AMH表达,出生后到青春期女性AMH表达达到高峰。近年来,AMH越来越受关注,主要是因为其水平高低可能与卵巢的储备功能有关,而同时PCOS患者血清AMH水平明显高于正常女性(可高达正常女性的2~3倍)[11]。由此可见,血清AMH水平与PCOS有着不可分割的密切关系,而同时PCOS与MS之间又存在着千丝万缕的联系[12-13]。目前,关于血清AMH水平是否与肥胖有关、AMH与MS代谢指标的关系,意见尚不统一。本研究通过对是否合并MS的PCOS患者各相关指标的对比分析发现,与多数研究结果相类似,两组患者在患者的体质量指数、腰臀围比、血压、血糖、胰岛素水平、胰岛素抵抗指数、血脂、以及抗苗勒管激素水平方面比较差异具有统计学意义(P<0.05)。PCOS的发生与病情进展与胰岛素抵抗有明显的关系,有研究显示PCOS与HOMA-IR呈显著正相关,血清AMH与HOMA-IR水平在鹿特丹标准四种不同表型上有显著差异。THOMAS等[14]研究指出,在肥胖人群中,PCOS患者血清AMH水平高于非PCOS患者。本研究中AMH水平与INS、HOMA-IR、TC、TG呈显著正相关(P<0.05)。提示血清AMP水平可作为PCOS血脂异常的预测因子,对PCOS未合并MS患者改善血脂血糖代谢,对延缓远期并发症具有重要的意义。但血清AMH水平与MS的风险程度尚不确定,需要采集更大样本进行远期随访进一步明确。
综上所述,PCOS患者血清AMH水平与MS有密切的关系,可根据PCOS患者血清AMH水平尽早采取干预措施,以降低MS导致的远期心血管疾病及糖尿病疾病风险。

