清达颗粒对脑缺血再灌注大鼠炎症损伤的保护作用研究
贾贝贝,蔡巧燕,2,3,张 铃,2,3,沈阿灵,2,褚剑锋,2,3,彭 军,2,3
已有研究证明,缺血缺氧所致的炎症反应是缺血性脑卒中重要的病理进程,炎症反应是预防和治疗脑缺血的关键[1]。 中药清达颗粒是由国医大师陈可冀院士60余年来治疗高血压的临床经验用方清眩降压汤精简而来,具有清肝热、平肝阳、泻心火的功效,对高血压前期、新发1级高血压证属肝火上炎、肝阳上亢具有良好的疗效。结合前期药效学研究结果,该方不仅能有效降低高血压模型大鼠血压,而且能抑制高血压模型大鼠心脏炎症反应,从而抑制高血压引起的心脏重构[2-3]。因此,本研究利用大脑中动脉闭塞(MCAO)模型观察中药清达颗粒对脑缺血再灌注大鼠脑局部炎症反应的保护作用。
1 材料与方法
1.1 实验动物 取8周龄SPF级雄性SD大鼠32只,体质量250~280 g,购自北京维通利华实验技术有限公司,实验动物许可证号:SCXK(京)2016-0006,常规饲养,环境温度(24±1)℃,湿度(55±5)%,术前12 h禁食、不禁水,术前4 h禁水。动物实验程序严格按照国际伦理准则和国家卫生研究院关于实验室动物护理和使用指导方针进行,本研究得到福建中医药大学机构动物护理和使用委员会批准。
1.2 实验药物 中药清达颗粒由天麻12 g,钩藤10 g,黄芩6 g,莲子心5 g组成, 由江阴天江药业有限公司制备成免煎颗粒剂并提供使用。中药清达颗粒一剂为1日使用量,每剂浓缩为清达颗粒免煎剂后为8 g,成品每包54 g,临床每日使用免煎剂药量为8 g。药材鉴定和药材质量标准、颗粒剂质量标准由天江药业完成,均按药典标准检验合格。
1.3 主要试剂 白介素-1β(IL-1β)、白介素-6(IL-6)、胶质纤维酸性蛋白(GFAP)抗体(英国Abcam公司);苏木素染色液、伊红染色液和2% TTC染色液(北京索莱宝科技有限公司);即用型免疫组化试剂盒(鼠/兔)、磷酸缓冲盐溶液(PBS,粉剂)、粉剂型抗原修复液(柠檬酸法)、凯基DAB显色试剂盒(福州迈新生物技术开发有限公司);硅胶线栓(广州佳灵生物技术有限公司,L 3600);其他试剂均为国产分析纯。
1.4 主要仪器 切脑模具(深圳市瑞沃德生命科技有限公司);生物组织自动脱水机和生物组织石蜡包埋机(孝感亚光公司);全自动石蜡切片机、DM4000B显微镜(德国徕卡有限公司);形态学显微图像分析系统(Leica LAS V 4.1和Motic 6.0)。
1.5 实验方法
1.5.1 局灶性脑缺血再灌注大鼠模型制备及动物分组 局灶性脑缺血再灌注模型采用硅胶线栓插入法栓塞大鼠大脑中动脉制备[4]。SD大鼠禁食12 h,禁水4 h后以2%戊巴比妥钠0.225 mL(100 g)经腹腔注射麻醉,采用线栓法阻断大鼠一侧颈内动脉血流(分离一侧颈总动脉,切开后向上置入硅胶线致颈内动脉,直至感到有阻力为止),90 min后拔除线栓开始灌注,扎紧颈内动脉,缝合各层皮肤,完成脑缺血再灌注模型。整个手术过程中使用暖灯照耀,维持肛温37 ℃。将40只SD大鼠按照随机数字表法分为造模组和假手术组,假手术组大鼠除不置入线栓外,其余操作同造模组。大鼠清醒后,参照Zea Longa进行神经功能损伤评分[5],详见表1。术后剔除1分和5分的大鼠,有死亡或造模失败大鼠,如数补上。再按随机数字表法将造模组分为模型组和清达颗粒低剂量(QDG-L)组、高剂量(QDG-H)组,造模组大鼠均经灌胃途径给药,QDG-L组给药剂量为0.8g/(kg·d),QDG-H组给药剂量为1.6 g/(kg·d),其余各组大鼠均灌服等量生理盐水,术后24 h开始干预,每日1次,干预期间,每日测定各组大鼠神经行为学变化。

表1 Zea Longa 神经功能损伤评分表
1.5.2 药物制备 中药清达颗粒临床用量每日33 g,每剂浓缩成颗粒为8 g,成品颗粒内每克含原生药量为4.125 g。给药剂量根据临床使用剂量换算得来,参照《药理实验方法学》换算大鼠灌胃给药剂量,依照体表面积折算系数,人与大鼠折算系数为0.018,换算成大鼠为0.8 g/(kg·d),相当于生药量3.3 g/kg。清达颗粒以生理盐水充分溶解配成浓度为0.8 mg/mL和1.6 mg/mL的混悬液(前期药效学实验采用了3个剂量)。
1.5.3 TTC染色 将取出的新鲜大鼠完整脑组织置于-20 ℃冰箱30 min后,取出稍复温,将脑组织置于大鼠切脑模具中用刀片去除嗅球、小脑及低位脑干部分,每个脑组织均沿冠状面平均切成5片,厚度约2 mm;将脑片放于2%的TTC染色液中,置于37 ℃恒温箱避光染色30 min,将染色后的脑片按顺序整齐地放置于白色背景板上,用相机拍照。
1.5.4 苏木精-伊红(HE)染色 各组大鼠干预7 d后,先用2%戊巴比妥钠以0.225 mL(100 g)对大鼠腹腔注射进行麻醉,麻醉成功后先用预冷的生理盐水经心脏灌注冲洗血液,再用4%的多聚甲醛固定液进行灌注,待大鼠肢体头颈僵硬时断头取脑,置于4%的多聚甲醛固定液中常温放置,48 h后将组织取出并在流水下冲洗8 h,之后修切组织置入75%乙醇中过夜脱水,次日再进行梯度脱水、透明和浸蜡包埋,包埋好的石蜡块,用切片机切成5 μm切片,之后脱蜡入水后进行HE染色。苏木精染色时间为5 min(镜检),伊红染色时间为5 s,而后进行脱水、透明、中性树胶封片。显微镜观察并拍片。
1.5.5 免疫组化 石蜡切片脱蜡入水后,以柠檬酸法进行热抗原修复,冷却后按照免疫组化试剂盒步骤进行阻断内源性过氧化物酶→封闭→4 ℃低温过夜孵育一抗(GFAP 1∶1 000,IL-1β 1∶200,IL-6 1∶200)→孵育二抗→加链霉菌抗生物素蛋白-过氧化物酶→DAB染色等操作,最后晾干封片,在显微镜下观察并拍片,采用Motic Med 6.0 System图像分析处理系统计算阳性表达率。

2 结 果
2.1 MCAO模型构建情况 评价模型构建是否成功和确认模型构建是否均一化,随机选择3只脑缺血再灌注术后24 h大鼠(给药前)进行TTC染色,结果发现急性脑缺血再灌注侧脑组织梗死,呈苍白色,提示模型构建成功。详见图1。
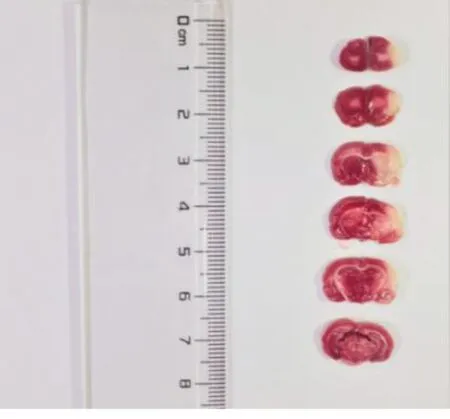
图1 TTC染色鉴定MCAO模型构建情况
2.2 各组缺血再灌注后大鼠神经行为学评分比较 与假手术组比较,术后第1天模型组、QDG-L组和QDG-H组神经行为学评分明显增高(P<0.05);术后第7天,QDG-L组和QDG-H组大鼠神经行为学评分较模型组下降,差异有统计学意义(P<0.05)。详见表2。

表2 各组大鼠缺血再灌注后神经行为学评分比较(±s) 单位:分
2.3 光镜下各组脑缺血再灌注大鼠皮质缺血区GFAP病理结构 GFAP为星型胶质细胞特异性蛋白,中枢神经系统损伤时,GFAP表达增强是星型胶质细胞常见的特征性反应之一。光镜下观察HE染色和GFAP标记星形胶质细胞结果发现,缺血再灌注7 d后,假手术组大鼠脑组织细胞、组织结构完整,排列整齐,神经元细胞形态饱满,胞浆着色均匀,胞膜完整,星形胶质细胞突起少且短;与假手术组比较,模型组大鼠缺血大脑皮质区神经元细胞数量减少,细胞间质肿胀,缺血中心区细胞坏死缺如,细胞核固缩,星形胶质细胞数量增多,突起变多且伸长,且星形胶质细胞核固缩,染色加深;QDG-L组和QDG-H组病理变化显著减轻,神经元细胞形态和数量均明显改善,星形胶质细胞表达减少。详见图2、图3。
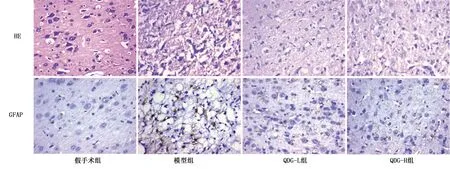
图2 光镜下各组脑缺血再灌注大鼠皮质缺血区GFAP病理结构(400×)
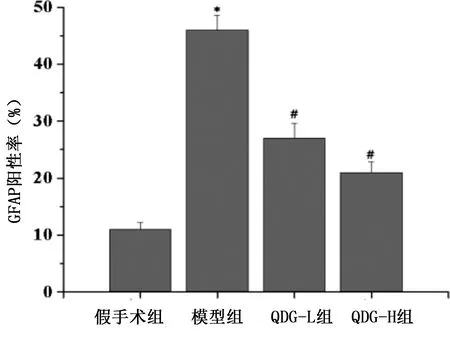
与假手术组比较,*P<0.05;与模型组比较,#P<0.05。图3 各组脑缺血再灌注大鼠GFAP阳性率比较
2.4 大脑皮质缺血区炎性因子表达比较 与假手术组比较,脑缺血再灌注 7 d后,模型组大鼠脑皮质区炎性因子IL-1β、IL-6表达增多(P<0.05);干预后,QDG-L组和QDG-H组炎性因子IL-1β、IL-6表达较模型组下降(P<0.05)。详见图4、图5。
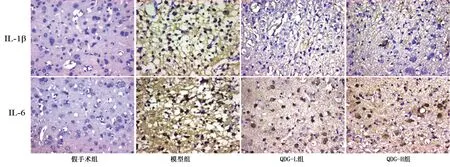
图4 光镜下各组脑缺血再灌注大鼠皮质缺血区炎性因子表达(400×)
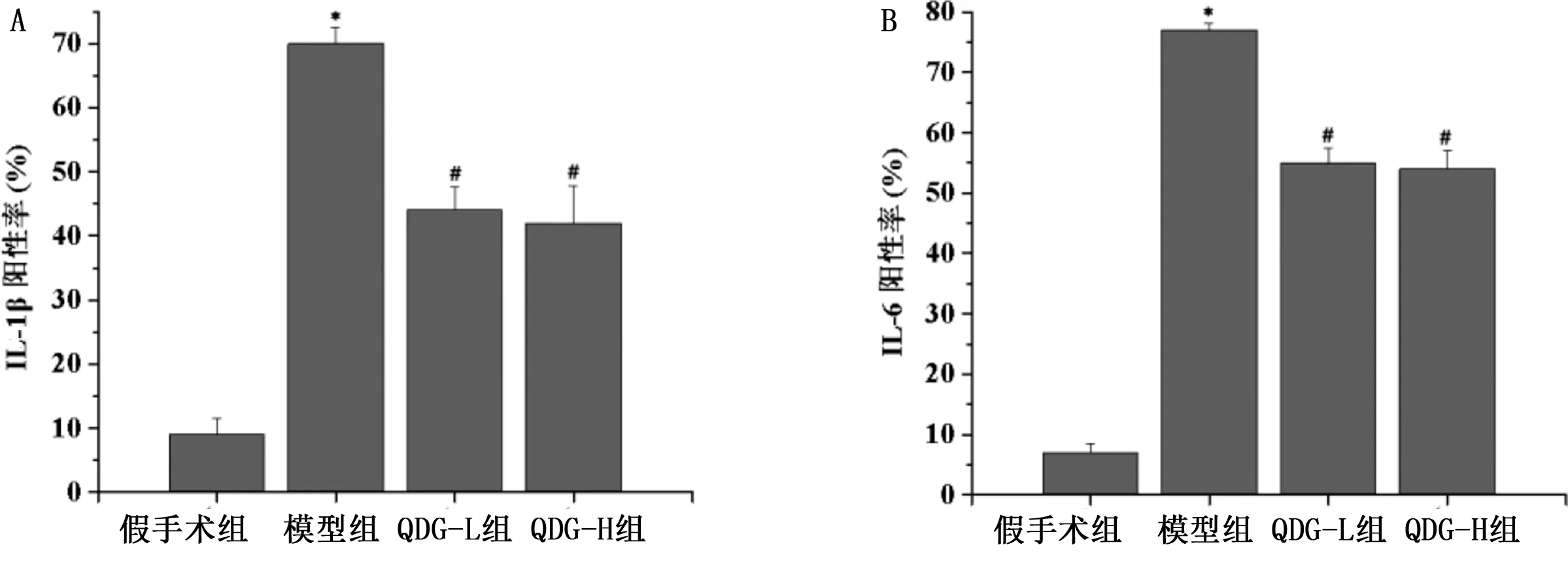
与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨 论
目前,临床治疗缺血性脑卒中多应用药物溶栓或介入治疗实现再通,针对脑缺血病理机制,研发了一些新型药物,但由于脑缺血及再灌注机制的复杂性,这些药物治疗脑缺血疗效不理想,且毒副作用大。脑血管再通后组织、器官功能不能恢复反而损伤加重,称为“缺血再灌注损伤”[6]。
本研究通过构建大鼠局灶性脑缺血模型探讨中药清达颗粒对脑缺血再灌注后神经功能、脑病理损伤和炎性细胞、炎性因子的影响。局灶性脑缺血模型制备方法较多,本研究采用硅胶线栓大鼠MCAO模型,普遍认为该模型是脑缺血的标准动物模型,已逐渐取代开颅法而成为常用方法。此法主要是通过分离颈部左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),从CCA分叉处附近直接将硅胶线栓插入大鼠MCA,阻断其起始端及所有侧支循环的血液供应。其优点是:造模不需要开颅,对其他生理结构损伤小;手术时间短、动物存活时间较长;缺血部位较恒定,对非缺血侧脑组织基本无损伤;感染概率较小;可精确控制缺血时间和再灌注时间。为最大可能避免因阻塞不完全造成的实验误差,本实验严格选取体质量250~280 g的SD大鼠及与体质量相符的硅胶线栓。
局部脑缺血再灌注对脑皮质功能造成严重损伤,该区域是运动功能中枢,因此引起神经功能缺失,根据Zea Longa神经行为学评分法,损伤加重时神经行为学评分增高[5]。本研究对大鼠造模后24 h进行神经行为学评分,结果发现模型组神经行为学评分显著升高,脑缺血再灌注后7 d内大鼠神经行为学评价结果显示,清达颗粒能早期改善神经运动功能,随着清达颗粒干预时间延长,干预7 d后,各给药组神经行为学评分降低。
局灶性脑缺血模型中,缺血灶脑组织大量细胞发生坏死,造成细胞丢失,葡萄糖和氧气缺乏造成能量衰竭,引发细胞毒性水肿。大脑主要兴奋性神经递质,即卒中后神经元信号退化的关键传递因子谷氨酸,因缺氧缺糖导致谷氨酸无法排出而累积于脑内引发兴奋性氨基酸中毒,最终导致神经细胞损伤和凋亡。脑缺血再灌注破坏小胶质细胞、中性粒细胞及巨噬细胞的动态平衡,缺血发生后,小胶质细胞作为中枢神经系统主要的免疫巨噬细胞样细胞被迅速激活,对缺血敏感的星形胶质细胞同时被激活并释放多种神经毒性物质参与炎症反应,增加血脑屏障通透性,最终引起脑水肿及组织坏死[7-11]。本研究通过对各组大鼠患侧皮质区病理染色发现,中药清达颗粒能改善因缺血和再灌注导致的脑组织水肿、神经细胞丢失、细胞核固缩变形、炎症细胞浸润等病理改变。
随着对脑缺血研究的深入,发现脑缺血再灌注后炎症反应是主要的分子机制,由缺血损伤转向炎症损伤过程中星形胶质细胞发挥重要作用[12]。脑缺血再灌注引起星形胶质细胞活化、炎症反应加剧[13]。星形胶质细胞是除中性粒细胞、巨噬细胞之外的脑缺血再灌注损伤炎症细胞,是脑组织中较大的胶质细胞,其在脑组织中多分布于神经元,脑缺血损伤首先引起毛细血管周围星形胶质细胞损伤,而星形胶质细胞损伤后合成和分泌IL-1β、IL-6等炎性因子,这些炎性因子损伤周围正常细胞,引起一系列脑组织损伤反应,继而发展为脑梗死[14-16]。GFAP特异性表达于星形胶质细胞,其表达量与星形胶质细胞激活程度呈正相关,可作为星形胶质细胞活化标志。本研究通过对脑缺血再灌注后患侧皮质区GFAP蛋白进行免疫组化染色,结果发现模型组大鼠梗死侧脑组织GFAP被激活,其数量增多,且激活的星形胶质细胞核呈固缩深染,细胞突起增多变长,而各给药组梗死侧脑组织GFAP表达水平较模型组下调,星形胶质细胞核较模型组饱满,突起变少且缩短。提示中药清达颗粒下调GFAP表达水平可能是保护缺血再灌注损伤的机制之一。
脑缺血再灌注急性期,IL-1β是参与炎症反应的关键因子[17],可激活自身表达,刺激其他促炎介质表达,并促进小胶质细胞和星形细胞增殖,引起星形细胞胶质化,造成脑损伤。IL-6来源于活化的小胶质细胞、星形细胞等免疫细胞,其水平反映疾病损伤程度[18]。因此,抑制炎性因子表达对脑缺血再灌注预后具有重要意义。本研究通过免疫组化染色检测各组大鼠患侧皮质区IL-6和IL-1β蛋白表达发现,脑缺血再灌注7 d后,模型组患侧皮质区IL-6和IL-1β表达增多,而QDG-L组和QDG-H组患侧皮质区IL-6和IL-1β较模型组减少,提示脑缺血再灌注后清达颗粒抑制炎性因子IL-6和IL-1β表达,从而发挥脑保护作用。
中药清达颗粒是由陈可冀院士60余年来临床治疗高血压的经验方清眩降压汤加减化裁而来,由天麻12 g、钩藤10 g、黄芩6 g、莲子心5 g四味中药组成,具有清肝热、平肝阳、泻心火功效,对高血压前期、新发1级高血压证属肝火上炎、肝阳上亢具有良好的疗效。该方不仅能有效降低高血压模型大鼠的血压,抑制高血压模型大鼠心脏炎症反应,从而抑制高血压引起的心脏重构,还能减轻自发性高血压模型大鼠脑损伤(部分数据尚未发表)[19]。李文君等[20]发现天麻素可降低血脑屏障通透性,通过降低炎症反应发挥保护局灶性脑缺血损伤作用;高丽娜等[21]发现钩藤碱能抑制缺血再灌注损伤后星形胶质细胞的坏死和凋亡,提示钩藤碱可能通过抑制星形胶质细胞凋亡和坏死而对脑缺血损伤发挥保护作用;王文娟等[22]发现黄芩苷通过抑制炎症反应对脑缺血再灌注大鼠发挥脑保护作用;余万桂等[23]通过观察莲心碱对大鼠局灶性脑缺血/再灌注损伤血清白介素-1(IL-1)和肿瘤坏死因子-α(TNF-α)活性的影响,发现莲心碱通过降低IL-1和TNF-α活性而发挥保护脑缺血作用。
综上所述,中药清达颗粒通过抑制脑缺血再灌注后大鼠脑皮质梗死区星形胶质细胞的激活和局部炎症反应,减轻缺血再灌注后脑损伤,促进脑功能恢复,从而发挥对脑缺血再灌注大鼠脑组织的保护作用,但具体的炎症调控机制尚不明确,今后将继续探讨清达颗粒调控脑局部缺血再灌注后相关炎症反应机制,以阐明其抑制炎症的通路。

