免疫检查点抑制剂治疗晚期肺癌毒副反应临床观察
王露方 江丰收 贾伟 王玲玉 张志红 王伟 王刚 韩兴华 孙玉蓓 王勇 潘跃银
免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)已经成为肿瘤研究和治疗领域的热点,在很多瘤种,尤其是非小细胞肺癌(non-small cell lung cacer, NSCLC)治疗中展现了新的篇章[1-2]。ICIs通过让抑制T细胞效应活性免疫检查点途径失调,改变了NSCLC的治疗格局[3-4]。但是,也表现出与治疗意愿违背的反应,表现为免疫相关毒副反应(immune-related adverse events, irAEs)[5-6],给临床医务工作者带来了挑战。Pembrolizumab(帕博利珠单抗)是阻断程序性细胞凋亡蛋白-1(programmed cell death receptor-1, PD-1)细胞通路,适用于PD-L1(programmed cell death ligand-1, PD-L1)TPS(tumor proportion score, TPS)≥1%的晚期NSCLC一线单药治疗。另一种Nivolumab(纳武利尤单抗)单药适用于既往接受过含铂方案化疗后的晚期NSCLC患者。我们利用Pembrolizumab和Nivolumab治疗43例局部晚期或转移性肺癌患者,并分析其药物相关的毒副反应及罕见致命的毒副反应。
资料与方法
一、 临床资料
选取2018年9月至2020年2月在中国科学技术大学附属第一医院诊治的晚期Ⅲb期、Ⅲc期和Ⅳ期肺癌患者,所有患者均为住院患者,均经组织病理学诊断为肺癌,其中肺腺癌患者接受一线ICIs治疗均为驱动基因阴性,或驱动基因阳性患者经过多线靶向治疗失败。
二、PD-L1突变检测
建议所有患者均接受肿瘤组织的免疫组化PD-L1检测,检测方法为免疫组织化学。
三、治疗方法
所有患者均接受了Pembrolizumab或Nivolumab单药或者联合化疗的治疗方案。
四、评价标准
观察所有入组患者的ECOG评分、吸烟史、性别、年龄、肿瘤病理类型、PD-L1 TPS表达和治疗状态。按照美国国立癌症研究院的标准4.0版本评价毒副反应,观察患者的输液反应、一般情况、甲状腺功能、瘙痒、皮疹、全身酸痛、食欲、恶心、腹泻、便秘、口腔溃疡、WBC、Neutrophils、血红蛋白(Hemoglobin)、血小板(Platelet)、谷丙转氨酶(Alanine aminotransferase, ALT)、谷草转氨酶(Glutamic oxaloacetylase, AST)、GGT、总胆红素(Total bilirubin, TBIL)、直接胆红素(Direct bilirubin, DBIL)、间接胆红素(Indirect bilirubin, IBIL)、CREA、尿蛋白、尿潜血、心脏毒性和肺毒性等。
五、43例患者接受Pembrolizumab或Nivolumab治疗均获得生存期的随访,观察患者在接受治疗后所出现的各系统的毒副反应。末次随访时间为2020年3月6日。
六、统计学方法
应用SPSS 20.0统计软件进行分析。组间疗效和不良反应率比较应用卡方检验和确切概率法,P<0.05表示差异有统计学意义。
结 果
一、患者的一般情况
2018年9月至2020年2月在我院诊治的晚期肺癌患者43例,所有患者均由组织病理学诊断为肺癌,在我院HIS和嘉和系统中均可以检索。患者的一般特征(见表1)。
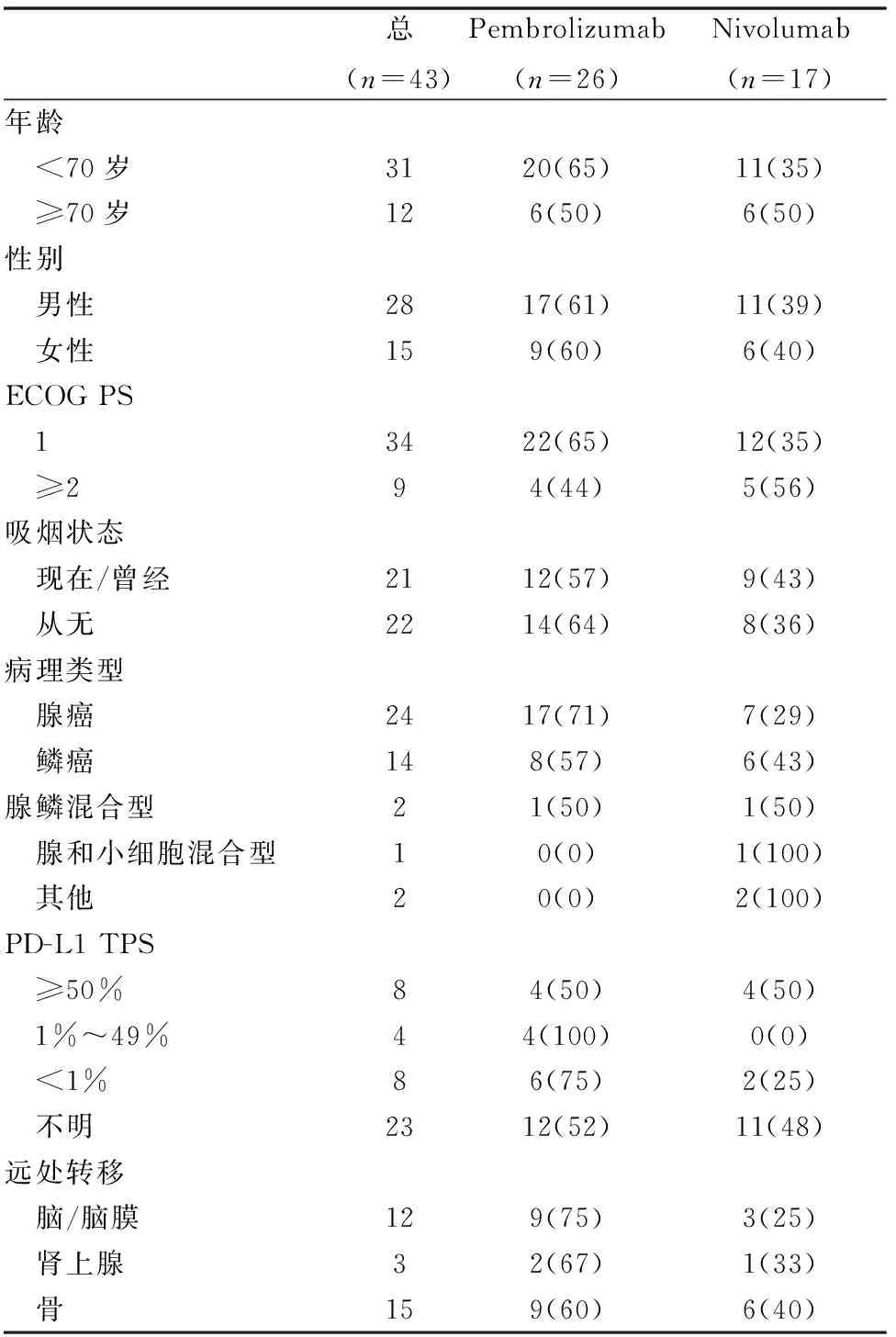
表1 43例患者的一般临床特征
二、总体疗效
在随访的43位患者中,一线治疗17人,大于等于二线治疗26人。一线和二线治疗的最佳疗效评估均为PR。截至2020年3月6日随访,43例患者至少接受了1疗程的ICIs或联合化疗,最多接受了19疗程治疗。其中一位患者彭某,系右肺浸润性腺癌伴肺内、纵隔、胸膜、左侧肾上腺转移,二线治疗接受Pembrolizumab共10疗程,截至2020年3月6日,OS达到51个月,从2019年11月4日开始接受单药Pembrolizumab维持治疗,末次评估疗效时间为2020年1月,评估为SD。另一位患者朱某,系Ⅳ期肺腺鳞混合型肿瘤,骨转移,接受二线Nivolumab联合白蛋白结合型紫杉醇(Albumin binding paclitaxel)化疗,后维持治疗,共16疗程的治疗,截至2020年3月6日随访,OS共20个月,仅表现为1级的食欲减弱。
三、 治疗相关毒副反应
所有入组的43例患者中,输液反应、疲劳、皮肤黏膜毒性、全身酸痛、神经毒性、消化系统毒性、血液毒性、肾毒性、甲状腺功能损伤和心肺毒性等表现,具体(见表2)。irAEs发生率≥25%的毒副反应,主要包括:疲劳、食欲减弱、恶心、WBC减少、Neutrophils减少、Anemia、GGT升高、瘙痒。irAEs发生率<10%的毒副反应,主要是输液反应、腹泻、口腔溃疡、TBIL升高、CREA升高、尿潜血、甲亢、甲减、心脏毒性和肺毒性。根据2020年第1版NCCN指南免疫治疗相关毒性管理和2019 CSCO指南推荐(如图1)所示大部分患者为1~2级毒性反应。极少数患者表现为3~5级毒副反应,包括疲劳、CREA升高、恶心、食欲减弱、心肺毒性。其中,1例患者郑某因无法耐受ICIs的毒副反应,表现为4级WBC减少、Neutrophils减少、Platelet减少,4级心脏毒性、频发心律失常,以频发房颤为主,伴有贫血、口腔溃疡、肾功能损害,同时诱发了脑梗死,所以永久性停用ICIs的治疗。1例患者罗某因同时出现3级免疫相关性肺毒性、3级免疫相关性心脏毒性、1级免疫相关性甲状腺功能减退和1级免疫相关性贫血,停药3个月。1例患者邵某因出现3级免疫相关性心脏损害,停药观察。
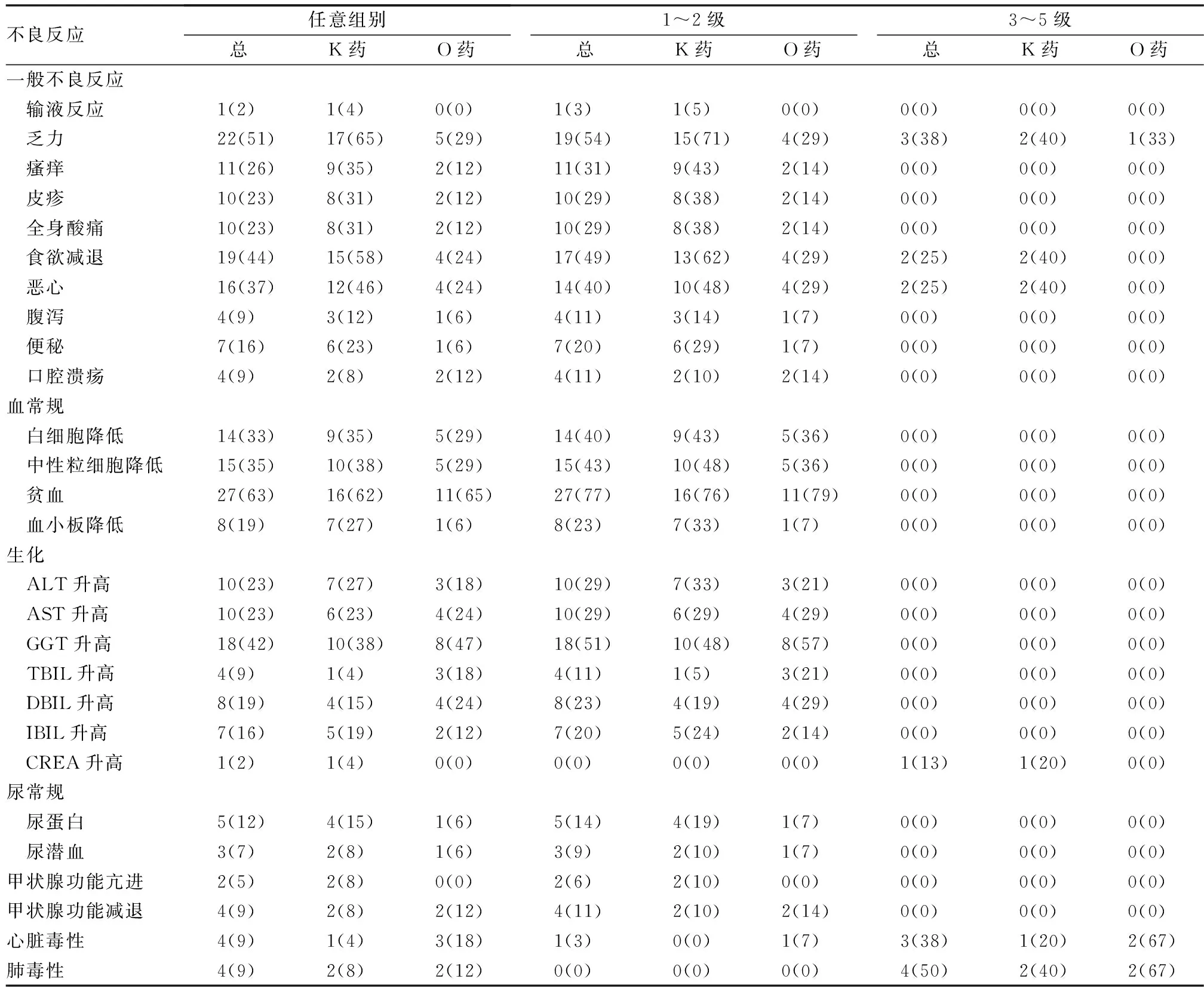
表2 免疫治疗相关毒副反应临床特征
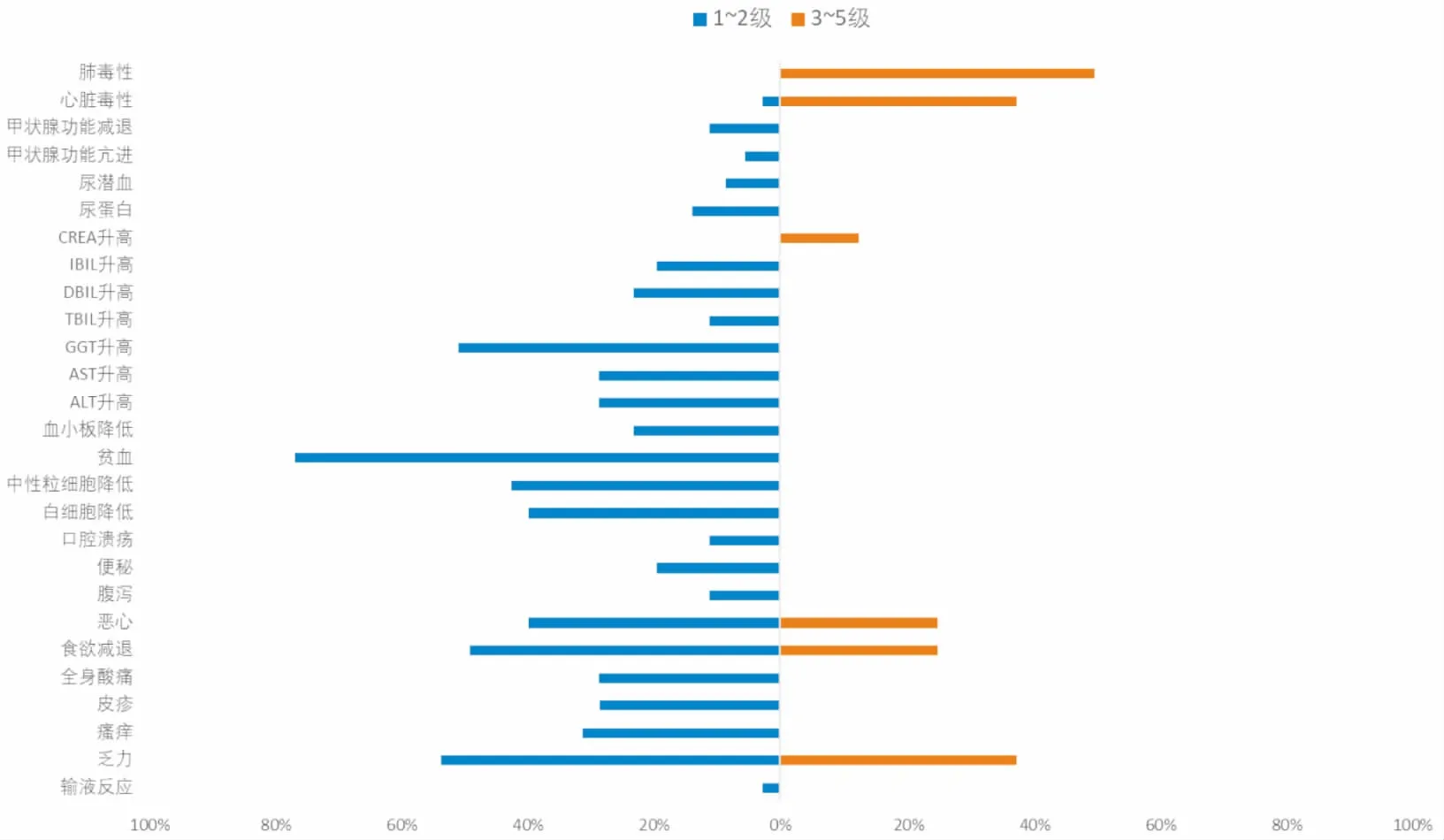
图1 免疫检查点抑制剂发生不同级别毒性反应比较
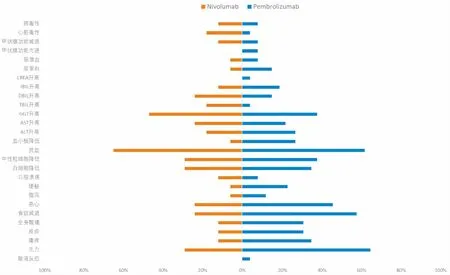
图2 Pembrolizumab和Nivolumab各系统毒副反应对比
(如图2)所示,Pembrolizumab和Nivolumab发生毒性反应的比较,二者发生毒性反应谱相当,但是,对于疲劳、瘙痒、皮疹、全身酸痛、食欲减弱、恶心、便秘、WBC减少、Neutrophils减少、Hemoglobin减少、Platelet减少和ALT升高,Pembrolizumab发生率高于Nivolumab,这与前期文献报道不同,可能系前者多数患者是一线治疗联合化疗,后者多数系二线或后线单药治疗,导致前者联合化疗发生毒副反应率较高。而在3~5级反应中,二者发生率无明显差异。仅Pembrolizumab发生的毒副反应是输液反应、CREA升高和甲亢,发生率分别为2%、2%和5%,属于发生率较低的毒副反应。
讨 论
免疫检查点抑制剂不再以肿瘤为治疗靶标,而是通过增强抗肿瘤免疫反应,达到控制肿瘤的目的。然而,激活的免疫系统也可能会引起免疫损伤,累及身体各个部位,引起相应的症状,成为一类病因明确的免疫系统异常性疾病,称之为irAEs[5]。在入组的43例晚期肺癌患者中,接受了ICIs单药或联合化疗的治疗。免疫检查点抑制剂可引起一系列组织相关毒副反应[7-9]。大多数irAEs是轻至中度的,偶尔会发生危及生命的irAEs;皮肤、消化系统、内分泌、肺和肌肉骨骼不良反应相对常见;心血管、肾脏、神经和眼部副作用相对少见,并且irAEs可能存在延迟反应[10-11]。我们观察到的≥25%的毒副反应与既往的研究相类似,但是血液学毒性,WBC减少、Neutrophils减少、Hemoglobin减少的情况也不低,这可能与ICIs联合化疗导致相关。我们观察到罕见的毒副反应,与研究报道的相符。免疫相关不良反应的机制不十分明确。一些潜在的机制包括:T细胞对抗存在于肿瘤和正常组织上抗原的活性增强;已存在的自身免疫抗体浓度增加;炎症细胞因子水平增高等[5]。
在观察ICIs毒副反应时,无论是国际权威指南、国内指南亦或是全球多中心临床研究,大多联合化疗。根据药物临床试验不良反应判定标准,我们在判断毒副反应是否与ICIs相关时,尤其慎重。ICIs联合化疗时,根据化疗和ICIs毒副反应发生机制、毒性谱和发生模式的不同进行鉴别,宁可判其有关,而谨慎判其无关。只有收集所有可能与免疫治疗相关毒性,才能充分了解其安全性。如果是无关事件,即使判定有关,也是单发事件。有一些罕见的毒副反应在临床真实世界中才被发现。
在irAEs中,有关心脏毒性发生率很低,已经报道的主要包括心肌病变、心包病变及心脏传导的问题[12],虽然心脏毒性发生率低,但是一旦发生,致死率高达39.7%~50%[13-15]。免疫相关心律失常通常表现为窦性心动过速、房性早搏、房颤等。我们观察到心脏毒性发生率9%,3~4级毒性反应发生率7%,一例患者出现了4级心律失常,以频发快速房颤为主,根据指南推荐,患者接受了1.0mg·d/kg激素治疗,同时辅助胺碘酮、索他洛尔控制心律,后转为窦性心律,经历了近1个月的住院抢救治疗。该例患者因同时并发了4级WBC减少、Neutrophils减少和Platelet减少,伴有Hemoglobin减少,口腔溃疡、肾功能损害,同时诱发了脑梗死,所以永久性停用ICIs的治疗。我们需要警惕罕见致命的irAEs心脏毒性,尤其高龄有基础心脏病患者,几种毒副反应同时出现的情况,应积极筛查心肌损伤的相关指标,如BNP、肌钙蛋白、心脏彩超、24小时动态心电图等。
有报道在接受ICIs治疗的患者中,免疫相关性肺炎发生率小于5%,3级以上发生率小于1.5%[16-19]。我们观察到4例患者发生了3~4级的间质性肺损伤,发生率9%,略超过研究报道,分析原因,具有ECOG评分差、晚期肿瘤多线治疗、肺部背景差的特点。其中,Pembrolizumab和Nivolumab各2例,3例患者临床死亡,1例患者因合并3级心脏毒性、1级甲减和1级贫血,暂停3个月ICIs治疗。死亡原因系晚期肿瘤,转移部位多,ECOG评分差,多线治疗,合并感染。一项系统综述和meta分析,PD-1抑制剂在NSCLC中发生免疫相关性肺炎的几率较黑色素瘤和肾癌高[17]。根据2019年CSCO指南推荐,免疫相关性肺炎的高危人群主要包括接受EGFR-TKI联合ICIs治疗的驱动基因阳性的NSCLC患者,或者存在活动性肺部感染、慢性阻塞性肺疾病、肺纤维化等肺的背景不好的情况,对于可能发生免疫相关性肺炎的高危人群,需要高度警惕。
ICIs单药治疗时,无论各种肿瘤,甲状腺功能异常的发生率为 5%~10%[20-21],我们观察到在43例患者中,甲状腺功能亢进和甲状腺功能减退的发生率分别为5%和9%,均为1级毒副反应,不需要停用ICIs。对于甲减可以补充甲状腺素;对于有症状的甲亢患者需要行甲状腺激素抑制治疗。推荐患者在接受免疫治疗期间,如果出现无法解释的疲劳、毛发脱落、畏寒、便秘、抑郁等,需要怀疑甲状腺功能减退的可能;如果出现不好诠释的心前区不适、出汗、亢奋和高代谢等,需要怀疑甲状腺功能亢进的可能,注意行基线评估。对于ICIs导致的皮疹,有研究表明,在接受Pembrolizumab和Nivolumab治疗的患者发生率为34%~40%,但3~4级皮疹较少发现[22]。我们观察到共10例患者发生了1~2级皮疹,发生率为23%,略低于研究报道。
根据NCCN指南和CSCO指南推荐,按照患者各系统表现毒副反应分级,酌情判断是否停药或继续治疗。糖皮质激素是治疗irAEs的基础用药,使用原则通常按照毒副反应发生的严重程度、受累脏器、病程缓急及潜在危险等因素,酌情考虑激素用量。一般来说,糖皮质激素的初始剂量可考虑为泼尼松0.5mg·d-1·kg-1口服或静脉。对于出现心肌受累或其他可能危及生命的严重情况,必要时考虑激素冲击治疗。
免疫检查点抑制剂为恶性肿瘤的治疗打开了新的格局,随之而来的irAEs也带来了很多挑战,同时也为肿瘤科及其他相关科室的临床医师们提供了新的研究领域,希望在未来的临床和基础研究工作中,我们有更多的探索空间和进步,以更好的为患者服务。

