EP管法测定婴幼儿配方乳粉中叶酸质量分数
杨小平,曾慧君,虞伟明,陈琼,郦娟,杨永
(武汉食品化妆品检验所,武汉430012)
0 引言
叶酸是指叶酸和具有叶酸生物活性的一类物质的总称[1],摄入不足易引发巨幼红细胞贫血和胎儿神经管发育缺陷[2],人体自身无法合成叶酸,只能通过饮食摄入,因此保证足够的叶酸摄入量非常重要,特别是对于婴幼儿而言。
检测食品中叶酸质量分数的方法主要有气相色谱-质谱检测法[3],HPLC法[4]和微生物法[5]。色谱法测定婴幼儿配方乳粉中叶酸质量分数,由于奶粉基质及成分复杂等因素,灵敏度和回收率均比微生物法低[6],因此国际仲裁方法为微生物法。本研究在微生物法原理的基础上,用2 mL的EP管代替传统的试管进行标准曲线溶液和样品溶液的培养,经过一系列的优化措施,极大降低了检验工作量,命名为EP管法,更适用于日常批量检验。
1 实验
1.1 材料与仪器
鼠李糖乳杆菌,CICC 6224;乳酸杆菌肉汤培养基,BD,美国;叶酸测定培养基,青岛海博;乳酸杆菌琼脂培养基,BD,美国;叶酸标准品,纯度97.0%,SUPELCO,美国;瓷珠菌种保存管,青岛海博;一次性无菌过滤器,0.45μm,密理博。
婴幼儿配方乳粉,中国检验检疫科学研究院,货号QC-IP-016,特性值为142.0μg/100g,能力评定标准差23.4μg/100g,量值范围为95.2~188.8μg/100g。
超纯水机,密理博;imark多功能酶标仪,BIORAD公司;全自动生化鉴定系统,美国Biomerieux公司;UV2700紫外可见分光光度计,岛津公司。
1.2 方法
1.2.1 质量控制措施
测定叶酸质量分数必须有足够的质量控制措施,包括:玻璃器皿,培养基,菌株,叶酸标准品,叶酸质控样品及加标试验。
玻璃器皿先用自来水洗刷干净,沸水煮30 min,再在1∶50的稀盐酸中浸泡24 h以上,二级水冲洗干净,200℃烘2 h待用;叶酸测定培养基的验证,参照GB 5009.211-2014设置标准曲线,验证培养基对各梯度浓度的叶酸标准溶液的响应程度,以未接种0对照管作空白对照,测定接种的标准0管的吸光度值,若吸光度值在0.1以下,说明培养基中叶酸本底符合要求,同时验证测定培养基、工作菌株和标准溶液三者之间配合响应程度;菌株的验证。观察菌株在平板上的颜色、形态、大小、划线的触感,并使用厌氧菌和棒状杆菌鉴定卡在全自动生化鉴定系统上进行生化特征验证;关于叶酸标准品,因为标准品可能会含水,所以需要用分光光度计进行标定,经稀释后配制成叶酸标准工作液,分装至2 mL的EP管,-20℃保存;叶酸质控样品及加标实验,试验时需要用叶酸质控样品进行比对,同时进行加标试验,计算回收率,验证测试体系的有效性。
1.2.2 工作菌株的制备
取鼠李糖乳杆菌冻干管,复苏菌株,按照瓷珠菌种保存管的方法,-20℃保存作为标准储备菌株。需要时,取一颗瓷珠到乳酸杆菌琼脂平板上,充分接触接种,传三代左右,按照国标的方法制备接种菌液,将此菌液与60%甘油按一定的比例混合,分装于2 mL的EP管中-20℃保存,此冻存液可作为下次实验的工作菌液。
1.2.3 样品的制备及稀释
根据奶粉标签值称取0.3~0.5 g奶粉,用氢氧化钠乙醇溶液溶解并超声使其完全溶解分散,定容至100 mL,再用水做适当稀释,使样液中叶酸质量浓度在0.2~0.5 ng/mL,用注射器吸取样液0.45μm无菌滤膜过滤出约1 mL样液备用。
1.2.4 样品测定管的制备
将2 mL EP管插入双面板中,分别吸取样液0.05,0.1,0.2 mL至3个EP管中,补水至0.5 mL,再加入0.5 mL含菌液的测定培养基,每个样品做两个平行,结果如表1所示。

表1 样品测定管的制备体积 mL
1.2.5 标准曲线的制备
按表2的顺序制作标准曲线,各标准系列管中叶酸的量分别为0.000,0.005,0.010,0.020,0.030,0.040,0.050,0.060,0.080,0.100 ng。另3支EP管设置为0对照管,设置同S1但不加菌液。如表2所示。
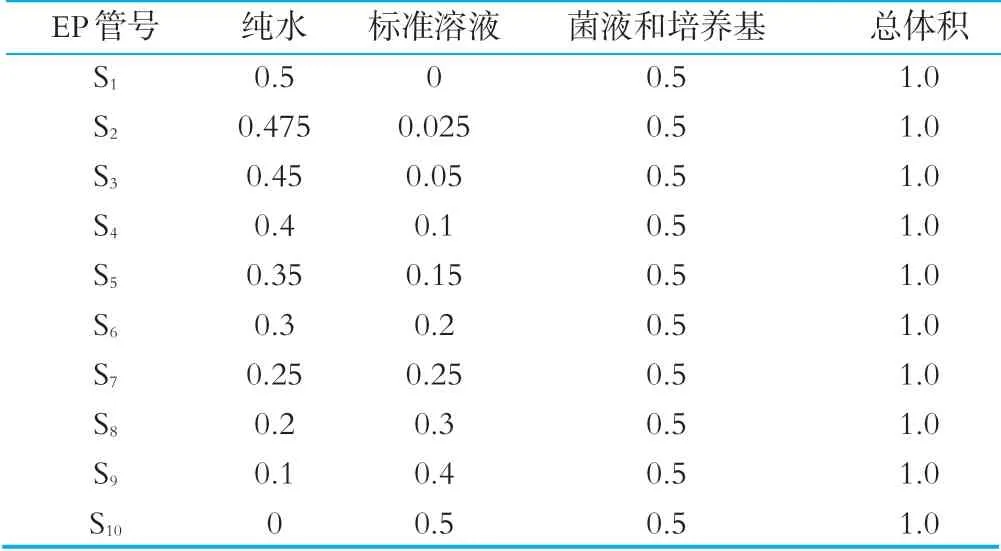
表2 标准曲线管的制备体积 mL
1.2.6 培养
将上述制备好的样品管和标准曲线管放入培养箱36℃培养40~44 h,直至叶酸消耗完。
1.2.7 测定
培养结束后,混匀培养液,各取0.2 mL培养液到本底均一的空白酶标板中,静置1 h后在630 nm波长下读取吸光度值,保存数据。
1.2.8 结果计算
应用拜发试剂盒的计算软件,设置标准曲线点的质量浓度和数量,根据每个孔的吸光度值计算出每个样品孔内叶酸的质量分数,再根据稀释倍数和称样量计算出样品中叶酸质量分数。
2 结果与讨论
2.1 各质量控制因素的影响
基于微生物法原理测定叶酸质量分数,质量控制措施非常必要。试验中用到的玻璃器皿要注意有机物的污染,清洗完成后,高温烘烤可去除有机物残留,避免有机物或抗生素等对实验的影响[7-8]。
选择合适的测定培养基是试验成功的关键。2017年以前多使用BD叶酸酪蛋白培养基,2017年以后,叶酸酪蛋白培养基停产,大部分实验室使用青岛海博或北京陆桥的叶酸测定培养基。叶酸测定培养基的关键是酪蛋白,酪蛋白中若未去除残留的叶酸,则在测定中本底偏高,标准曲线的相关性也较差,不适合做叶酸的定量检测[9]。
微生物法测定叶酸质量分数的菌株有3种:鼠李糖乳杆菌,粪链球菌和啤酒小球菌。每种菌株对不同结构的叶酸敏感程度不同,粪链球菌只对非甲基化叶酸敏感;鼠李糖乳杆菌则对单谷氨酸叶酸、含2或3个谷氨酸的叶酸及其还原型衍生物均敏感,是3种菌株中反应谱带最宽的一种,也是最为常用的菌种[5]。为保证在运输、传代、储存过程中菌株性能的稳定性,使用前需要对菌株的关键生化指标进行验证,评价工作菌株是否适用。
加标实验可以确认培养体系中是否有抑制剂存在,低回收率说明抑制剂存在。关于标准品,S O’Broin等人使用鼠李糖乳杆菌测定叶酸质量分数时,无论采用叶酸,5-甲基-四氢叶酸或5-甲酰-四氢叶酸,绘制的标准曲线基本相同,说明这几种常见形式的标准品对叶酸质量分数的测定结果几乎无影响[10]。
2.2 工作菌液制备方式的优化
菌株的传代次数与培养时间应根据实际情况而定,以菌株活力能满足实验要求为宜。关于最终测定体系中的接种量,实验发现,菌液的透光率在80%左右,菌液与培养基的体积比为1:200为宜。菌量太大,则吸光度值的波动较大。将工作菌株冷冻保存在由等量60%甘油和叶酸测定培养基组成的冷冻保护液中,能有效防止冰晶对菌体的损害。将解冻后的工作菌液按比例加入到测定培养基中进行混合,培养体系均匀性更好,有利于保证数据的稳定性。
2.3 测定体系的优化
与国标法相比,本方法将测定体系等比例10倍缩小为1 mL,但体系中叶酸的质量浓度不变。优化后,使用EP管代替试管,EP管架代替试管架,移液器代替各种移液管。样液及叶酸标准工作液均采用0.45μm滤膜过滤除菌,消除了高温高压灭菌对试验结果的影响。过滤除菌的样液及标准工作液均可-20℃短期存放,方便了试验数据的复测。
2.4 测定方式的优化
紫外分光光度计测量每根试管的吸光度值耗时耗力,测量时间的间隔不一致,测定条件不统一。EP管法培养结束后将菌液混合均匀,吸取培养液到空白酶标板中测定吸光度值,可大大缩减读数时间,且各管测定时间间隔一致,保证了测量结果的可靠性。
2.5 结果的计算
拜发微孔板法叶酸测定试剂盒采用微生物法原理测定样品中添加及原生的叶酸质量分数,其自带的计算软件默认标准曲线为四项式,该软件可以个性化设置标准品的数量和质量浓度,通过设置样品孔的数量及布局,可自动计算各样品孔中叶酸的质量分数,再通过称样量和稀释倍数即可计算样品中叶酸的质量分数。相比传统的手绘标准曲线更省时省力,计算各管中叶酸质量分数更加准确方便。
2.6 EP管法标准曲线、检出限和定量限
EP管法标准曲线如图1所示,其R2可达0.99以上,表明相关性良好。对于标准曲线的设置,可以参考GB 5009.211-2014,也可以根据样品中叶酸的质量分数,增加或减少标准曲线点数量的设置,扩大或缩小标准曲线的范围。
微生物法不同于一般的化学方法,只有在叶酸达到一定量后,才能刺激鼠李糖乳杆菌的生长并得到线性的生长响应,所以检出限的确定主要考虑标准曲线的最低响应值。在本方法中,叶酸的量大于0.005 ng可以被稳定检出,但当样品中叶酸的量低于0.005 ng时无法外推预估,因此仅能以最低标准点进行计算;叶酸的量在0.01~0.08 ng之间时能保证3个样品管的叶酸质量浓度有两个在标准曲线范围内;本方法主要针对婴幼儿配方乳粉,其添加的叶酸为强化叶酸,不需要考虑原生叶酸及酶源酶空白叶酸质量分数,以奶粉称样量0.5 g计算,检出限和定量限分别为
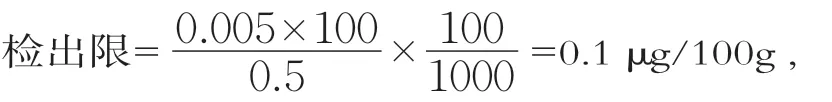
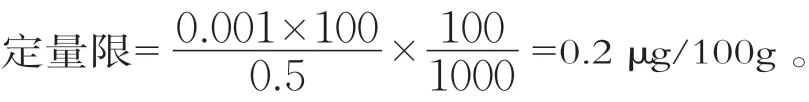
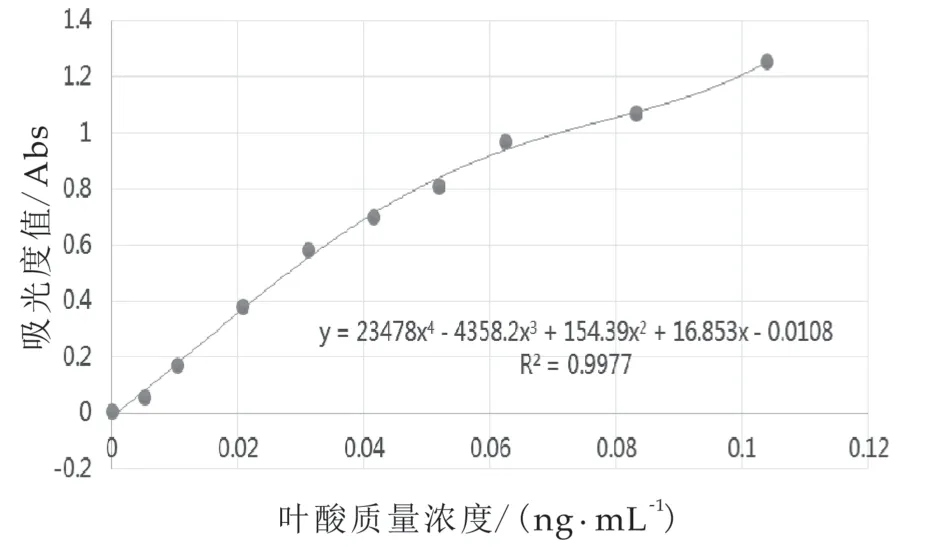
图1 EP管法标准曲线
2.7 加标回收率
配制质量浓度为100 ng/mL的叶酸标准工作液,以叶酸质控样品作为实验样品,分别称取4次0.3 g的试验样品,各加入0,0.5,1.0,2.0 mL上述叶酸标准溶液,则所加入的叶酸的量分别为0,50,100,200 ng;将实验样品和叶酸标准品稀释定容至100 mL,按EP管法步骤进行3次测试,结果如表3所示。加标回收率=(加标样品测定量-样品本底测定量)/加入标准物质的量×100%,其范围为98.0%~107.5%,根据GB/T 27404-2008的要求,EP管法加标回收率符合要求。
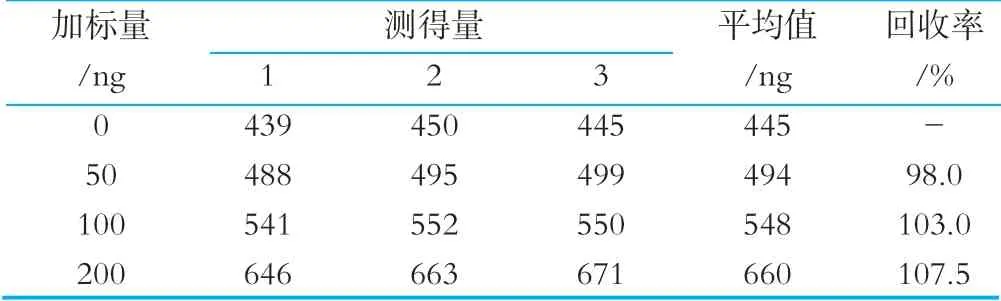
表3 EP管法加标回收率实试验结果
2.8 重复性实验
分别对质控样品和3种不同品牌的市售奶粉进行检测,每个样品做6次平行对照,实验结果如表4所示,分别计算各样品的RSD值,叶酸质控样品的RSD值为4.7%,3个市售奶粉的RSD值在7.8%~9.2%之间,说明本方法的重复性良好。
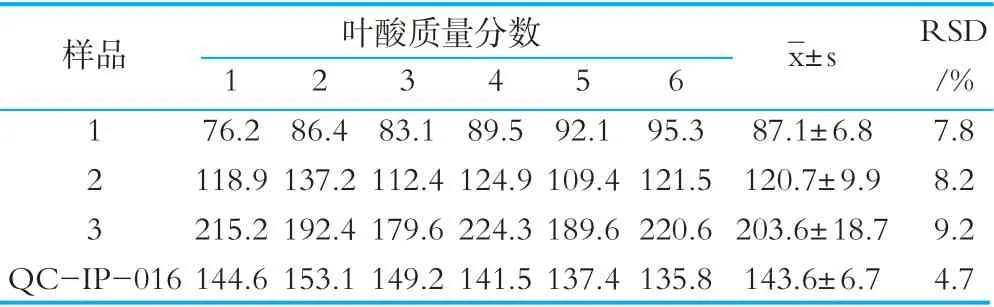
表4 EP管法的重复性试验结果 μg/100g
2.9 不同稀释倍数对测量值的影响
称取质控样品,采取四个不同的稀释倍数,每个稀释倍数做两组平行进行检测,结果如表5所示。分析不同稀释倍数下的检测结果的波动范围,结果表明在不同的稀释倍数下,测定结果较为稳定,测量值均在可接受的范围内。
2.10 EP管法和国标法的比较
称取质控样品和3种市售奶粉,国标法按照GB5009.211-2014进行检测,按照2.7的要求设置加标回收实验,分别计算回收率,检测结果如表6所示。
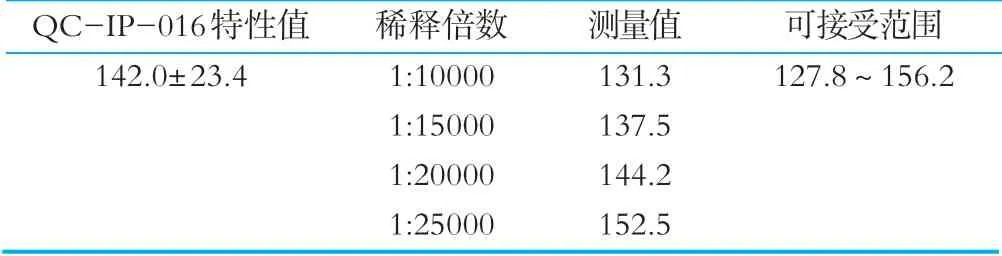
表5 不同稀释倍数下QC-IP-016叶酸质量分数 μg/100g
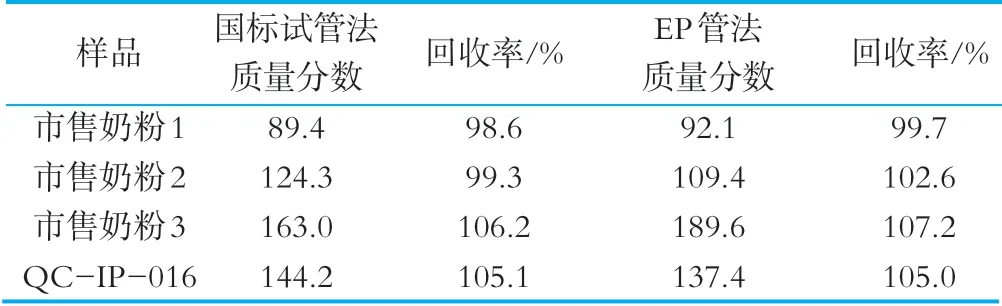
表6 EP管法和国标试管法检测结果 μg/100g
2.11 试剂的稳定性
将含甘油的工作菌液,叶酸标准工作液和质控样品过滤液分装于EP管中,-20℃保存,第一个月每两周测量一次,以后每个月测量1次,连续6个月,测定结果见表7,试验结果表明-20℃保存条件下关键试剂的稳定性良好。试剂的稳定性提示我们,工作菌液、标准工作液和质控样品稀释液可以一次配制,分装冷冻保存,按需取用,这将大大缩减试验时间。
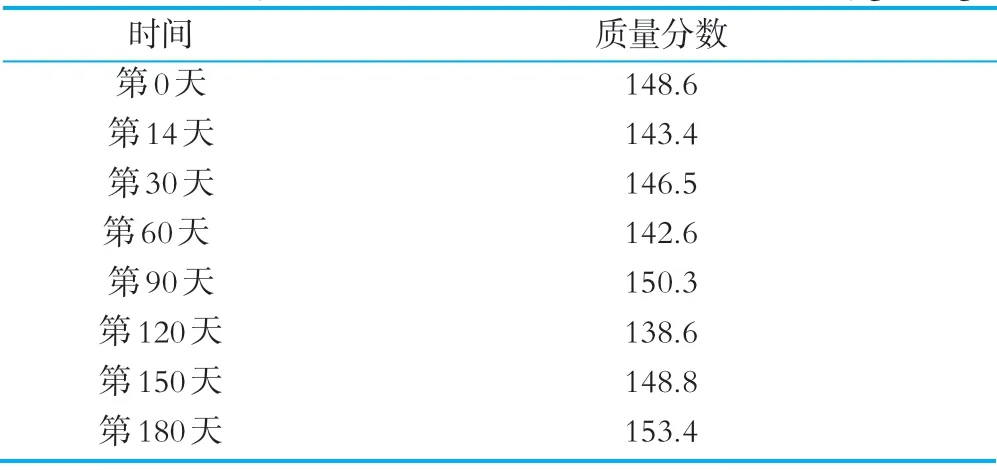
表7 QC-IP-016试剂稳定性评估实试验 μg/100g
3 结论
EP管法,试管法和微孔板法都采用微生物法的原理测定叶酸,但这3种方法又具有各自的特点。试管法的方法设置严谨,思路清晰,但准备工作较繁琐,工作量大,难以应对大批量的样品检验;微孔板法操作简便,应用较成熟,但对于大批量样品检验成本较高;而EP管法则融合了试管法和微孔板法的优点,用EP管代替试管进行培养,缩小了培养体积,采用冻存的工作菌株,可以缩短实验的准备时间,整体极大的提高了实验的可操作性,有效缩短了检验周期,能适应大批量的样品检验工作。EP管法的检出限达到0.1μg/100g,加标回收率范围为98.0%~107.5%,方法的重复性较好,且关键试剂(工作菌液、标准工作液和质控样品稀释液)在-20℃保存条件下6个月内稳定性良好,具有微孔板法操作简便的特点,但成本较微孔板法大大降低。EP管法不但适用于测定婴幼儿配方乳粉中的叶酸,还可应用于其他以微生物法原理为基础测定的维生素,如泛酸,维生素B12,生物素,肌醇和烟酸,适合在各级常规实验室推广应用。

