?不同产地多花黄精生物活性成分含量比较
王丹 张鸿 刘嘉丽 满琪 董新荣 刘德明 黄立新
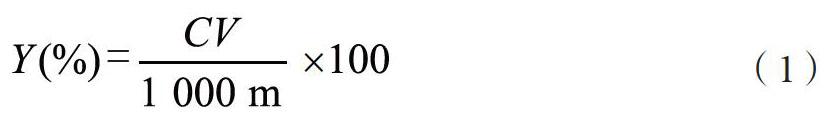

摘 要:以湖南永州地区、湘西地区、张家界地区、娄底地区及四川甘孜地区这5个不同产地的多花黄精为试验材料,采用比色法对其多糖、总皂苷、总黄酮3种生物活性成分的含量进行了测定与分析比较。结果表明:多花黄精中的生物活性成分含量因产地不同而存在着较大差异,多糖含量在8.09%~11.78%范围内变化,以娄底地区的最高;总皂苷含量范围为2.73%~5.01%,以永州地区的最高;总黄酮含量范围为0.21%~0.71%,以张家界地区及四川甘孜地区的较高。总体来看,不同产地多花黄精中多糖含量均较高,总皂苷含量居中,总黄酮含量均较低。
关键词:多花黄精;产地;多糖;总皂苷;总黄酮
中图分类号:R284文献标识码:A文章编号:1006-060X(2020)07-0089-04
Abstract: Polygonatum cyrtonema Hua samples from Yongzhou, Xiangxi, Zhangjiajie and Loudi regions of Hunan , and Garzê region of Sichuan were used as experimental material for the determination and comparison of their polysaccharide, total saponins and total flavonoids contents by colorimetric analysis method. The results showed that the contents of bioactive components in Polygonatum cyrtonema samples varied greatly with different habitats, polysaccharide content ranged from 8.09% to 11.78%, with the highest content from Loudi region; total saponins content ranged from 2.73% to 5.01%, with the highest from Yongzhou region; total flavonoids content ranged from 0.21% to 0.71%, which was relatively higher in Zhangjiajie region of Hunan and Garzê region of Sichuan. In general, polysaccharide content of these Polygonatum cyrtonema samples is high , total saponins content is medium and total flavones content is low.
Key words: Polygonatum cyrtonema Hua; habitat; polysaccharide; total saponins; total flavones
黃精为百合科植物滇黄精(Polygonatum kingianum Coll. et Hemsl)、黄精(Polygonatum sibiricum Red.)或多花黄精(Polygonatum cyrtonema Hua)的干燥根茎,具有补气养阴、健脾、润肺、益肾的功效[1]。黄精最早见于晋代陶弘景的《名医别录》,在《本草经集注》及《本草纲目》述及:“黄精宽中意气,使五脏调良,肌肉充实,骨髓坚强,其力增倍,多年不老”[2],现为药食两用植物[3]。现代药理及临床研究表明,黄精具有提高免疫力、抗菌、抗病毒、抗衰老、抗肿瘤、降血糖、降血脂、提高记忆力等作用[4-9]。
多花黄精是南方地区的道地中药材,但因长期采挖,导致野生多花黄精资源稀少,不能满足人们的需求。因此,人工栽培多花黄精正在兴起[10]。但是,多花黄精品质与品种、产地自然环境等密切相关。目前,中国药典[1]评价黄精的品质主要为定性评价,仅对多糖含量进行了定量评价。国内外研究表明,多花黄精中含有多糖、皂苷及黄酮等多种生物活性成分[11-15]。因此,客观评价多花黄精的品质应该采取多指标、同时定量的方法[16-19]。课题组采集了南方5个地区的林下仿野生种植多花黄精样品,以多花黄精多糖、总皂苷、总黄酮含量为指标进行定量比较,旨在为优选适合多花黄精生长的道地产区提供科学依据。
1 材料与方法
1.1 材料与试剂
供试材料:试验所用黄精为人工栽培三年生多花黄精块茎,采集时间为11月下旬,采集地点分别为湖南永州地区(A)、湘西地区(B)、张家界地区(C)、娄底地区(D)及四川甘孜地区(E)5个多花黄精主产区,每个区域采集样品3份。
对照样品:人参皂苷(B2p0234,安徽省合肥博美生物科技有限责任公司),菝葜皂苷对照品(批号:ST191029-010,乐美天医药/德思特生物),薯蓣皂苷元对照品(批号:1539-200001,中国药品生物制品检定所),芦丁(国家食品药品检定研究院)。
主要试剂:葡萄糖(AR)、香草醛、蒽酮、浓硫酸、无水乙醇、甲醇、高氯酸、冰醋酸、亚硝酸钠、硝酸铝、氢氧化钠等,均为国药集团化学试剂有限公司生产的分析纯试剂。
供试仪器:UV-9600型紫外可见分光光度计(北京瑞丽分析仪器公司),AX-200型万分之一分析天平(日本Shimadzu Philipines公司),DYF-200万能粉碎机(温岭市林大机械有限公司),DZKW-D-2恒温水浴锅(北京市永光明医疗仪器厂),RE-52C旋转蒸发器(上海亚荣生化仪器),SB25-12DT超声清洗器(宁波新芝生物科技股份有限公司)。
1.2 试验方法
1.2.1 样品前处理 将同一个产地的3份新鲜多花黄精样品洗净后切成约1 mm薄片并充分混匀,用烘箱在60℃下干燥至水分含量低于5%。用万能粉碎机粉碎,用封口塑料袋收集粉末,4℃保存于冰箱备用。
1.2.2 多糖含量分析 (1)葡萄糖标准曲线。称取一水葡萄糖32.4 mg,置100 mL容量瓶中,用水溶解并稀释至刻度,摇匀,得到0.294 5 mg/mL的葡萄糖标准准备液。移取葡萄糖标准储备溶液0.1、0.2、0.3、0.4、0.5、0.6、0.8 mL于10 mL具塞比色管中,分别加水至2.0 mL,摇匀。在冰水浴中缓缓滴加0.2%蒽酮-硫酸溶液至刻度,混匀。置沸水浴中保温10 min,取出后于冰水浴中冷却10 min。以水为空白对照,在582 nm波长处测定吸光度。以吸光度为纵坐标,葡萄糖浓度为横坐标绘制标准曲线。(2)样品测定。参照中国药典(2015版)黄精多糖含量测定方法制备样品溶液[1]。按上述方法显色并测定吸光度,按标准曲线计算多糖浓度,按公式(1)计算多花黄精中多糖含量。
其中,Y为多糖或总皂苷或总黄酮含量,C为多糖或总皂苷或总黄酮浓度(mg/L);V为多糖或总皂苷或总黄酮溶液体积(L);m为多花黄精质量(g)。
1.2.3 总皂苷含量分析 (1)对照样品选择。参考文献[18]方法进行。具体操作:将0.3 mL的黄精提取物的甲醇溶液、人参皂苷(1.07 mg/mL)溶液、菝葜皂苷(0.65 mg/mL)溶液、薯蓣皂苷元(0.27 mg/mL)溶液分别置于4支10 mL具塞比色管中,于80℃恒温水浴锅中挥尽溶剂。加入0.2 mL 新配制的5%香草醛-冰醋酸溶液,然后在冰水浴下加入0.8 mL高氯酸,摇匀,放入60℃恒温水浴锅中加热15 min。取出后置冰水浴中冷却2 min,加入冰醋酸至5 mL。摇匀,静置5 min。用紫外可见分光光度计在300~700 nm下,测其最大吸收波长。(2)薯蓣皂苷标准曲线绘制。称取薯蓣皂苷元2.7 mg于10 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,得到含薯蓣皂苷元0.27 mg/mL的储备溶液。移取薯蓣皂苷元标准储备溶液0.2、0.3、0.4、0.5、0.6 mL,置于10 mL具塞比色管中,显色。用紫外可见分光光度计在452 nm处测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。(3)样品中皂苷含量的测定。称取干燥后的黄精粉末0.25 g,置于250 mL圆底烧瓶中,加入150 mL浓度为80%的乙醇溶液,加热回流提取1 h,稍冷后趁热过滤;残渣及滤纸装回圆底烧瓶中再提取一次,过滤。收集滤液,减压浓缩至干,甲醇超声溶解,定容至25 mL,得到样品溶液。移取0.20 mL样品溶液于具塞比色管中,挥尽溶剂后按照上述方法显色并测定吸光值,通过标准曲线计算总皂苷浓度,参照公式(1)计算多花黄精中总皂苷含量。
1.2.4 总黄酮含量分析 (1)芦丁标准曲线的绘制。称取芦丁3.5 mg于50 mL容量瓶中,加60%乙醇溶液溶解,再用60%乙醇稀释至刻度,摇匀,得到浓度为0.07 mg/mL的芦丁標准储备溶液。参考文献[19]方法。移取芦丁标准储备溶液0.5、1.0、2.0、3.0、4.0 mL于10 mL容量瓶中。加入0.3 mL 5%亚硝酸钠溶液,摇匀,静置6 min;再加入0.3 mL 10%硝酸铝溶液,摇匀,静置6 min;再加入2.5 mL 4%氢氧化钠溶液,最后以70%乙醇定容,静置15 min,以空白试剂作对照,在510 nm处测定吸光度。以芦丁浓度为横坐标,吸光度为纵坐标绘制标准曲线。(2)样品中总黄酮含量的测定。称取干燥后的多花黄精粉末0.5 g置于锥形瓶中,分别加入25 mL 60%乙醇溶液,超声提取20 min;将上层液倒入离心管中,以3 000 r/min离心10 min,收集上清液即为样品溶液。移取样品溶液适量于25 mL具塞比色管中,于95℃恒温水浴中挥发浓缩至小于5 mL。取出冷却后显色,在510 nm处测定吸光值,用标准曲线计算总黄酮浓度。进一步参照公式(1)计算多花黄精中总黄酮含量。
2 结果与分析
2.1 黄精多糖
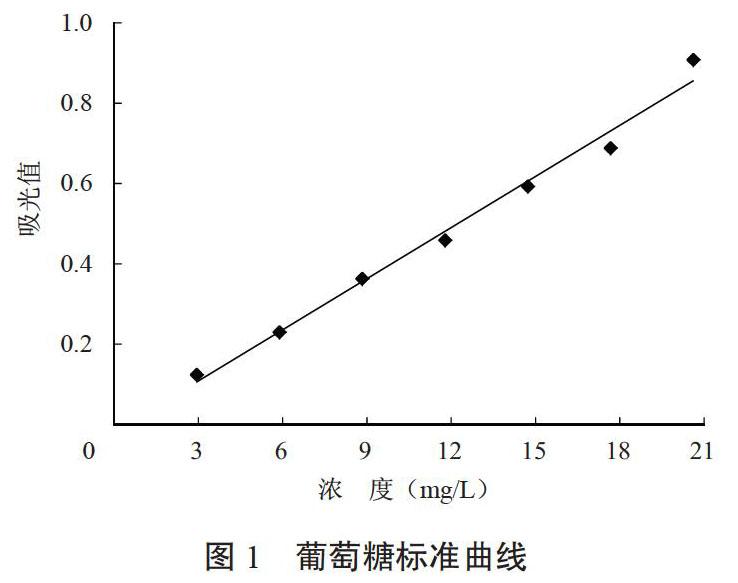
2.1.1 葡萄糖标准曲线 葡萄糖经蒽酮-硫酸显色后在582 nm下色测定吸光值,吸光值与葡萄糖浓度的线性关系如图1所示。
图1表明,葡萄糖浓度在2.945~20.615 mg/L范围内,吸光值与浓度有线性关系良好,回归方程为:Y=-0.019+0.042 42 X,R=0.994,n=7。
2.1.2 样品测定 一般认为多糖是黄精的主要生物活性成分,也是目前中国药典[1]评价黄精质量的唯一可定量的指标成分。因此,比较多糖的含量是评价黄精品质的基本要素之一。5个不同产地多花黄精中多糖含量测定结果如图2。
由图2可知,在调查的几个样品中,D样品多糖含量最高,但这5个产地多花黄精样品中多糖含量均能满足中国药典以无水葡萄糖计时不得少于7.0%(按干燥品计算)的要求[1]。
2.2 黄精皂苷
2.2.1 对照样品选择 现代研究表明,多花黄精中含有甾体皂苷及三萜皂苷类生物活性物质[3,15]。但中国药典[1]目前对黄精皂苷仅采用TLC方法进行定性检测。近年来,人们开始关注黄精中皂苷的定量评价。虽然HPLC法具有测定单一皂苷含量的优势[20-21],但存在受设备限制、耗时长等特点,特别是多花黄精因产地不同而导致皂苷种类、含量差异都较大,测定总量时需要多个对照样才能排除其他物质的干扰。比色法测定中药材的总皂苷含量具有仪器易得、速度快,适合多个样品总皂苷的比较。但比色法测定多花黄精总皂苷还没有一致认可的标准方法,特别是没有公认的对照样品,目前在实践中较多采用的对照样品有人参皂苷[22]及薯蓣皂苷[23],也有人认为菝葜皂苷较好[24]。
为了选择最大吸收波长,笔者参考上述文献方法,以人参皂苷、薯蓣皂苷及菝葜皂苷的溶液以及多花黄精样品溶液显色后进行波长300~700 nm扫描,结果如表1所示。
由表1可知,样品溶液的最大吸收峰的波长与薯蓣皂苷元的最大吸收波长接近。因此笔者选择薯蓣皂苷元作为对照样品。
2.2.2 含量测定 以薯蓣皂苷元为对照样品,经显色后在542 nm波长下的吸光值,吸光值与其浓度的线性关系如图3所示。
图3显示,薯蓣皂苷元的浓度在5.4~16.2 mg/L范围内,两者线性关系良好,回归方程为:Y=-0.005 2+0.088 04 X,R=0.994,n=5。进一步测定多花黄精样品总皂苷含量,结果如图4所示。
由图4可知,样品A的黄精总皂苷含量最高,E的次之,其余3个样品相近。
2.3 黄精黄酮
2.3.1 标准曲线 以芦丁为对照样品,经亚硝酸钠-硝酸铝显色后在510 nm波长下的吸光值,它与浓度的线性关系如图5所示。
由图5可知,在芦丁浓度为3.5~28.0 mg/L范围内,吸光值与浓度线性关系良好,回归方程为:Y= -0.002 05+0.001 09 X,R=0.999,n=5。
2.3.2 样品测定 由于多花黄精中黄酮含量较低,经过多次预试验探索,采取将提取样品浓缩后测定多花黄精中的黄酮含量,结果如图6所示。
图6结果显示,总体而言多花黄精中黄酮含量较低,但不同的产地之间也存在着明显的差异。就试验研究涉及的样品而言,样品E、C的总黄酮含量较高,样品D的含量最低。
3 讨 论
湖南为多花黄精道地产区,为了满足优质道地中药材多花黄精的种植需求,课题组从湖南多花黄精的主产区的湘西地区、张家界地区、娄底地区、永州地区以及四川甘孜地区各采集了3份人工栽培的多花黄精样品,对其所含黄精多糖、总皂苷、总黄酮的含量进行了较为系统的测定和分析比较。就试验研究收集的样品而言,黄精多糖以娄底地区的最高,但上述样品的多糖含量均符合中国药典的要求。而总皂苷含量以永州地区的最高,黄酮含量则以张家界地区及四川甘孜地区的较高。总的来说,上述5个产地的多花黄精中多糖、总皂苷的含量均较高,但总黄酮含量普遍较低。
多花黄精是药食同源的多年生草本植物,因其良好的药用和食用价值,市场需求量日益增长。近年来,野生多花黄精因采挖过于频繁,导致产量迅速下降,而且破坏生态环境。多花黄精为喜阴植物,适合林下种植,特别适合贫困山区的脱贫致富与美丽乡村建设的需求。因此,多花黄精的引种驯化栽培作为新型的林下中药材产业正在兴起。研究对5个不同产地的多花黄精样品中的黄精多糖、皂苷及黄酮的含量进行了分析比较,可为南方地区多花黄精的引种驯化与规范化栽培提供科学依据。在今后的研究中,课题组还将进一步跟踪这些地区多花黄精的品质,为南方地区道地中药材多花黄精的发展提供更多更全面的科学数据。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典(一部)(2015年版)[M]. 北京:中国医药科技出版社,2015.
[2] 李亚霖,周 芳,曾 婷,等. 药用黄精化学成分与活性研究进展[J]. 中医药导报,2019,25(5):86-89.
[3] 张 娇,王元忠,杨维泽,等. 黄精属植物化学成分及药理活性研究进展[J]. 中国中药杂志,2019,44(10):1989-2008.
[4] 李 泽,潘 登,沈建利,等. 黄精多糖对免疫抑制小鼠免疫功能影响的实验研究[J]. 药物生物技术,2013,20(3):241-244.
[5] 辜红梅,蒙义文,蒲 蔷. 黄精多糖的抗单纯疱疹病毒作用[J]. 应用与环境生物学报,2003,9(1):21-23.
[6] 江 华. 黄精多糖的抗肿瘤活性研究[J]. 南京中医药大学学报,2010,26(6):479-480.
[7] 王建新. 黄精降糖降脂作用的实验研究[J]. 中国中医药现代远程教育,2009,7(1):93-94.
[8] 郑春艳,汪好芬,张庭廷. 黄精多糖的抑菌和抗炎作用研究[J]. 安徽师范大学学报(自然科学版),2010,33 (3):272-275.
[9] 王爱梅,周建辉,欧阳静萍. 黄精对D-半乳糖所致衰老小鼠的抗衰老作用研究[J]. 长春中医药大学学报,2008,24(2):137-138.
[10] 李 莺,赵 兵,陈千良,等. 鸡头黄精及其愈伤组织总皂苷含量的测定比较[J]. 北方园艺,2011(21):167-168.
[11] 王 坤,岳永德,汤 锋,等. 多花黄精多糖的分级提取及结构初步分析[J]. 天然产物研究与开发,2014,26(3):364-369.
[12] 徐德平,孙 婧,齐 斌,等. 黄精中三萜皂苷的提取分离与结构鉴定[J]. 中草药,2006,37(10):1470-1472.
[13] 李小红,杨显辉,李 安,等. 滇黄精总黄酮超声辅助双水相提取工艺优化及其抗氧化活性[J]. 江苏农业科学,2019,47(11):234-238.
[14] 刘彦东,黄俊学,张 权,等. 高效液相色谱-双波长法测定黄精中5种活性化学成分的含量[J]. 理化检验-化学分册,2018,54(4):398-402.
[15] 陈 辉,冯珊珊,孙彦君,等. 3种药用黄精的化学成分及药理活性研究进展[J]. 中草药,2015(15):2329-2338.
[16] 喻祖文,张旺凡. 多倍体黄精中多糖和皂苷的提取及含量测定[J]. 中国现代中药,2011,13(5):20-22.
[17] 尤新军,郭 蕊,王 琳,等. 黄精总皂苷超声提取工艺研究[J]. 西北林学院学报,2010,25(3):163-166.
[18] 郑小江,陈晓春,滕树锐,等. 湖北省恩施州三种黄精主要有效成分及硒含量对比[J]. 湖北民族学院学报(自然科学版),2018,36(1):12-14,21.
[19] 刘清华,高汉云,陈桂芬,等. 多花黄精中总黄酮提取工艺优化及可视化分析[J]. 中国中医药信息杂志,2019,26(8):89-93.
[20] 陈立娜,都述虎,高艳坤,等. RP-HPLC法测定黄精中薯蓣皂苷元含量[J]. 现代中药研究与实践,2006,20(4):32-34.
[21] 左雅敏,李 琛,彭興春,等. HPLC-一测多评法测定黄精及其饮片中6种成分的含量[J]. 中国药房,2019,30(13):1748-1754.
[22] 崔 婧,范桂强,庞红霞,等. 正交法优化闪式提取黄精皂苷工艺研究[J]. 中国药师,2017,20(1):53-55.
[23] 苑 璐,薛 洁,周 三,等. 崂山产黄精总皂苷提取工艺的响应面优化[J]. 食品与药品,2015,17(1):9-13.
[24] 赵丽蓉,罗 汉,相英龙,等. Box-Benhken响应面法优化微波提取黄精总皂苷的条件[J]. 中国现代中药,2018,20(8):1010-1015.
(责任编辑:肖彦资)

