不同咀嚼负荷对牙周组织炎症状态影响的实验研究
张博伦 贾如 胡波 裴丹丹 刘洁 韩如浩 逯宜


[摘要]目的:探讨牙周炎状态下不同咀嚼负荷对牙周组织的炎性状态的影响。方法:取18只大鼠利用局部注射脂多糖(Lipopolysaccharide,LPS)+高糖饮食喂养方法建立实验性动物牙周炎模型,36d后停止处置并随机分为两组:LPS组与LPS+soft组各9只,分别用正常饲料与定制软饲料连续喂养7d,另取3只大鼠作为control组。43d后,采集双侧上颌第一磨牙腭侧龈沟液与牙龈组织及磨牙区上颌骨,分别用于ELISA检测、提取总RNA、反转录后进行Real-time PCR和用于Micro-CT扫描、三维重建后脱钙进行H&E染色。结果:相比于control组,LPS+soft组和LPS组腭侧牙槽骨均出现明显吸收,炎细胞浸润,破骨细胞增殖,形成骨吸收陷窝形成,其中LPS组更为明显。LPS组IL-1β、TNF-α在牙龈组织的表达与龈沟液含量中分泌水平均高于control组,差异具有统计学意义(P<0.05);牙龈组织中IL-6在LPS组的表达也显著高于control组,差异具有统计学意义(P<0.05);另外TNF-α在LPS組中的基因表达水平较LPS+soft组显著升高,差异具有统计学意义(P<0.05)。结论:不同硬度的食物会导致牙周组织的炎症反应程度出现差异,较软食物相对正常食物有减轻其炎性状态的作用。
[关键词]牙周炎;牙列缺损;力学载荷;脂多糖;炎症因子
[中图分类号]R781.4+2 [文献标志码]A [文章编号]1008-6455(2020)08-0023-04
Effects of Inflammation for Periodontitis Tissue on Different Masticatory Loading
ZHANG Bo-lun,JIA Ru,HU Bo,PEI Dan-dan,LIU Jie,HAN Ru-hao,LU Yi
(Department of Prosthodontics,College of Stomatology,Xian Jiaotong University,Key Laboratory of Shaanxi Province for Craniofacial Precision Medicine Research,Xian 710004,Shaanxi,China)
Abstract: Objective To explore the effect of different mechanical loads on the inflammatory state of periodontitis tissue. Methods 18 rats were taken to establish an experimental periodontitis model by local injection of LPS (Lipopolysaccharides) + high-sugar feeding method. After 36 days, the injection was stopped and the rats was divided randomly into two groups: the LPS group and the LPS+soft group, there were 9 rats in each group. The two groups were fed respectively with sufficient normal feed and customized soft feed for 7 days. Another 3 rats were taken as control group. After 43 days, the gingival crevicular fluid and the gingival tissue of the palatal side of the maxillary first molars were collected for ELISA detection, total RNA extraction, Real-time PCR after reverse transcription, the maxillary bone of the molar area were collected for H&E staining after Micro-CT scanning and 3D reconstruction. Results Compared with the control group, the alveolar bone of the LPS+soft group and the LPS group showed obvious resorption, inflammatory cell infiltration, osteoclast proliferation, and Howships lacuna, in particular, the LPS group was more obvious. The expression of IL-1β and TNF-α in gingival tissue and secretion level of gingival crevicular fluid were higher in the LPS group than in the control group, the differences were statistically significant (P<0.05). The expression of IL-6 in gingival tissue in the LPS group was higher than that in the control group (P<0.05). In addition, the gene expression level of TNF-α in the LPS group was higher than that in the LPS+soft group (P<0.05). Conclusion Different hardness foods will lead to differences in the degree of inflammation of periodontal tissues, the softer foods have a role in reducing their inflammatory status compared to normal diets.
Key words: periodontitis; dentition defect; masticatory loading; lipopolysaccharide; inflammatory factors
牙周炎是口颌系统的常见疾病,为中老年人群牙齿缺失的首要原因[1]。在对患者进行固定或活动义齿修复时,通常需选择余留牙作为基牙,咀嚼力经由基牙牙齿硬组织传导到牙周膜和牙槽骨,进而引发牙周组织相应的生物化学反应。研究显示,健康的牙槽骨在受到力学刺激后会发生成/破骨的双向改变[2],但对于炎性牙周组织在不同咀嚼负荷下的炎性改变在体研究尚未见报道。学者们常通过咬合早接触诱导咬合创伤建立动物模型,而该方法会引起大鼠咬合痛[3-4],并非生理状态下的过大牙合力状态。因此本课题拟利用脂多糖(Lipopolysaccharide,LPS)+高糖饮食构建大鼠牙周炎状态,并利用不同硬度饲料加载不同大小的咀嚼負荷,检测患牙牙周组织炎症反应状态,以探讨牙周炎状态下不同咀嚼负荷对牙周组织的炎性状态的影响,从而对牙周炎患者的修复设计提供实验依据与参考。
1 材料和方法
1.1 实验动物及牙周炎受力载荷模型的建立:清洁级(SPF等级)、8~10周龄、雄性、SD(Sprague-Dawley)大鼠,21只,体质量(200±20)g,由西安交通大学医学院实验动物中心提供。
随机选取18只大鼠,建立实验性牙周炎在体模型,10%葡萄糖水喂养,3%异氟烷吸入麻醉下,在双侧上颌第一磨牙腭侧近中龈沟、根分叉对应黏膜及第一、第二磨牙间龈乳头3处位点分别使用微量进样器注射3μl(浓度为10μg/μl)LPS,缓慢注射,并停留数秒,减少试剂流失,隔天注射,共18次。36d后停止注射LPS及10%葡萄糖水喂养,随后将18只大鼠平均分成两组,正常硬度饲料喂养组(LPS组):9只,每日投食足量常规饲料(西安交通大学医学院实验动物中心),自由饮水,连续喂养7d;软食喂养组(LPS+soft组):9只,每日投食足量定制的软饲料(西安飞扬生物科技有限公司),自由饮水,连续喂养7d。其余3只大鼠作为空白对照组(control组),同环境下继续饲养不做处理,共43d。
1.2 主要实验试剂和仪器:LPS(L-2880,10mg)(Sigma,美国);异氟烷(深圳市瑞沃德生命科技有限公司);Rat IL-1β、Rat TNF-α的ELISA试剂盒(杭州联科生物技术股份有限公司);15#吸潮纸尖(天津加发医疗器械有限公司);轻简型动物麻醉机(瑞沃德,深圳);小动物活体Micro-CT(PerkinElmer,美国)。
1.3 标本采集:预备常用试验器械以及15#吸潮纸尖,预先剪去0.5mm尖端消毒后置于150μl微离心管内,3根每瓶,称重记录备用。43d后取全部大鼠,3%异氟烷吸入麻醉下,参照文献记载方法[5-6],擦干腭侧黏膜,使用纸尖采集大鼠双侧第一磨牙腭侧龈沟液,每侧取近中、正中和远中3个位点共3支吸潮纸尖,置于150μl微离心管内称重,设0.15mg:150μl的浓度为1,加入150μl相应倍数的ELISA试剂盒内自带缓冲液稀释,-80℃保存。随后继续于3%异氟烷吸入麻醉下断头处死所有大鼠,取双侧第一磨牙腭侧牙龈组织,即刻液氮冷冻后置于冻存管内,-80℃保存,分离双侧磨牙区上颌骨标本,送Micro-CT扫描。
1.4 Micro-CT检测:将所取得的各组大鼠双侧磨牙区上颌骨标本使用Micro-CT扫描、三维重建。分别在每个样本腭侧中部1mm区域内选择近中、中央、远中3个位点,间隔0.5mm,在Micro-CT二维图像的冠状位剖面进行测量,记录每个样本腭侧牙槽嵴顶到咬合平面的距离并取平均数,以进行统计分析(见图1)。
1.5 组织病理学观察:将每个经过Micro-CT扫描后的标本用生理盐水清洗后分置于4%多聚甲醛中固定24h,参照EDTA脱钙液说明书,0.2mol/L磷酸缓冲液中充分漂洗,漂洗后投入10%成品脱钙液脱钙约1个月,至大头针能刺入骨密质为止,经脱水后行石蜡包埋,选取相近位置分别做3~5μm近远中向切片。随机在LPS组、LPS+soft组中各选取4个样本的切片,另在control组中随机选择2个标本的切片,进行H&E染色,光学显微镜下观察并拍照。
1.6 分子生物学相关检测:总RNA的提取及Real-time PCR反应:自-80℃冰箱中取出牙龈组织,放入液氮预冷的研钵中加入1ml的Trizol,充分匀浆后,按试剂盒说明提取总RNA及合成cDNA模板。对从RNA中获得的cDNA进行qPCR,检测各组样本中白细胞介素(Interleukin,IL)1β、IL-6、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)及单核细胞趋化蛋白(Monocyte chemoattractant protein,MCP)1的mRNA表达。以β-肌动蛋白(β-actin)为内参,对所得数据进行分析。各基因引物见表1。
IL-1β、TNF-α的ELISA检测:实验前从-80℃冰箱内取出微离心管恢复至室温,轻柔涡旋振荡洗脱1h,1 500r/min,4℃离心15min,提取100μl上清液备用。参考Rat IL-1β、Rat TNF-α Elisa试剂盒的说明书,将空白对照孔调零,使用酶标仪进行双波长检测,测定450nm最大吸收波长和570nm参考波长下的OD值。进行回归分析确定最佳拟合曲线,通过样本OD值在标准曲线上找到样本对应浓度。
1.7 统计学分析:用SPSS 26.0软件(IBM,美国)对所得计量资料进行分析,计量资料均数±标准差表示(精确至小数点后四位),多组间比较采用单因素方差分析,不符合正态分布或方差不齐的数据采用Kruskal-Wallis检验,多组数据之间的多重比较采用LSD-t检验,检验水准α=0.05。
2 结果
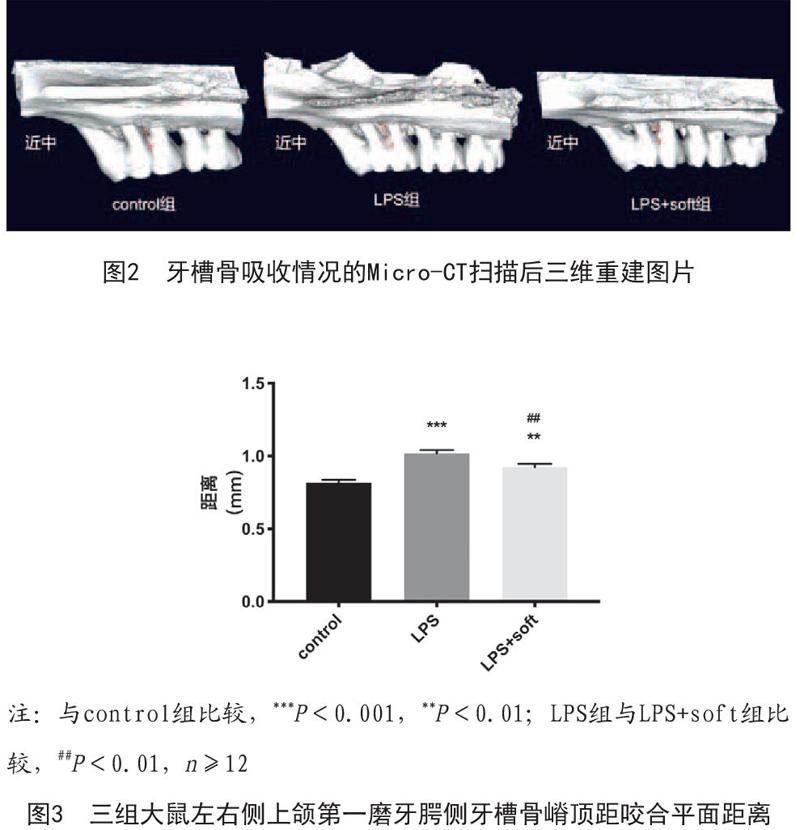
2.1 牙槽骨吸收情况:Micro-CT扫描后进行三维重建,结果如图2所示。可以看出与control组相比,LPS组与LPS+soft组均有明显弧形牙槽骨吸收,远中根处尤为明显,近中根处牙周膜间隙增宽;相比于LPS+soft组,LPS组则吸收更为明显,且牙根与牙槽骨表面显得较为粗糙。
测量结果经统计学分析后发现:三组牙槽骨吸收高度比较差异具有统计学意义(P<0.001)。两两比较后得出:control组与LPS组牙槽骨吸收高度比较差异有统计学意义(P<0.0001),control组与LPS+soft组牙槽骨吸收高度比较差异有统计学意义(P<0.01),LPS组与LPS+soft组牙槽骨吸收高度比较差异有统计学意义(P<0.01)。见图3。
2.2 组织病理学观察结果:H&E染色结果显示:与control组相比,LPS组和LPS+soft组均有一定程度的炎细胞浸润,破骨细胞增殖,骨吸收陷窝形成,牙槽骨表面凹凸不平;LPS+soft组相比于LPS组炎性细胞数量减少,牙槽骨表面平整度较好。见图4。
注:A.control组;B.LPS组;C.LPS+soft组。黑色箭头指示破骨细胞及骨吸收陷窝;红色箭头指示炎细胞浸润区域
2.3 Real-time PCR结果:Real-time PCR结果显示:炎性相关因子IL-1β、IL-6与TNF-α的表达三组间差异均具有统计学意义(IL-1β:P=0.0014<0.01;IL-6:P=0.0076<0.01;TNF-α:P=0.0016<0.01,n=6~8);且control组与LPS组间差异具有统计学意义(IL-1β:P=0.0046<0.01;IL-6:P=0.0068<0.01;TNF-α:P=0.0033<0.01,n=6~8);LPS组和LPS+soft组间TNF-α水平比较差异具有统计学差异(P=0.0283<0.05,n=6~8);而MCP-1三组间比较差异无统计学意义(P=0.2258>0.05,n=6~8);所有因子在control组与LPS+soft组间比较差异均无统计学意义(P>0.05)。见图5。
注:A.IL-1β;B.IL-6;C.TNF-α;D.MCP-1。与control组比较,**P<0.01,n=6~8;LPS组与LPS+soft组比较,#P<0.05,n=6~8
2.4 IL-1β、TNF-α的ELISA检验结果:ELISA结果如图6所示:IL-1β和TNF-α在LPS组中的浓度均显著高于control组(IL-1β:P=0.0412<0.05;TNF-α:P=0.0364<0.05,n≥3);而IL-1β和TNF-α在LPS+soft组中浓度与LPS组相比有降低趋势,但差异无统计学意义(P>0.05)。
注:A.IL-1β;B.TNF-α。与control组比较,*P<0.05,n≥3
3 討论
牙周炎与牙列缺损是中老年人常见的口腔疾病[7],且常常并存,对于修复医生来说如何利用患有牙周炎的余留牙作为基牙进行修复是个难题。牙周病患牙若承担过大的咬合力,则会加重牙周病,这个过程中牙周组织具体发生了怎样的变化,机制是什么,是口腔研究的热点问题。
成功建立一个牙周炎在体模型是本实验的基础。文献表明,LPS是公认的牙周炎相关因素[8-9],使用一定浓度的LPS在实验动物牙周膜进行局部注射便能形成牙周炎[10-11],且研究表明,45d后牙周炎表现仍然明显存在[12]。另外,学者们还常将实验鼠饮用水换成10%葡萄糖溶液作为辅助刺激因素诱导建模[13-14],该方法操作简单、无创。本次实验中通过LPS的局部注射辅以高糖饮水来进行牙周炎模型的建立,以期更有效地获取理想结果。众所周知,异常的咬合接触常常会迅速造成不适感,也是牙周病的促进因素之一,但并非是决定性的致病因素,Weston等[15]的Meta分析并没有找到足够证据支持或反对咬合调整有利于牙周治疗的观点。有综述中提到食物的性状会引起咀嚼肌活动的改变[16],潘云洁[17]等实验证明了食物硬度与咬合力存在相关性,也有研究表明过大机械应力作用下第4天起大鼠就会发生牙槽骨的改变,7d后趋化因子CCL2达到高表达水平,因此基于这些研究成果,设计改变食物硬度对牙周炎在体模型增加力学因素,并用7d作为加力时间[18-19],以完成动物模型的建立。
本实验中,建模后通过Micro-CT扫描后三维重建的结果直观的看到,经过7d正常硬度饲料喂养的大鼠,对比软饲料喂养的大鼠,其牙槽骨表面更加粗糙。经二维成像数据定量分析,与空白组对比无论软饲料还是正常硬度饲料喂养组,牙槽骨的吸收量都有统计学意义。分析牙周炎患牙在受力较轻的状态下,牙槽骨吸收速率会有所下降,成/破骨状态会达到一个新的平衡,但想要通过较小的牙合力刺激,来达到促进成骨的目的,还需要进一步的研究证实。通过H&E染色,观察到三组中破骨细胞增殖、炎细胞浸润及骨吸收陷窝形成具有差异,也印证了三维重建的结果。
对取自实验大鼠的牙龈组织样本中的炎性相关标志基因做出mRNA表达水平的检测。结果显示相比于空白对照组而言,在正常硬度饲料喂养组中IL-1β、IL-6及TNF-α的表达水平均显著升高。两个实验组之间对比,软饲料喂养组低于正常硬度饲料喂养组表达水平的趋势。推测停止LPS注射后,出现该现象的原因可能有以下3种:软饲料喂养组炎症存在但已停止进展,而正常硬度饲料喂养组继续加重;软饲料喂养组炎症继续加重但速率减慢,而正常硬度饲料喂养组则继续急剧加重;软饲料喂养组炎症出现消退,而正常硬度饲料喂养组仍未出现改善。这样看来,通过改变食物硬度减轻牙周炎患牙咀嚼负担,对于控制炎症而言,不失为一种有效措施。
此外,还尝试通过采集龈沟液,使用ELISA检验对比龈沟液中IL-1β与TNF-α浓度的差异,来观察牙周组织的炎性分泌水平的改变。结果显示两种蛋白在正常硬度饲料喂养组中的浓度均显著高于空白对照组,符合结论。而软饲料喂养组虽有低于正常硬度饲料喂养组的趋势,但不具有统计学意义,其原因可能与龈沟液样本量较少,检测灵敏度等原因有关。
综上所述,硬性食物会导致炎性牙周组织的炎症反应程度出现差异;较软食物相对正常食物而言有减轻牙周炎性状态的作用。这提示在临床修复工作中,不但应积极治疗基牙的炎症状态、尽量减轻牙周炎患牙的咀嚼负荷,还应建议患者在日常饮食中食用软质食物,以改善基牙的炎性状态,延长余留牙与修复体的使用寿命。
本实验虽得出了一些有意义的结果,但仍存在一些不足,如因为动物伦理审查的原因导致实验动物数量不够充足,为增加处理组动物数量,尽量减少实验误差而导致实验设计中正常对照组动物数量较少,在后续实验中将尽可能增加样本量,同时优化实验设计,进一步提高研究可信度。
[参考文献]
[1]严玉梅,关晓月,李香娟.局部应用云南白药治疗牙周炎的Meta分析[J].中国美容医学,2019,28(9):122-125.
[2]覃雅庆,沈慧娟,农冬梅,等.不同静压力下脂多糖刺激牙周膜成纤维细胞对炎症相关因子表达的影响[J].中国美容医学,2020,29(1):79-83.
[3]刘存瑞,徐啸翔,曹烨,等.咬合干扰时间因素对大鼠咀嚼肌机械痛觉敏感的影响[J].北京大学学报(医学版),2016,48(1):51-56.
[4]Xu XX,Cao Y,Ding TT,et al.Role of TRPV 1 and ASIC 3 channels in experimental occlusal interference-induced hyperalgesia in rat masseter muscle[J].Eur J Pain,2016,20(4):552-563.
[5]左志刚,胡敏,刘珊,等.大鼠龈沟液吸潮纸尖采集方法的建立及其评价[J].吉林大学学报(医学版),2014,40(5):1028-1032.
[6]曾辉,赵许兵,李子夏,等.骨碎补总黄酮对牙周炎大鼠龈沟液骨钙素及牙槽骨骨密度的影响[J].贵州医药,2016,40(5):460-462.
[7]张蓉,徐建红,陈荣锐.口腔正畸对牙周病致前牙移位患者前牙功能及血清炎症因子水平的影响[J].中国美容医学,2020,29(1):90-93.
[8]Mayumi H,Norihisa W,Noriaki K,et al.Cynaropicrin from Cynara scolymus L. suppresses Porphyromonas gingivalis LPS-induced production of inflammatory cytokines in human gingival fibroblasts and RANKL-induced osteoclast differentiation in RAW264.7 cells[J].J Nat Med,2019,73(1):114-123.
[9]贾如,衣颖杰,刘洁,等.不同大小动态载荷对牙周膜细胞线粒体发育及功能的影响[J].中国美容医学,2019,28(11):86-89.
[10]李会英,李国兴,刘学聪,等.黄芩苷抑制脂多糖诱导大鼠牙周炎的组织学观察[J].实用口腔医学杂志,2016,32(1):133-134.
[11]Elburki MS,Rossa C,Guimar?es-Stabili MR,et al.A chemically modified curcumin (CMC 2.24) inhibits nuclear factor κB activation and inflammatory bone loss in murine models of LPS-induced experimental periodontitis and diabetes-associated natural periodontitis[J].Inflammation,2017,40(4):1436-1449.
[12]Xu X,Chen H,Zhang X,et al.Simvastatin prevents alveolar bone loss in an experimental rat model of periodontitis after ovariectomy[J].J Transl Med,2014,12(1):284.
[13]張璇,王凯.实验性牙周炎动物模型的研究进展[J].中国医药指南,2016,14(11):39-40.
[14]Struillou X,Boutigny H,Soueidan A,et al.Experimental animal models in periodontology: a review[J].Open Dent J,2010,4(1):37-47.
[15]Weston P,Yaziz YA,Moles DR,et al.WITHDRAWN: Occlusal interventions for periodontitis in adults[J].Cochrane Database Syst Rev,2016,11(11):CD004968.
[16]Andries van der Bilt.Assessment of mastication with implications for oral rehabilitation: a review[J].J Oral Rehabil,2011,38(10):754-780.
[17]潘云洁,杨德圣.单侧最大紧咬软硬物对咬合力和咀嚼肌的影响[J].武警医学,2015,26(9):929-932.
[18]Tsutsumi T,Kajiya H,Tsuzuki T,et al.Micro-computed tomography for evaluating alveolar bone resorption induced by hyperocclusion[J].J Prosthodont Res,2018,62(3):298-302.
[19]Goto KT,Kajiya H,Nemoto T,et al.Hyperocclusion stimulates osteoclastogenesis via CCL2 expression[J].J Dent Res,2011,90(6):793-798.
[收稿日期]2020-05-28
本文引用格式:张博伦,贾如,胡波,等.不同咀嚼负荷对牙周组织炎症状态影响的实验研究[J].中国美容医学,2020,29(8):23-27.

