术中单肺通气期间吸入一氧化氮对患者氧合功能和全身炎性反应的影响
李卫霞,李成辉,刘鲲鹏,李 昭,赵 晶★
(1.中日友好医院 麻醉科,北京 100029;2.泰康宁波国际医院,江苏南京 210046;3.北京大学国际医院 麻醉科,北京 102206)
开胸手术单肺通气 (one-lung ventilation,OLV)期间低氧血症的发生率高达5%~10%,并会引发更为严重的全身炎症反应,与围术期并发症密切相关[1~5]。吸入NO(inhaled nitric oxide,iNO)可以选择性扩张肺动脉、改善通气/血流比。近些年在肺损伤动物模型中研究发现iNO 可以减少氧化应激和炎性反应,具有一定肺保护作用[6,7]。本研究采用随机对照的方法观察开胸手术患者OLV 期间持续iNO(20ppm)对氧合功能和全身炎性反应的影响。
1 资料与方法
1.1 研究对象
本研究经本院伦理委员会批准,并由患者签署麻醉知情同意书。选择2013年6月~2014年5月择期行开胸手术且术中需侧卧位OLV 的患者。排除标准:(1) 心功能NYHA 分级Ⅲ级或Ⅳ级;(2) 肝脏/肾脏功能衰竭;(3) 第一秒用力呼气量(FEV1) 占 预计值<80%且FEV1/用力肺活量(FVC)<0.7;(4)术前服用免疫抑制药物;(5)合并全身或肺部感染临床征象;(6)肺动脉高压的患者(平均肺动脉压>25mmHg);(7) 拒绝参加该项研究。按随机数表法将入选患者随机分为对照组和NO 组。
根据预实验OLV 后30min(T4)时的PaO2预期差为40mmHg,预期标准差为45mmHg。为了达到0.8 的检验效能和0.05 的α 水平,每组至少需要20 名研究对象。
1.2 麻醉及监测方法
所有患者均未应用术前药物。入室后建立静脉输液通路,并于局麻下行桡动脉穿刺置管建立有创测压通路,连接Detax-Omeda 多功能监护仪连续监测有创血压(BP)、心率(HR)、心电(ECG)和指尖血氧饱和度(SpO2),取稳定5min 后的数值作为麻醉诱导前的基础值。静脉注射咪唑安定0.05mg/kg,芬太尼2~4滋g/kg,异丙酚2~2.5mg/kg,罗库溴铵0.6mg/kg 行麻醉诱导,同时应用面罩进
行纯氧通气。采用双腔气管插管实现OLV,成功实施双腔气管插管后行右侧颈内静脉穿刺置管,在平卧位插管后和摆放侧卧位手术体位后2 次纤支镜定位确定双腔气管插管位置正确。
术中持续输注异丙酚4~6mg/kg/h,瑞芬太尼0.3~0.5滋g/kg/min 进行麻醉维持,间断追加罗库溴铵维持肌松。采用多功能脑电监测仪监测脑电双频指数(BIS),调节麻醉深度维持BIS 在40~60 之间。所有患者双腔气管插管定位合适后将气管导管与麻醉呼吸机(Drager Fabius Tiro,德国)相连接,麻醉期间通气模式为容量控制正压通气,FiO2为100%,潮气量6~8ml/kg,调整呼吸频率9~12次/min,维持气道峰压<30cmH2O,呼气末CO2分压在35~40mmHg。手术医生切皮时开始实施OLV,呼吸参数不变;NO 组患者OLV 期间持续吸入20ppm NO。NO 的吸入方法为:用氮气平衡的NO 高压气罐 (北京市北氧特种气体研究所有限公司,出厂压力9.8MPa,规格AL8L)经减压装置后与呼吸机吸气管通过T 接口连接,通过NO 浓度监测仪调整NO 的给气量,使吸入气中NO 浓度维持在20ppm。
1.3 监测项目
患者入手术室后连续监测BP、HR 和SpO2,记录麻醉时间、 手术时间、OLV 时间以及OLV 期间SpO2<90%、 临时改双肺通气、 通气侧肺加用PEEP 等事件,记录麻醉恢复室(PACU)停留时间及PACU 观察期间出现SpO2<90%、再次气管插管事件。
1.4 血样采集及肺内分流率测定
分别于麻醉诱导前(T1)、摆放侧卧位后TLV 20 min (T2)、OLV 后15 min (T3)、OLV 后30min(T4)、OLV 结束时(T5)抽取桡动脉血1ml 行血气分析,T2、T3、T4 和T5 时间点经颈内静脉抽取中心静脉血1ml 行血气分析 (ABL80 血气分析仪,Radiometer,丹麦),并计算肺内分流率[8]。
在T2、T4、T5 时间点用一次性真空血清采血管取中心静脉血3~4ml,待血样完全凝固后低温(4℃)保存送检。采用3000g×10min 进行低温离心(KUBOTA 5922 型,北京东迅天地医疗仪器有限公司),血清分离后保存在-70℃。采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)(Multiskan MK3 型酶标仪,Thermo 公司,美国)测定炎性因子白介素-6(IL-6)、白介素-8(IL-8)、白介素-10(IL-10)的浓度。
研究中止的条件:OLV 持续时间<30min 的手术患者、OLV 期间双腔气管插管位置变动影响氧合或气道峰压需重新调整的患者、 术中需要输注异体血的患者被排除在本研究之外。
1.5 统计学方法
应用SPSS15.0 对数据进行统计学处理。计量数据以(±s)表示,组间比较采用独立样本t 检验,组内比较采用单因素方差分析;计数资料采用进行χ2检验,对于χ2检验中>20%各自出现期望值<5,采用Fisher 精确检验。
2 结果
本研究共纳入42 例患者,2 例因为术中双腔管位置变动重新调整位置而至研究终止。纳入的NO 组和对照组患者基线资料和术前特征 (包括术前肺功能和基础动脉血气分析结果) 均无显著性差异(见表1)。2 组患者术中参数包括术中异丙酚和瑞芬太尼总用量、单肺通气时长、麻醉和手术时长等均无显著差异(见表2)。

表1 2 组患者基线情况和术前参数比较
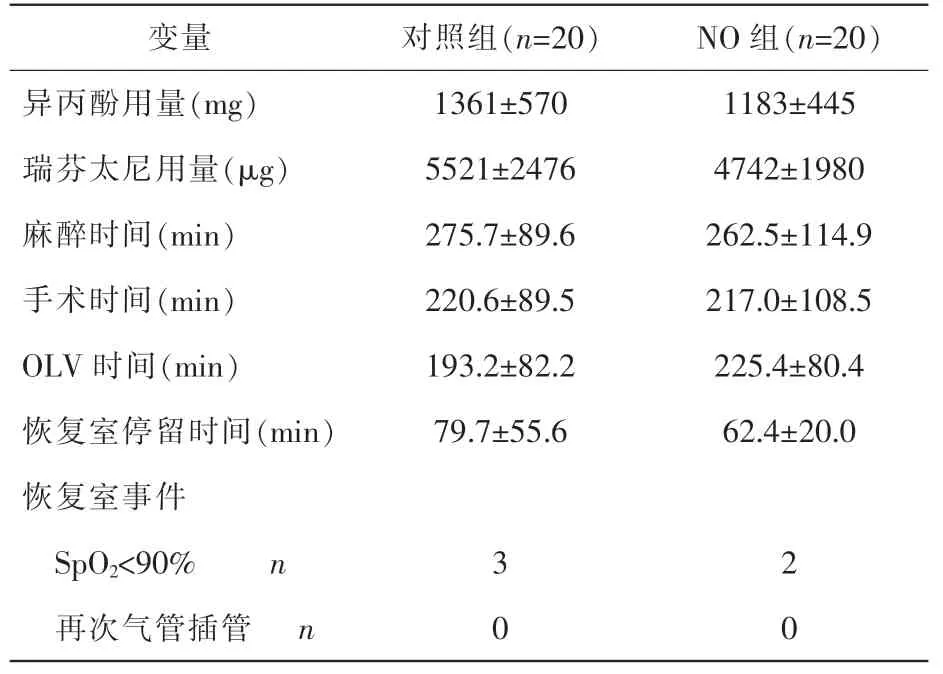
表2 2 组患者术中和PACU 参数比较
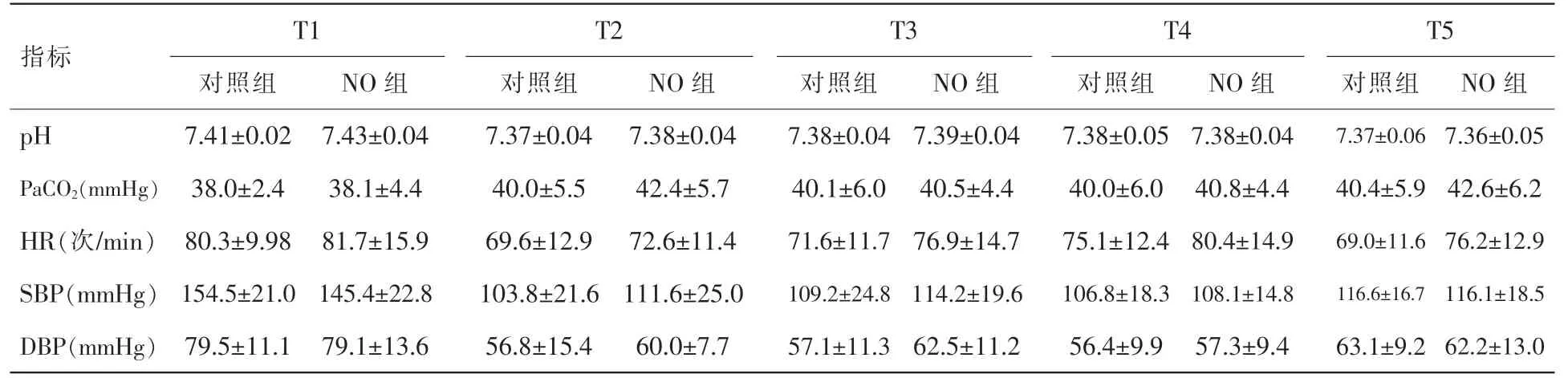
表3 术中血流动力学和动脉血气参数
表4 2 组患者循环中炎性因子测量结果比较(±s,pg/ml)

表4 2 组患者循环中炎性因子测量结果比较(±s,pg/ml)
注:与对照组比较,* P<0.05。
指标T2 T4 T5对照组 NO 组 对照组 NO 组 对照组 NO 组IL-6 4.52±2.50 3.86±4.46 5.82±4.26 4.85±4.98 63.33±58.57 54.97±60.20 IL-8 11.20±17.47 15.26±27.19 12.94±17.43 8.49±14.50 20.86±28.98 17.07±22.20 IL-10 24.67±11.18 25.05±6.89 27.12±16.53 6.43±7.55* 52.88±43.90 21.97±43.03*
术中T1~T5 各时间点血压、心率,动脉血气中pH 和PaCO2NO 组和对照组间无显著性差异(见表3)。2 组患者OLV 期间T3~T5 各时间点与T2 相比,Qs/Qt 显著增高,PaO2显著降低。但NO组T4 时Qs/Qt 显著低于对照组,PaO2显著高于对照组 (29.1±6.2 vs. 33.6±7.2,P<0.05;180.3±84.1 vs.124.9±44.7,P<0.05)(见图1、2)。
2 组患者静脉血炎性因子的变化:T5 时2 组患者IL-6 水平均有显著升高,但组间无显著性差异; 术中IL-8 水平各时间点和组间均无显著差异;IL-10 水平在T4、T5 时间点NO 组显著低于对照组 (6.43±1.73 vs.27.12±3.70,P<0.01;21.97±9.87 vs.52.88±9.82,P<0.05)。

图1 2 组患者动脉血气PaO2 变化
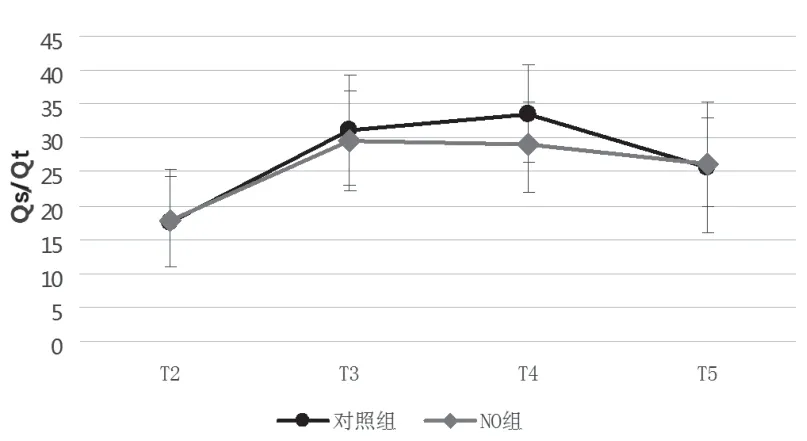
图2 2 组患者动脉血气Qs/Qt 变化
2 组患者OLV 期间均无SpO2<90%、 临时改TLV、通气侧肺加用PEEP 等事件发生,恢复室观察期间对照组和NO 组分别有3 例和2 例患者出现SpO2<90%,无显著性差异。
3 讨论
3.1 iNO 对氧合功能的影响
本研究结果显示2 组患者在实施OLV 后肺内分流率显著增加,PaO2显著降低,而NO 组在OLV 初期尤其是OLV 30min 时氧合功能显著高于对照组。开胸手术在实施手术侧朝上的侧卧位OLV 后会出现肺通气/血流比失衡、肺内分流率增加,这是OLV 期间低氧血症发生风险增加的重要原因。对照组患者在实施单肺通气后手术侧肺低氧性肺血管收缩(HPV)、重力以及术者对手术侧肺的机械压迫等影响均会导致更多肺血流重新分布至通气侧肺[9~11],可改善OLV 引起的肺通气/血流比失衡,作用在30~40min 后达到峰值[12]。而NO组患者在上述3 种因素作用的基础上,从实施OLV 时即开始iNO,通过扩张通气侧肺血管而达到增加通气侧肺血流、 改善通气/血流比的作用。OLV 后期各种调节因素共同影响下已经有大约75%~80%的心排量分布至通气侧肺,通气侧肺血管随着血流增多而适应性扩张,外源性NO 扩张肺血管作用有限,所以在本研究OLV 后期未发现NO 组氧合功能优于对照组。Fradj 等人[13]研究也证实在OLV 后期吸入20ppm NO 治疗并不能明显改善氧合功能。
3.2 iNO 对炎性反应的影响
目前OLV 影响全身炎性反应的具体机制并不明确,可能与OLV 期间肺内分流增加和潜在的低氧血症有关,另外还存在通气侧肺高潮气量通气造成的呼吸机相关的肺损伤和毛细血管应力增加[3~5]。近年来越来越多的证据提示NO 通过与核转录因子(NK-κB)结合来影响多种细胞因子的转录表达,调节机体免疫系统和炎症反应[14]。NO调控炎性反应是抑制作用还是促进作用,主要取决于作用部位和细胞内外环境[14,15]。
3.3 iNO 对IL-6 和IL-8 的影响
IL-6 是人体损伤或炎性刺激急性期反应重要的促炎因子,来源于单核细胞或巨噬细胞,在受到相应损伤应激后快速释放,而IL-8 是肺泡中募集炎性细胞最重要的细胞因子之一。本研究中,2组患者OLV 期间未发现循环中IL-6 和IL-8 水平有显著差异。有研究显示在肺损伤动物模型和ARDS 患者吸入NO 后肺泡灌洗液中IL-6、IL-8水平显著降低[16,17]。OLV 期间肺部局部IL-6 和IL-8 变化尚需进一步验证。
3.4 iNO 对IL-10 的影响
IL-10 是一种主要由Th2 细胞产生的抑制性免疫调节因子,可在转录、翻译、释放等多个环节抑制促炎细胞因子的释放,是维持细胞因子平衡机制重要的抗炎细胞因子之一[18]。本研究中对照组患者OLV 期间IL-10 水平显著升高,而NO 组患者IL-10 水平显著低于对照组,提示iNO 可能对OLV 期间循环中的IL-10 水平有抑制作用。在OLV 期间各种损伤应激激活炎性反应,同时也激活IL-10 等抑制性炎性细胞因子表达与释放,维持机体正常的免疫平衡状态。NO 组由于iNO 的作用可能会使体内炎性反应和抗炎反应在低水平达到平衡。
总之,iNO 可以减少OLV 初期的肺内分流并改善氧合,而对OLV 期间肺损伤相关全身炎性反应可能存在一定的抑制作用。本研究样本量较少,存在一定的局限性,只观察了3 种炎性细胞因子的变化来反映机体炎性反应水平。另外本研究选择的样本为静脉血,其炎性因子水平反映了全身循环系统中炎性反应水平,而iNO 过程中肺组织局部的炎性反应水平是否与全身循环系统一致尚需进一步验证。

