盐酸小檗碱对初发2型糖尿病患者降糖疗效及肠道菌群的影响
朱英倩, 江 华, 沙雯君, 雷 涛
(1.同济大学附属东方医院老年医学科,上海 200120;2.上海中医药大学附属普陀医院内分泌科,上海 200333)
2型糖尿病(type 2 diabetes mellitus, T2DM)是以血糖升高为特征的慢性代谢性疾病,我国T2DM患病人数居世界首位[1]。T2DM发病机制复杂,尚未完全阐明,近年来研究发现其发生发展可能与肠道菌群失调密切相关[2],肠道菌群参与机体代谢、免疫调节等重要功能[3],而菌群失调时可能会引起代谢异常[4],研究表明,T2DM患者的肠道菌群结构较健康对照组受试者存在差异[5],调节肠道菌群可能成为改善T2DM的新靶点。
小檗碱是一种从中药黄连素中提取的生物碱。具有一定的降糖作用,但其作用机制尚不完全清楚[6-7]。口服小檗碱生物利用度极低[8],推测小檗碱可能通过局部调节肠道菌群发挥作用。已有动物研究表明,小檗碱能够调节高脂饮食导致的肠道菌群紊乱、改善胰岛素抵抗和肥胖症状[9-10],但小檗碱临床治疗T2DM以及调节肠道菌群的证据还有待明确。此外,胰高血糖素样肽(glucagon-like peptide-1, GLP-1)一种是由肠道L细胞分泌的胃肠激素,能够减缓胃排空、促进胰岛素分泌,维持血糖稳态[11]。研究表明,小檗碱可以升高GLP-1的表达水平、降低炎症反应,进而改善胰岛素抵抗和代谢紊乱[9,12],但相关机制尚不明确。因此,本研究以初发T2DM患者为研究对象,观察盐酸小檗碱的降糖疗效以及对肠道菌群、GLP-1的调节作用,并进一步分析小檗碱调节血糖的可能机制,为其在临床的应用提供依据。
1 资料与方法
1.1 一般资料
入选受试者为2018年1月—2018年10月就诊于上海中医药大学附属普陀医院内分泌科初发T2DM患者,共50例。两组受试者人口学基本信息比较见表1。两组在性别、年龄、BMI、降糖药物差异均无统计学意义(P>0.05)。

表1 两组受试者一般资料比较
1.2 纳入及排除标准
纳入病例符合1999年WHO糖尿病诊断标准:(1)有T2DM典型症状,空腹血糖≥7.0mmol/L或2h血糖≥11.1mmol/L或随机血糖≥11.1mmol/L;(2)无T2DM典型症状,仅空腹血糖≥7.0mmol/L或2h血糖≥11.1mmol/L或随机血糖≥11.1mmol/L,需重复1次,血糖仍达以上标准者;(3)初发糖尿病患者(病程≤1年);(4)年龄40~ 80岁;(5)受试者知情本研究,自愿签署知情同意书;(6)服药依从性好,能配合各项检查。本研究已通过伦理委员会审查(PTEC-A-2017-14S-1)。
排除标准:(1)1型糖尿病、妊娠糖尿病、其他特殊类型糖尿病;(2)糖尿病疾病急性并发症或急性期感染、血糖控制不稳定期;(3)有严重全身性疾病,如肿瘤、自身免疫性疾病;(4)心脑血管疾病不稳定期、肝肾等脏器严重损害;(5)近1个月内服用抗菌素、益生菌或微生态活菌制剂等;(6)近1个月内服用GLP-1受体激动剂或二肽基肽酶抑制剂、二甲双胍或阿卡波糖;(7)未使用胰岛素治疗;(8)胃肠手术史、肠易激综合征或便秘病史;(9)精神病患者或妊娠。
1.3 研究方法
1.3.1 分组 本研究采用随机、双盲的研究方法。(1)随机分组: 应用Excel生成随机数字,由计算机随机将受试者按1∶1分配至小檗碱组和安慰剂组。受试者从1~50编号,按就诊先后顺序分配盲号,该编号在整个研究过程中保持不变。盲号为本研究的盲底,予以密封,研究人员在干预结束前不得擅自拆封。(2)盲法: 本研究中受试者与研究人员均不了解分组情况。盐酸小檗碱片由上海信谊天平药业有限公司制造(批号: H20034013),安慰剂由上海中医药大学附属普陀医院药剂科制备,其外形、颜色等均与盐酸小檗碱匹配,封装于包装盒内,由与研究过程无关的专人发放,研究人员与受试者均不知晓分配制剂的成分。
1.3.2 干预方法 两组受试者均给予基础治疗,包括严格饮食控制、适当运动。小檗碱组: 在常规降糖方案基础上,加用盐酸小檗碱片。服用方法: 每次0.5g,每日3次,疗程12周。安慰剂组: 在常规降糖方案基础上,服用安慰剂。服用方法: 每次0.5g,每日3次,疗程12周。
1.3.3 观察指标 小檗碱组和安慰剂组患者在0周、治疗12周时分别采集清晨空腹静脉血,留取清晨空腹粪便标本置于一次性无菌粪便盒内(1h内完成送检);检测糖尿病组和安慰剂组患者治疗前后空腹血糖(fasting blood glucose, FBG)、糖化血红蛋白(glycated hemoglobin A1c, HbA1c)、空腹胰岛素水平(fasting insulin, FINS)、GLP-1。两组受试者入组期间,每周进行电话随访,记录患者服药、饮食情况。在此期间患者服药、运动、饮食习惯保持不变。
1.3.4 肠道菌群培养 (1)收集受试者新鲜的自然排便1g左右置于密封的无菌便盒中,常温下1h内快速送检;(2)取1g粪便,加入10mL试管中,无菌生理盐水充分混匀稀释至10mL;将混匀液依次稀释为102~107的浓度梯度,分别用移液器依次吸取0.1mL均匀涂布至对应的选择培养基表面,每个稀释度平行接种3次;(3)采用选择性培养基培养目标菌落: 双歧杆菌、乳酸杆菌、拟杆菌先进行厌氧处理,再放入37℃培养箱进行培养48h;肠杆菌、肠球菌采用需氧培养法,直接放在37℃培养箱进行培养24h;(4)观察结果: 根据培养基菌落数目,选择30~300菌落(cfu)的稀释度进行计数;(5)细 菌数计算公式(cfu/g)=平均菌落数×稀释倍数×10;结果以每g粪便质量中菌落形成单位的对数值表示(log10cfu/g)。
1.3.5 GLP-1等血液指标水平检测方法 收集清晨空腹静脉血5mL离心(离心半径7cm,3000r/min,10min),Elisa酶联免疫法测定GLP-1水平。FBG采用全自动生化分析仪测定,HbA1c采用高压液相色谱法测定,FINS采用放射免疫法测定。计算稳态模型胰岛素抵抗指数(homeostasis model assessment-insulin resistance, HOMA-IR),HOMA-IR=FINS×FBG/22.5。
1.4 统计学处理

2 结 果
2.1 两组患者临床指标以及GLP-1水平比较
干预前两组T2DM患者FBG、HbA1c、FINS、HOMA-IR、GLP-1差异均无统计学意义(P>0.05);干预12周后,小檗碱组FBG、HbA1c、HOMA-IR低于安慰剂组,GLP-1较安慰剂组升高(P<0.05),两组的FINS差异无统计学意义(P>0.05),见表2。
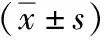
表2 干预前后两组受试者临床指标以及GLP-1水平变化
2.2 干预后两组肠道菌群变化
干预前小檗碱组与安慰剂组受试者肠道双歧杆菌、乳酸杆菌、拟杆菌、肠杆菌、肠球菌变化差异无明显统计学意义(P>0.05);干预12周后小檗碱组的肠道双歧杆菌、乳酸杆菌较安慰剂组升高,肠球菌较安慰剂组下降(P<0.05);拟杆菌、肠杆菌较安慰剂组显著下降(P<0.01),见表3。
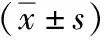
表3 干预后两组患者肠道菌群改变
2.3 肠道菌群数与血糖相关性分析
两组T2DM患者干预前后FBG水平与双歧杆菌数呈负相关(r=-0.273,P=0.007),与乳酸杆菌数呈负相关(r=-0.225,P=0.027),与肠杆菌数呈正相关(r=0.286,P=0.005),与拟杆菌数及肠球菌数无明显相关性(P>0.05)。
2.4 GLP-1变化差值与肠道菌群相关性分析
两组T2DM患者干预前后GLP-1差值与双歧杆菌、乳酸杆菌、肠杆菌、拟杆菌、肠球菌数变化差值均无相关性(P>0.05)。GLP-1前后差值与FBG、FINS、HOMA-IR前后差值无相关性(P>0.05),但与HbA1c变化差值相关(r=-0.377,P=0.008)。
2.5 干预12周的安全性评估
记录受试者不良事件、生命体征、心电图及实验室指标,包括肝肾功、血常规、尿常规等。整个研究过程中,两组受试者无肝肾功能损伤,无恶心、腹胀及明显便秘等不良事件报告,无过敏性反应、皮疹、药物热等异常反应,期间无严重不良反应发生。
3 讨 论
当前T2DM的具体发病机制尚未完全明确,增加了血糖控制以及糖尿病心脑并发症一、二级预防的难度。近年来研究表明,肠道菌群在T2DM的发生及发展中发挥重要作用[13]。T2DM患者较正常健康人群的肠道菌群结构改变,表现为产丁酸的乳酸杆菌等益生菌数量减少,而各种条件致病菌增多[14]。T2DM发生可能已经出现肠道菌群改变[15],调节肠道菌群可能是治疗T2DM的靶点。已有研究表明多种降糖药物可能通过作用肠道菌群发挥作用。二甲双胍是目前T2DM治疗的一线用药,其作用机制可能是通过调节肠道胆汁酸代谢及肠道菌群[16],Meta分析表明二甲双胍治疗的T2DM患者肠道菌群构成发生显著变化[17]。此外,α-糖苷酶抑制剂、DDP-4抑制剂以及GLP-1受体激动剂等降糖药物可以改变肠道菌群[18-20]。但目前研究尚不支持磺脲类以及噻唑烷二酮类降糖药物对肠道菌群的影响作用[21-22]。
盐酸小檗碱是广谱抗菌药物,近年来研究发现小檗碱可以有效降低血糖。但其生物利用度低,因此推测其降糖疗效的机制之一可能是参与对肠道菌群的调节。本研究考虑其他药物也可能对肠道菌群产生影响,因此排除了服用二甲双胍、α-糖苷酶抑制剂、GLP-1受体激动剂以及DPP-4抑制剂的T2DM患者。初步发现,小檗碱组双歧杆菌、乳酸杆菌数较安慰剂组升高,而拟杆菌、肠杆菌、肠球菌数量下降,表明盐酸小檗碱对肠道菌群具有一定的调节作用。本研究也发现FBG水平与肠道菌群数量具有一定的相关性,对整体FBG与肠道菌群数量进行相关性分析显示,双歧杆菌与乳酸杆菌与FBG呈负相关,其原因可能是双歧杆菌、乳酸杆菌可以升高肠道β半乳糖苷酶、葡萄糖苷水解酶的活性,促进外周组织对糖类物质有效吸收和利用。相关研究表明益生菌可促进多糖转化为更容易被肠道上皮吸收的短链脂肪酸,通过与脂肪细胞膜上的脂肪酸受体结合,促进游离脂肪酸与葡萄糖吸收,从而降低血糖[23]。双歧杆菌和乳酸杆菌是促进机体健康的益生菌,其数量升高可以维持血糖稳态[24],本研究进一步证明这一结果。研究也发现FBG与肠杆菌数量呈正相关,其原因可能是肠杆菌是一种致病菌,可以引起糖尿病患者更高的感染发病率[25],同时肠杆菌可加剧糖脂代谢紊乱程度[26]。
两组初发T2DM患者治疗后血糖水平均有下降,小檗碱组干预前后对FBG、HbA1c的降糖疗效分别为29.0%、20.87%,安慰剂组为19.48%、13.83%。小檗碱组FBG、HbA1c较安慰剂组的FBG、HbA1c水平降低(P<0.05)。本研究中观察到两组受试者的HOMA-IR的差异有统计学意义(P<0.05),但胰岛素水平的改变差异无统计学意义(P>0.05),提示小檗碱可能并不通过影响胰岛素水平发挥降糖作用。有研究表明,小檗碱具有与二甲双胍、罗格列酮相似的降糖疗效,但作用机制是通过促进胰岛素受体的表达,提高葡萄糖的利用率,改善胰岛素抵抗[27]。
本研究在干预12周后,小檗碱组GLP-1水平较安慰剂组显著升高(P<0.05),提示小檗碱可升高GLP-1水平。GLP-1是由肠道上皮L细胞合成并分泌的一种肠促胰素,动物研究表明盐酸小檗碱能够提高L细胞的数量进而升高GLP-1的水平[28]。此外,益生元是一类选择性促进肠道益生菌生长从而改善宿主健康的一类膳食纤维,本身不被消化。服用益生元可以减少食物摄入、降低血糖,膳食纤维经肠道菌群发酵后产生短链脂肪酸,可以与G蛋白偶联受体结合,从而触发L细胞分泌GLP-1[29]。肠道菌群紊乱可降低GLP-1受体的表达[30],但是尚未明确有直接作用于GLP-1特定的肠道菌群。本研究进行相关性分析,也未发现能够直接影响GLP-1水平的肠道微生物。另外,生活方式的改变也会对GLP-1产生一定影响,如严格控制饮食,增加有氧运动时间也可以促进L细胞分泌GLP-1[31],在本研究中空腹血糖、胰岛素的变化差异与GLP-1的变化值无相关性,因此安慰剂对照组的GLP-1水平升高可能与健康生活方式转变有关。
综上所述,初发T2DM患者常伴有肠道菌群失调,盐酸小檗碱可以有效调节肠道菌群紊乱,同时改善初发T2DM患者胰岛素抵抗、调节胃肠激素,且无明显不良事件发生,具有良好的降糖疗效及安全性。但是本研究观察点较少,只对基线水平和干预12周进行评估,且未能连续性观察小檗碱的疗效以及对肠道菌群的影响。因此,后续研究将考虑这些因素,并扩大样本量,通过长程随访以动态观察小檗碱对2型糖尿病的降糖疗效及安全性,为临床决策提供依据。

