外周血常见炎症指标与重叠综合征患者合并疾病的关系分析
胡卫华 董明林 胡克 熊梦清
慢性阻塞性肺疾病(COPD)和阻塞性睡眠呼吸暂停(OSA)均为呼吸系统高发疾病,二者合并存在时被称为重叠综合征(OVS)[1]。 OSA 与炎症过程的多种介质水平升高相关[2-3],这些介质的释放常由慢性间歇缺氧触发,也可能与OSA 相关睡眠缺失和碎片化有关[4]。 既往研究表明,OSA 可导致患者血清炎症因子水平升高,包括肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1、活性氧(ROS)、核因子(NF)-κB 等,上述因子参与各种心血管和代谢性疾病如动脉粥样硬化的发展[5]。 Abdel-Fadeil 等[6]的研究表明,TNF-α 和 IL-6与OSA 的严重程度明显相关,并可能参与OSA 患者常见心血管并发症的发病机制。 Macrea 等[7]的研究表明,OVS 患者和单纯COPD 患者外周血中性粒细胞数量有明显差异。 国内研究也表明OSA 患者的多种炎症因子水平明显升高[8-9]。 在经皮冠状动脉介入治疗的冠心病患者中,超敏C 反应蛋白(hs-CRP)与睡眠呼吸暂停低通气指数(AHI)及氧减指数(ODI)均明显相关,中重度OSA 患者hs-CRP 水平明显高于无或轻度OSA 组,且预后更差[10]。 炎症因子对血管内皮的不良影响可能导致与OSA 相关的心血管和代谢紊乱加重。 氧化应该是COPD 与OSA 导致缺血性心脏病共同的重要机制之一。 目前最经典的心血管危险评估工具是弗雷明翰危险评估模型(FRS)[11]。 但由于各地区的心血管危险因素水平不同,我国制定了适合本国的心血管危险评估体系[12]。 我们通过对OVS 患者外周血常见炎症指标进行分析,旨在探讨其外周血炎症指标水平的变化及与常见合并疾病(高血压、糖尿病、冠心病、脑血管疾病)的关系。
对象与方法
1.对象:2017 年 1 月 ~ 2018 年 12 月于我科治疗的稳定期 COPD 患者105 例,其中男92 例,女13 例,年龄 40 ~86 岁,平均年龄(67.10 ±8.37)岁。 纳入标准:(1)年龄≥40 岁;(2)使用支气管扩张剂后第1 秒用力呼气容积(FEV1)/用力肺活量(FVC) <70%[13]。 排除标准:(1)妊娠或哺乳期;(2)合并其他呼吸系统疾病(如支气管扩张、肺纤维化、气道内肿瘤、结核后遗症等);(3)目前有身体任何部位的有症状的急性炎症;(4)口服或静脉使用糖皮质激素、近3 个月内使用吸入糖皮质激素、抗生素、明确干扰血液细胞成分药物;(5)血液系统疾病。 根据睡眠呼吸暂停低通气指数(AHI)将患者分为单纯 COPD 患者(AHI <5 次/小时)27 例(25.71%,单纯 COPD 组)和 OVS 患者 78 例,再将OVS 患者分为合并轻度 OSA 组(5 次/小时≤AHI <15 次/小时)40 例(38.10%)、合并中度 OSA 组(15 次/小时≤AHI < 30 次/小时)29 例(27.62%)及合并重度 OSA 组(AHI≥30 次/小时)9 例(8.57%)。所有患者均签署知情同意书。
2.方法
(1)问卷调查:所有患者均完成COPD 患者睡眠呼吸监测调查问卷,问卷内容包括性别、年龄、身高、体重、吸烟量和时间、是否有高血压、糖尿病、脑梗死、心绞痛或明确诊断为冠心病病史。
(2)国人缺血性心血管疾病(ICVD)10 年发病风险评估表:该表基于7 项主要ICVD 危险因素(性别、年龄、收缩压、BMI、总胆固醇(TC)、糖尿病及吸烟指数),总分数即为10 年ICVD 发病风险评分;发病绝对危险分层:<5%为极低危,5% ~9%为低危,10% ~19%为中危,20% ~39%为高危,≥40%为极高危[12]。 吸烟指数=每天吸烟量(支) ×吸烟时间(年)。
(3)肺功能检查和睡眠呼吸监测:采用德国耶格MasterScreen body 肺功能检测仪测量患者使用支气管扩张剂后的FEV1和FVC,计算FEV1/FVC。 每位患者均在标准睡眠呼吸监测睡眠室完成整夜(≥7 小时/晚)标准多导睡眠呼吸监测,然后分析其结果,包括AHI、最低血氧饱和度,根据美国睡眠医学会《睡眠及相关事件AASM 判读手册-规则、术语和技术规范》对睡眠相关呼吸事件进行判读[14]。
(4)炎症指标检测:于睡眠呼吸监测次日清晨抽取患者空腹静脉血,检测常见炎症指标,包括WBC 计数、中性粒细胞百分比(PPN%)、淋巴细胞百分比(LYM%)、中性粒细胞计数/淋巴细胞计数(NRL)、降钙素原(PCT)、hs-CRP 及 CRP。
3.统计学处理:应用SPSS 21.0 软件进行统计分析。 符合正态分布的计量资料以表示,两组间比较采用t检验,多组间比较采用单因素方差分析;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料以例数和百分比表示,组间比较采用χ2检验。 连续性变量之间的关系评估采用线性相关分析,二分类变量与分类变量及连续性变量之间的关系评估采用logistic回归分析。 以P<0.05 为差异有统计学意义。
结 果
1.4 组患者一般资料比较:4 组患者性别、年龄、吸烟指数、收缩压、TC、合并疾病及国人ICVD 10 年发病风险比较差异均无统计学意义(P>0.05),而BMI、颈围比较差异有统计学意义(P<0.05),其中合并中度OSA 组和合并重度OSA 组患者BMI 均高于合并轻度OSA 组,合并重度OSA 组患者颈围高于单纯COPD 组和合并轻度OSA 组,差异均有统计学意义(P<0.05)。见表1。
表1 4 组患者一般资料比较()
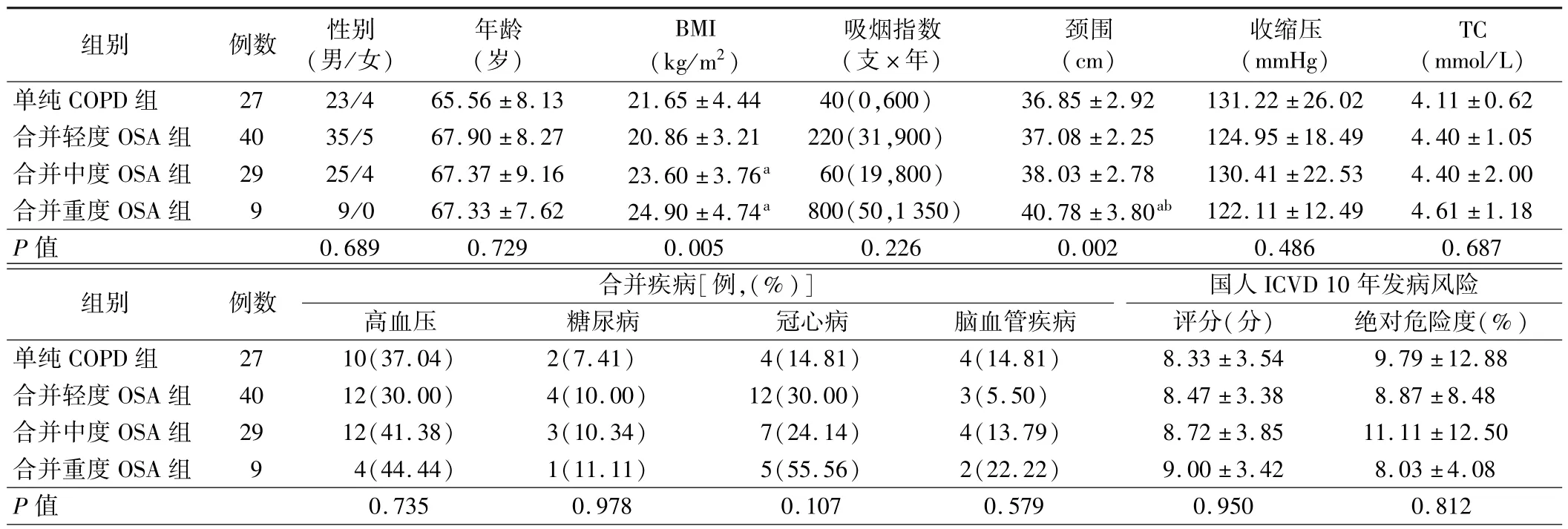
表1 4 组患者一般资料比较()
注:与合并轻度 OSA 组比较,aP <0.05;与单纯 COPD 组比较,bP <0.05
组别 例数 性别(男/女)年龄(岁)BMI(kg/m2)吸烟指数(支×年)颈围(cm)收缩压(mmHg)TC(mmol/L)单纯 COPD 组 27 23/4 65.56 ± 8.13 21.65 ± 4.44 40(0,600) 36.85 ± 2.92 131.22 ± 26.02 4.11 ± 0.62合并轻度 OSA 组 40 35/5 67.90 ±8.27 20.86 ±3.21 220(31,900) 37.08 ±2.25 124.95 ±18.49 4.40 ±1.05合并中度 OSA 组 29 25/4 67.37 ±9.16 23.60 ±3.76a 60(19,800) 38.03 ±2.78 130.41 ±22.53 4.40 ±2.00合并重度 OSA 组 9 9/0 67.33 ±7.62 24.90 ±4.74a 800(50,1 350) 40.78 ±3.80ab 122.11 ±12.49 4.61 ±1.18 P 值 0.689 0.729 0.005 0.226 0.002 0.486 0.687组别 例数 合并疾病[例,(%)]高血压 糖尿病 冠心病 脑血管疾病国人ICVD 10 年发病风险评分(分) 绝对危险度(%)单纯 COPD 组 27 10(37.04) 2(7.41) 4(14.81) 4(14.81) 8.33 ±3.54 9.79 ± 12.88合并轻度 OSA 组 40 12(30.00) 4(10.00) 12(30.00) 3(5.50) 8.47 ±3.38 8.87 ± 8.48合并中度 OSA 组 29 12(41.38) 3(10.34) 7(24.14) 4(13.79) 8.72 ±3.85 11.11 ± 12.50合并重度 OSA 组 9 4(44.44) 1(11.11) 5(55.56) 2(22.22) 9.00 ±3.42 8.03 ± 4.08 P 值 0.735 0.978 0.107 0.579 0.950 0.812
表2 4 组患者肺功能及睡眠呼吸指标比较()
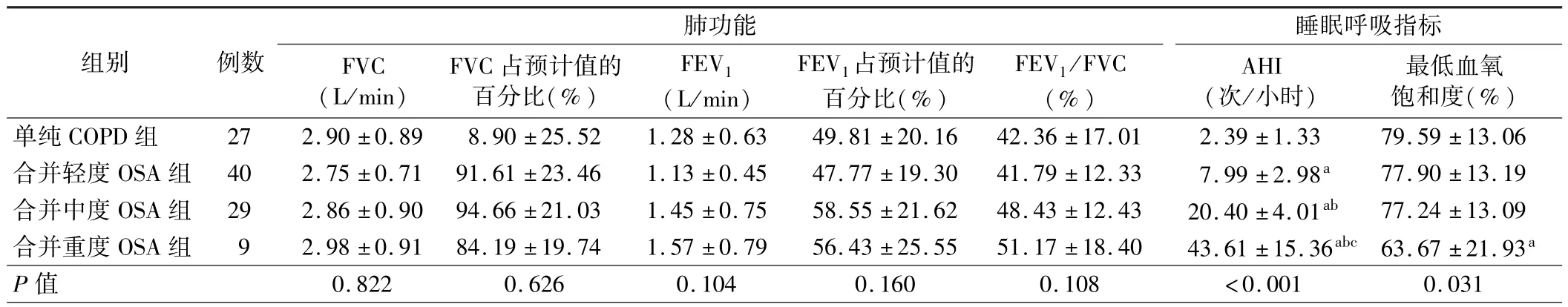
表2 4 组患者肺功能及睡眠呼吸指标比较()
注:与单纯 COPD 组比较,aP <0.05;与合并轻度 OSA 组比较,bP <0.05;与合并中度 OSA 组比较,cP <0.05
组别 例数肺功能FVC(L/min)FVC 占预计值的百分比(%)FEV1(L/min)FEV1占预计值的百分比(%)FEV1/FVC(%)睡眠呼吸指标AHI(次/小时)最低血氧饱和度(%)单纯 COPD 组 27 2.90 ± 0.89 8.90 ± 25.52 1.28 ± 0.63 49.81 ± 20.16 42.36 ± 17.01 2.39 ± 1.33 79.59 ± 13.06合并轻度 OSA 组 40 2.75 ±0.71 91.61 ±23.46 1.13 ±0.45 47.77 ±19.30 41.79 ±12.33 7.99 ±2.98a 77.90 ±13.19合并中度 OSA 组 29 2.86 ±0.90 94.66 ±21.03 1.45 ±0.75 58.55 ±21.62 48.43 ±12.43 20.40 ±4.01ab 77.24 ±13.09合并重度 OSA 组 9 2.98 ±0.91 84.19 ±19.74 1.57 ±0.79 56.43 ±25.55 51.17 ±18.40 43.61 ±15.36abc 63.67 ±21.93a P 值 0.822 0.626 0.104 0.160 0.108 <0.001 0.031
表3 4 组患者外周血炎症指标水平比较()
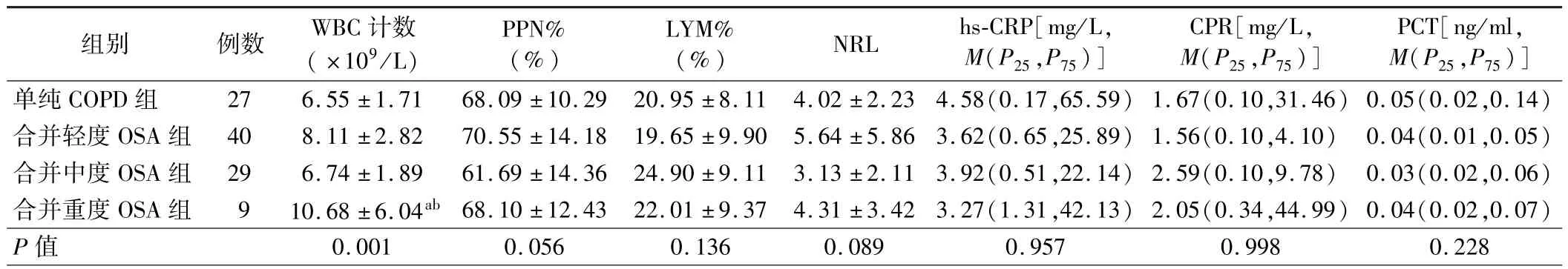
表3 4 组患者外周血炎症指标水平比较()
注:与单纯 COPD 组比较,aP <0.05;与合并中度 OSA 组比较,bP <0.05
组别 例数 WBC 计数( ×109/L)PPN%(%)LYM%(%) NRL hs-CRP[mg/L,M(P25,P75)]CPR[mg/L,M(P25,P75)]PCT[ng/ml,M(P25,P75)]单纯 COPD 组 27 6.55 ±1.71 68.09 ±10.29 20.95 ± 8.11 4.02 ±2.23 4.58(0.17,65.59) 1.67(0.10,31.46) 0.05(0.02,0.14)合并轻度 OSA 组 40 8.11 ±2.82 70.55 ±14.18 19.65 ±9.90 5.64 ±5.86 3.62(0.65,25.89) 1.56(0.10,4.10) 0.04(0.01,0.05)合并中度 OSA 组 29 6.74 ±1.89 61.69 ±14.36 24.90 ±9.11 3.13 ±2.11 3.92(0.51,22.14) 2.59(0.10,9.78) 0.03(0.02,0.06)合并重度 OSA 组 9 10.68 ±6.04ab 68.10 ±12.43 22.01 ±9.37 4.31 ±3.42 3.27(1.31,42.13) 2.05(0.34,44.99) 0.04(0.02,0.07)P 值 0.001 0.056 0.136 0.089 0.957 0.998 0.228
2.4 组患者肺功能及睡眠呼吸指标比较:4 组患者 FVC、FVC 占预计值的百分比、FEV1、FEV1占预计值的百分比及FEV1/FVC 比较差异均无统计学意义(P>0.05),而AHI 及最低血氧饱和度比较差异均有统计学意义(P<0.05),其中合并重度OSA 组患者最低血氧饱和度低于单纯COPD 组,差异有统计学意义(P<0.05)。 见表 2。
3.4 组患者外周血炎症指标水平比较:4 组患者PPN%、LYM%、NRL、hs-CRP、CPR 及 PCT 比较差异均无统计学意义(P>0.05),而外周血WBC 计数比较差异有统计学意义(P<0.05),其中合并重度OSA 组患者外周血WBC 计数高于单纯COPD 组和合并中度OSA 组,差异均有统计学意义(P<0.05)。 见表 3。
4.OVS 患者各合并疾病与外周血WBC 计数的相关性:二元logistic回归分析结果显示,OVS 患者外周血WBC 计数与冠心病的患病率呈正相关(P<0.05),校正性别、年龄、颈围、BMI 混杂因素后仍呈正相关(P<0.05),而外周血WBC 计数与高血压、糖尿病、脑血管疾病均无相关性(P>0.05)。 见表4。
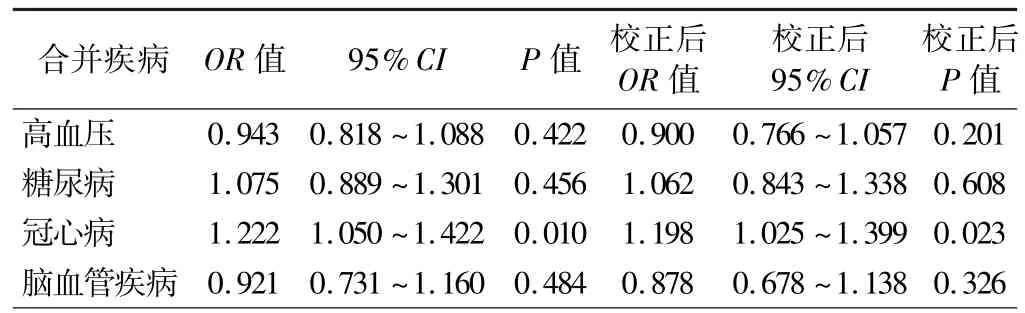
表4 OVS 患者外周血WBC 计数与各合并疾病的相关性
5.OVS 患者外周血WBC 计数与国人ICVD 10 年发病风险的相关性分析:线性相关分析结果显示,OVS 患者外周血WBC 计数与国人ICVD 10 年发病风险评分呈弱正相关(r=0. 277,P=0. 004),与国人ICVD 10 年发病风险绝对危险度无相关性(r=0.066,P=0.505)。
讨 论
OSA 是以反复发生的睡眠呼吸停止及睡眠片段化为主要特点的睡眠障碍性疾病,反复睡眠呼吸暂停导致低氧、再氧合的交替,这与缺血再灌注的情况类似,在此过程中产生大量的ROS 及炎症因子[15-16]。 虽然低氧对机体的危害程度远不及缺血再灌注,但这种频繁的低氧、再氧合的交替过程每晚可发生数百次之多,持续数十年之久。 而低氧产生的大量氧化因子和炎症因子反复刺激血管内皮及全身多个脏器,可引起严重的低氧血症及睡眠紊乱,与高血压、心律失常、心脑血管疾病及呼吸衰竭等疾病的发生密切相关。
本研究对OVS 患者临床上最常见的炎症指标如外周血WBC 计数、PPN%、CRP、hs-CRP 等进行分析,发现4 组患者外周血WBC 计数比较差异有统计学意义,进一步两两比较发现合并重度OSA 组患者外周血WBC 计数明显高于单纯 COPD 组及合并中度 OSA组,这与Madjid 等[17]的研究结果相似,其通过系统性分析相关领域的文章发现,红细胞压积、ESR 与WBC计数相结合可提高预测冠心病风险的能力,红细胞压积、ESR 等也与冠心病的发病率相关。 WBC 计数是判断机体炎症程度的敏感指标,也是临床最常用、获取方式便捷的指标,且检测价格低廉。 本研究结果提示,WBC 计数可能成为OSA 患者心血管疾病的预测指标。 本研究尚未发现 PPN%、CRP、hs-CRP 等在单纯COPD 患者与 OVS 患者间的差异,这与 Macrea等[7]的研究结果相似。
本研究中二元logistic回归分析结果显示,OVS 患者外周血WBC 计数与冠心病的患病率呈正相关,提示外周血WBC 计数可部分预测OVS 患者缺血性心脏病的发病风险。 此外,WBC 计数与国人ICVD 10 年发病风险的相关性分析结果显示,OVS 患者WBC 计数与国人ICVD 10 年发病风险评分呈弱正相关,与国人ICVD 10 年发病风险绝对危险度无相关性,提示WBC计数和国人ICVD 10 年发病风险评分对ICVD 的预测存在差异。 但本研究样本量较小,尚需扩大样本量进一步证实。
COPD 和OSA 是呼吸系统的两大类疾病,合并疾病较多,而冠心病是全球致死率最高的疾病之一,越来越多的研究证明此三类疾病之间通过复杂的机制相关联,尤其是炎症机制,而对于各种机制的探索还远远不够,阐明各炎症因子在COPD、OSA 及ICVD 中的相互作用需要更多研究深入探讨。

